Содержание
Первый вздох: Адаптация дыхательной системы новорожденного
Неонатальный период новорожденных — это захватывающее время, полное удивительных изменений и стремительного развития. Представьте себе: крошечное существо, которое провело девять месяцев в уютном водном мире, вдруг оказывается в совершенно новой среде. Как же малыш справляется с этим колоссальным переходом? Давайте нырнем в этот удивительный процесс и разберемся, что происходит с дыхательной системой новорожденного в первые мгновения жизни.
Когда малыш делает свой первый вдох, это похоже на запуск сложнейшего механизма. Представьте, что вы открываете двери старинного замка — сначала с трудом, но потом механизм начинает работать все легче и легче. Так и легкие новорожденного, которые до этого момента были заполнены жидкостью, начинают расправляться и наполняться воздухом. Это не просто физический процесс — это настоящее чудо природы!
Но как же организм малыша понимает, что пора начать дышать? Тут в игру вступают сложные биохимические процессы. Представьте, что в теле ребенка есть маленькие датчики, которые постоянно следят за уровнем кислорода и углекислого газа в крови. Как только малыш покидает утробу матери, эти датчики начинают сходить с ума — уровень кислорода падает, а углекислого газа растет. И вот тут-то и срабатывает сигнал тревоги, который заставляет дыхательный центр в мозге активироваться и дать команду: «Дышать!»
Сурфактант: невидимый помощник
Но одного желания дышать недостаточно. Тут на помощь приходит удивительное вещество — сурфактант. Это как волшебное масло, которое помогает легким расправиться и не слипаться при выдохе. Без сурфактанта дышать было бы так же сложно, как пытаться надуть жевательную резинку в огромный пузырь — попробуйте, и вы поймете, насколько это непросто!
Интересно, что организм малыша начинает производить сурфактант еще до рождения, примерно на 24-й неделе беременности. К моменту родов его количество достигает пика, что позволяет легким новорожденного успешно начать свою работу. Это как если бы природа заранее подготовила смазку для всех шестеренок в механизме дыхания.
Кислородный квест: от первого вдоха к стабильному дыханию
Первые несколько часов после рождения — это настоящий кислородный квест для малыша. Его организм учится поддерживать стабильный уровень кислорода в крови, и это не так-то просто. Представьте, что вы пытаетесь удержать равновесие на качающейся лодке — вот так же и организм новорожденного балансирует, пытаясь найти оптимальный ритм дыхания.
В этот период частота дыхания у новорожденного может достигать 40-60 вдохов в минуту — это почти вдвое быстрее, чем у взрослого человека! Такая частота дыхания необходима, чтобы компенсировать меньший объем легких и обеспечить достаточное поступление кислорода. Это как если бы вы пытались наполнить большой бассейн, используя маленькое ведерко — приходится работать быстрее, чтобы добиться результата.
Неонатальный период: время больших перемен
Неонатальный период новорожденных — это не только про дыхание. Это время, когда все системы организма малыша проходят через серьезную перестройку. Кровеносная система меняет свою конфигурацию, закрывая фетальные коммуникации, которые были необходимы во время внутриутробного развития. Пищеварительная система начинает свою работу, привыкая к новому типу питания. Иммунная система активно формируется, получая первые «уроки» от окружающего мира.
Но вернемся к дыханию. В течение первых недель жизни дыхательная система продолжает совершенствоваться. Альвеолы — крошечные воздушные мешочки в легких — увеличиваются в размерах и количестве, что повышает эффективность газообмена. Это похоже на то, как если бы внутри легких постоянно надувались новые воздушные шарики, увеличивая площадь поверхности для обмена кислородом.
Чудеса адаптации: от воды к воздуху
Одним из самых удивительных аспектов неонатального периода является то, как быстро организм малыша адаптируется к жизни в воздушной среде. Подумайте об этом: девять месяцев ребенок получал кислород через плаценту, а теперь ему нужно самостоятельно извлекать его из воздуха. Это все равно что перейти от подводного плавания к бегу марафона — кардинальная смена условий!

Интересно, что у некоторых новорожденных могут наблюдаться кратковременные эпизоды апноэ — остановки дыхания. Это может звучать пугающе, но на самом деле это часть нормального процесса адаптации. Представьте, что вы учитесь ездить на велосипеде — иногда вы можете потерять равновесие, но это не значит, что вы не научитесь ездить. Точно так же и дыхательная система новорожденного может иногда «спотыкаться», но быстро восстанавливает свой ритм.
Роль окружающей среды в адаптации новорожденного
Неонатальный период новорожденных — это не только внутренние процессы, но и активное взаимодействие с окружающей средой. Температура, влажность, качество воздуха — все это играет огромную роль в том, как быстро и успешно малыш адаптируется к новым условиям. Это как если бы космонавт высадился на новую планету — каждый аспект окружающей среды имеет значение!
Исследования показывают, что оптимальная температура воздуха для новорожденного составляет около 24-26°C. При этом важно избегать перегрева, так как это может привести к учащению дыхания и дополнительной нагрузке на еще не окрепшую дыхательную систему. Влажность воздуха также играет важную роль — слишком сухой воздух может раздражать нежные дыхательные пути малыша, а слишком влажный — затруднять испарение и теплоотдачу.
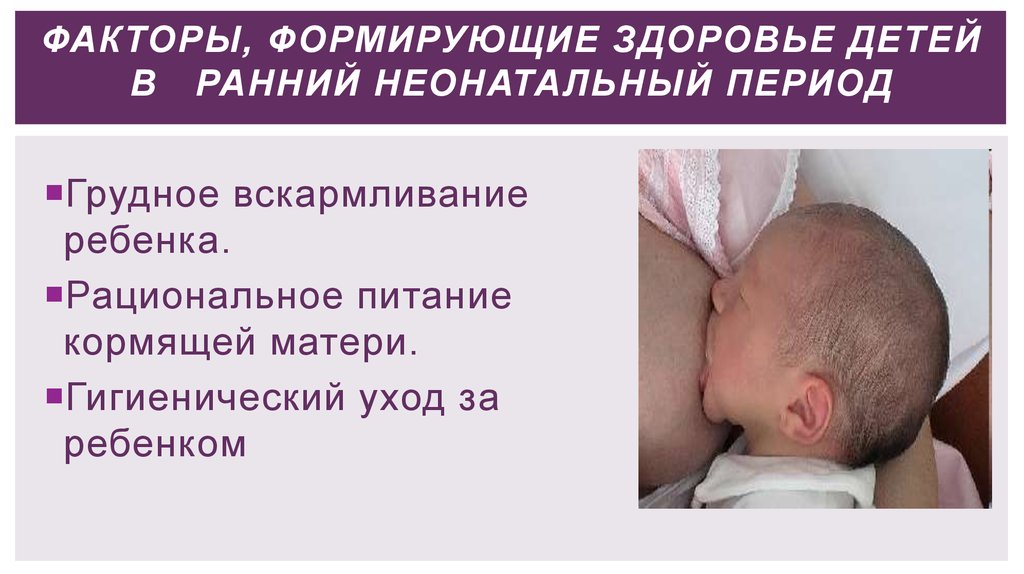
Грудное вскармливание и дыхательная система
Интересно, что грудное вскармливание играет важную роль в развитии дыхательной системы новорожденного. Когда малыш сосет грудь, он не только получает питание, но и тренирует мышцы, участвующие в дыхании. Это как своеобразная гимнастика для дыхательной системы! Более того, молозиво и грудное молоко содержат факторы, которые помогают укрепить иммунитет и защитить дыхательные пути от инфекций.
Исследования показывают, что дети на грудном вскармливании имеют более низкий риск развития респираторных заболеваний в неонатальном периоде и в дальнейшей жизни. Это еще один аргумент в пользу того, что природа продумала все до мелочей!
Мониторинг дыхания: ключ к спокойствию родителей
В неонатальный период новорожденных особенно важно внимательно следить за дыханием малыша. Современные технологии предлагают различные устройства для мониторинга дыхания, которые могут помочь родителям чувствовать себя спокойнее. Но не стоит забывать, что самый лучший «монитор» — это внимательный родитель. Наблюдение за цветом кожи, движениями грудной клетки, общим состоянием ребенка может дать гораздо больше информации, чем самый высокотехнологичный прибор.

Помните, что небольшие паузы в дыхании, легкие всхрапывания или посапывания — это нормальные явления для новорожденного. Его дыхательная система все еще учится работать в новом режиме, и некоторые «шероховатости» в этом процессе вполне естественны. Это как если бы вы слушали, как настраивается оркестр перед концертом — иногда можно услышать странные звуки, но в итоге все инструменты сливаются в прекрасную мелодию.
Грудное вскармливание: Основа иммунитета и правильного развития
Неонатальный период новорожденных — это время, когда грудное вскармливание играет ключевую роль в формировании здоровья малыша. Представьте себе, что материнское молоко — это не просто питание, а настоящий эликсир жизни, созданный природой специально для каждого конкретного ребенка. Удивительно, но состав грудного молока меняется не только в течение дня, но и на протяжении всего периода лактации, идеально подстраиваясь под потребности растущего организма.
Молозиво — первое «золото» для новорожденного. Эта густая желтоватая жидкость, которая вырабатывается в первые дни после родов, буквально напичкана антителами и факторами роста. Это как если бы природа создала концентрированный коктейль из всего самого необходимого для старта жизни. Молозиво содержит в пять раз больше белка, чем зрелое грудное молоко, а также богато витамином А и иммуноглобулинами.
Иммунная система: строительство крепости
Грудное молоко — это не только питание, но и мощный иммуномодулятор. В нем содержатся живые клетки иммунной системы матери, которые помогают малышу бороться с инфекциями. Это похоже на то, как если бы мама отправляла в организм ребенка целую армию защитников. Лактоферрин, лизоцим, секреторный IgA — эти компоненты грудного молока создают барьер против патогенов в кишечнике и дыхательных путях новорожденного.
Исследования показывают, что дети на грудном вскармливании реже страдают от респираторных и кишечных инфекций в неонатальный период. Но это не все! Грудное вскармливание также снижает риск развития аллергий, ожирения и даже некоторых онкологических заболеваний в будущем. Разве это не удивительно, как природа позаботилась о долгосрочном здоровье малыша?
Микробиом: невидимые друзья
Неонатальный период новорожденных — это время формирования микробиома кишечника. И тут грудное молоко играет роль дирижера, управляющего огромным оркестром бактерий. Олигосахариды грудного молока (ОГМ) — это особые углеводы, которые не перевариваются организмом ребенка, но служат пищей для полезных бактерий. Это как если бы мама отправляла в организм малыша специальный корм для его микроскопических помощников.
Интересно, что состав ОГМ уникален для каждой женщины и даже может меняться в зависимости от времени суток и состояния здоровья матери. Это показывает, насколько тонко природа настроила механизм грудного вскармливания. Здоровый микробиом не только улучшает пищеварение, но и влияет на развитие иммунной и нервной систем ребенка.
Нейроразвитие: пища для мозга
Грудное молоко содержит идеальное соотношение жиров, необходимых для развития мозга новорожденного. Длинноцепочечные полиненасыщенные жирные кислоты, такие как DHA и ARA, играют критическую роль в формировании нейронных связей. Это как если бы мама обеспечивала малыша строительным материалом для его нейронной сети.
Исследования показывают, что дети на грудном вскармливании имеют более высокие показатели когнитивного развития в долгосрочной перспективе. Но дело не только в составе молока. Сам процесс кормления грудью стимулирует развитие мозга через тактильный контакт, зрительное взаимодействие и эмоциональную связь между матерью и ребенком.
Эндокринная система: тонкая настройка
Неонатальный период новорожденных — это время, когда эндокринная система малыша проходит сложный процесс адаптации к внеутробной жизни. И тут грудное молоко снова приходит на помощь. Оно содержит гормоны и факторы роста, которые помогают регулировать метаболизм ребенка. Например, лептин в грудном молоке участвует в регуляции аппетита и обмена веществ, что может играть роль в профилактике ожирения в будущем.
Кортизол в грудном молоке помогает регулировать циркадные ритмы ребенка. Это как если бы мама передавала малышу свои биологические часы, помогая ему настроиться на правильный режим сна и бодрствования. Удивительно, но уровень кортизола в грудном молоке меняется в течение дня, что еще раз подчеркивает, насколько тонко природа настроила этот механизм.

Аллергии: профилактика с первых дней
Грудное вскармливание играет важную роль в профилактике аллергических заболеваний. Секреторный IgA в грудном молоке помогает «запечатать» кишечник ребенка, предотвращая проникновение потенциальных аллергенов в кровоток. Это как если бы мама создавала защитную пленку на внутренней поверхности кишечника малыша.
Интересно, что если мать потребляет разнообразную пищу во время лактации, то микродозы различных пищевых белков попадают в грудное молоко. Это может помочь ребенку развить толерантность к различным продуктам. Однако, этот вопрос все еще остается предметом научных дискуссий, и не все исследователи согласны с этой теорией.
Психоэмоциональное развитие: больше, чем питание
Неонатальный период новорожденных — это не только физическое, но и психоэмоциональное становление. Грудное вскармливание создает особую связь между матерью и ребенком, способствуя формированию здоровой привязанности. Окситоцин, выделяющийся у матери во время кормления, помогает ей чувствовать себя спокойнее и увереннее, что передается и ребенку.
Исследования показывают, что дети на грудном вскармливании демонстрируют более низкий уровень стресса в ситуациях разлучения с матерью. Это как если бы грудное вскармливание создавало невидимую эмоциональную нить, связывающую мать и дитя даже на расстоянии.
Вызовы грудного вскармливания
Несмотря на все преимущества, грудное вскармливание может быть связано с определенными трудностями. Болезненность сосков, мастит, недостаточная выработка молока — эти проблемы могут возникнуть в неонатальный период новорожденных и стать серьезным испытанием для матери. Важно помнить, что большинство этих проблем решаемы при правильном подходе и поддержке специалистов.
Интересно, что некоторые исследования указывают на возможную связь между длительным грудным вскармливанием и повышенным риском кариеса у детей. Однако, этот риск может быть минимизирован при правильной гигиене полости рта ребенка. Это напоминает нам, что даже в таком идеальном процессе, как грудное вскармливание, важно соблюдать баланс и быть внимательным к деталям.

Альтернативы и дополнения
В некоторых случаях грудное вскармливание может быть невозможно или недостаточно. Современные смеси для искусственного вскармливания разработаны с учетом потребностей новорожденных и могут быть хорошей альтернативой. Некоторые смеси даже обогащены пробиотиками и пребиотиками, пытаясь имитировать благотворное влияние грудного молока на микробиом.
Донорское молоко также может быть опцией для недоношенных детей или в случаях, когда мать не может кормить грудью. Банки грудного молока проводят тщательный скрининг доноров и пастеризацию молока, обеспечивая его безопасность. Хотя пастеризованное донорское молоко теряет некоторые живые компоненты, оно все равно сохраняет многие ценные свойства и может быть лучшим выбором, чем искусственная смесь, особенно для уязвимых новорожденных.
Сон и бодрствование: Формирование режима дня младенца
Неонатальный период новорожденных — это время, когда малыш впервые сталкивается с понятием режима дня. Представьте себе, что мозг новорожденного — это как новенький компьютер, который только учится работать с операционной системой под названием «Жизнь». И одна из первых программ, которую он должен освоить, — это чередование сна и бодрствования.
В первые дни жизни сон новорожденного кажется хаотичным. Малыш может спать до 20 часов в сутки, просыпаясь каждые 2-3 часа для кормления. Это похоже на работу в режиме энергосбережения — организм концентрируется на самом важном: еде и росте. Но не стоит думать, что во время сна мозг отдыхает. Напротив, это время активной обработки информации и формирования нейронных связей.
Циркадные ритмы: настройка внутренних часов
Циркадные ритмы — это наш внутренний 24-часовой цикл, который регулирует множество физиологических процессов, включая сон-бодрствование. У новорожденных эта система еще не сформирована. Это как если бы у малыша были часы, но без стрелок — механизм есть, а показывать время еще не может.
Интересно, что формирование циркадных ритмов начинается еще до рождения, но полностью этот процесс завершается только к 3-4 месяцам жизни. В неонатальный период новорожденных ключевую роль в этом процессе играет мелатонин — гормон сна, который малыш получает с грудным молоком. Уровень мелатонина в молоке матери меняется в течение суток, помогая настроить биологические часы ребенка.

Фазы сна: мини-циклы в действии
Сон новорожденного существенно отличается от сна взрослого. Он состоит из коротких циклов, длящихся около 50-60 минут, в отличие от 90-минутных циклов у взрослых. Каждый цикл включает в себя фазу активного (REM) и спокойного (non-REM) сна. Это похоже на американские горки — малыш то погружается в глубокий сон, то почти просыпается.
В неонатальный период новорожденных доля активного сна необычайно высока — до 50% всего времени сна. Для сравнения, у взрослых эта фаза занимает лишь 20-25% сна. Почему так происходит? Активный сон критически важен для развития мозга. Это время, когда формируются новые нейронные связи, обрабатывается полученная информация. Можно сказать, что во время активного сна мозг малыша работает на полную мощность, подготавливаясь к новому дню открытий.
Режим кормления: дирижер сна
В первые недели жизни режим сна новорожденного тесно связан с режимом кормления. Маленький желудок быстро переваривает молоко, и малыш просыпается голодным каждые 2-3 часа. Это как если бы у ребенка был встроенный будильник, настроенный на сигнал «Пора есть!».
Интересно, что грудное вскармливание может влиять на паттерны сна. Исследования показывают, что дети на грудном вскармливании чаще просыпаются ночью, чем те, кто находится на искусственном вскармливании. Это может быть связано с более быстрым усвоением грудного молока. Однако, несмотря на частые пробуждения, общее качество сна у детей на грудном вскармливании часто лучше.
Дневной сон: фундамент ночного отдыха
Может показаться парадоксальным, но хороший дневной сон — это ключ к спокойным ночам. В неонатальный период новорожденных малыш еще не может долго бодрствовать. Оптимальное время бодрствования для новорожденного — всего 45-60 минут. После этого ребенок начинает уставать и может стать раздражительным.
Представьте, что энергия малыша — это как песок в песочных часах. Каждую минуту бодрствования песчинки падают вниз. Задача родителей — перевернуть часы (уложить малыша спать) до того, как весь песок пересыплется. Если этого не сделать, ребенок может «перегулять» и, парадоксально, будет труднее уснуть.

Создание благоприятной среды для сна
Окружающая среда играет важную роль в формировании здоровых привычек сна. В неонатальный период новорожденных малыш особенно чувствителен к внешним стимулам. Темнота, тишина (или мягкий белый шум), комфортная температура — все это помогает создать идеальные условия для сна.
Интересно, что некоторые исследования показывают пользу «гнездования» — создания уютного, ограниченного пространства для сна новорожденного. Это напоминает малышу о безопасности материнской утробы и может способствовать более глубокому и спокойному сну.
Метод «пеленания»: за и против
Пеленание — это древняя практика, которая в последние годы переживает второе рождение. Суть метода в том, чтобы плотно завернуть малыша в ткань, ограничивая движения рук и ног. Это как если бы вы создавали для ребенка подобие кокона, напоминающего о внутриутробной жизни.
Сторонники метода утверждают, что пеленание помогает успокоить ребенка и улучшить качество сна. Действительно, некоторые исследования показывают, что запеленатые дети спят дольше и просыпаются реже. Однако у этого метода есть и критики. Они указывают на потенциальные риски, такие как перегрев или нарушение развития тазобедренных суставов при неправильном пеленании.
Совместный сон: близость vs. независимость
Вопрос о том, где должен спать новорожденный, вызывает горячие дебаты. Совместный сон с родителями или отдельная кроватка? У каждого варианта есть свои плюсы и минусы. Совместный сон облегчает ночные кормления и может способствовать более крепкой эмоциональной связи между родителями и ребенком. С другой стороны, отдельный сон может помочь малышу раньше научиться засыпать самостоятельно.
Интересно, что в разных культурах к этому вопросу подходят по-разному. В некоторых странах совместный сон — это норма, в то время как в других это считается небезопасной практикой. Важно помнить, что какой бы вариант вы ни выбрали, безопасность ребенка должна быть на первом месте.
Режим дня: постепенное формирование
В неонатальный период новорожденных говорить о строгом режиме дня еще рано. Однако, можно начать закладывать его основы. Регулярные ритуалы перед сном, кормление в одно и то же время, ежедневные прогулки на свежем воздухе — все это помогает малышу постепенно освоиться в мире, где день сменяет ночь.
Представьте, что вы дирижер, а ежедневные активности — это музыканты в вашем оркестре. Ваша задача — не заставить всех играть идеально с первого раза, а постепенно настроить инструменты и добиться гармонии. Со временем, эта симфония повседневной жизни станет привычной и комфортной для малыша.
Индивидуальные особенности: каждый малыш уникален
Важно помнить, что каждый ребенок уникален. То, что работает для одного малыша, может не подойти другому. Некоторые дети от природы «совы» и предпочитают поздно ложиться, другие — «жаворонки». Некоторым нужно больше сна, чем среднестатистическому ребенку, другим — меньше.
В неонатальный период новорожденных задача родителей — не заставить ребенка соответствовать некоему идеальному стандарту, а наблюдать, прислушиваться к потребностям малыша и постепенно формировать режим, который подходит именно вашей семье. Это как если бы вы были садовником, который не пытается вырастить все цветы одинаковой формы и размера, а создает уникальный, гармоничный сад, учитывая особенности каждого растения.
Рефлексы новорожденного: Врожденные механизмы выживания
Неонатальный период новорожденных — это время, когда малыш демонстрирует удивительный набор врожденных рефлексов. Эти автоматические реакции можно сравнить с встроенным программным обеспечением, которое помогает крохе выжить в новом, незнакомом мире. Представьте себе, что рефлексы — это как набор инструментов, которые природа дала малышу для старта жизни. Некоторые из них исчезнут через несколько месяцев, уступив место осознанным движениям, другие останутся с нами на всю жизнь.
Сосательный рефлекс: первый шаг к выживанию
Сосательный рефлекс — это, пожалуй, самый важный из всех рефлексов новорожденного. Он активируется, когда что-то касается нёба малыша, заставляя его инстинктивно начать сосательные движения. Это как если бы в мозгу ребенка была кнопка «Еда!», которая автоматически нажимается при правильной стимуляции. Интересно, что этот рефлекс начинает формироваться еще в утробе матери — вот почему многие дети сосут палец еще до рождения.

В неонатальный период новорожденных сосательный рефлекс играет ключевую роль не только в питании, но и в успокоении малыша. Вот почему соска-пустышка может быть таким эффективным инструментом для утешения плачущего ребенка. Однако, стоит помнить, что чрезмерное использование пустышки может иметь негативные последствия для формирования прикуса и развития речи в будущем.
Поисковый рефлекс: в поисках источника пищи
Поисковый рефлекс тесно связан с сосательным и помогает новорожденному найти грудь матери. Если погладить щеку малыша, он повернет головку в эту сторону и откроет ротик, готовясь к кормлению. Это похоже на встроенный GPS-навигатор, который ведет ребенка к источнику питания. Забавно наблюдать, как малыш может «искать» грудь, даже когда его держат на руках папа или бабушка!
Интересно, что интенсивность поискового рефлекса может варьироваться в зависимости от того, насколько голоден ребенок. Сытый малыш может слабо реагировать на стимуляцию щеки, в то время как голодный будет активно поворачивать головку и открывать рот. Это показывает, как тесно рефлексы связаны с физиологическими потребностями ребенка в неонатальный период новорожденных.
Хватательный рефлекс: крепкая хватка
Хватательный рефлекс — это удивительная способность новорожденного крепко сжимать пальцы вокруг предмета, который касается его ладони. Сила этой хватки может быть настолько велика, что некоторые малыши способны удержать собственный вес, вися на пальцах взрослого! Конечно, не стоит проверять это на практике, но сам факт впечатляет, не правда ли?
Этот рефлекс — наследие наших далеких предков-приматов, для которых способность крепко держаться за шерсть матери была вопросом выживания. В современном мире хватательный рефлекс помогает развитию мелкой моторики и координации движений. Постепенно, в течение первых месяцев жизни, этот рефлекс ослабевает, уступая место осознанному хватанию предметов.
Рефлекс Моро: инстинкт самосохранения
Рефлекс Моро, или рефлекс испуга, — это, пожалуй, самая драматичная реакция новорожденного. При внезапном изменении положения тела или громком звуке малыш резко разводит ручки и ножки, а затем сводит их обратно, как будто пытается обхватить себя. Это выглядит так, словно ребенок пытается ухватиться за что-то в воздухе, чтобы не упасть.

Этот рефлекс считается примитивным инстинктом самосохранения. В природе он мог бы помочь детенышу уцепиться за мать при опасности падения. В современном мире рефлекс Моро может быть причиной частых пробуждений малыша, особенно в первые недели жизни. Вот почему многие педиатры рекомендуют тугое пеленание — оно помогает сдерживать этот рефлекс и обеспечивает малышу чувство безопасности, напоминающее о пребывании в утробе.
Рефлекс Бабинского: загадка эволюции
Рефлекс Бабинского — это реакция, при которой большой палец ноги отклоняется вверх, а остальные пальцы веерообразно расходятся при раздражении подошвы. У взрослых этот рефлекс отсутствует и его появление может указывать на неврологические проблемы. Но у новорожденных это совершенно нормальное явление.
Интересно, что точная функция этого рефлекса до сих пор остается загадкой для ученых. Некоторые предполагают, что он может быть связан с развитием навыков ходьбы, другие считают его просто побочным продуктом незрелости нервной системы. В любом случае, наблюдение за этим рефлексом — важная часть неврологического обследования в неонатальный период новорожденных.
Рефлекс ползания: первые шаги к мобильности
Рефлекс ползания, или рефлекс Бауэра, — это удивительная способность новорожденного делать движения, напоминающие ползание, когда его кладут на живот. Если положить ладони на ступни малыша, он начнет отталкиваться ногами, как будто пытается двигаться вперед. Это выглядит так, словно природа заложила в ребенка «инструкцию» по передвижению еще до того, как он научится это делать сознательно.
Этот рефлекс обычно исчезает к 6 неделям жизни, но он играет важную роль в развитии двигательных навыков. Стимуляция этого рефлекса может помочь укрепить мышцы спины и шеи, что будет полезно для последующего развития навыков переворачивания и ползания. Вот почему педиатры рекомендуют регулярно выкладывать малыша на животик под присмотром взрослых.
Рефлекс шагания: предвестник ходьбы
Рефлекс шагания — это поразительная реакция, когда новорожденный делает шагающие движения, если его держать вертикально, слегка наклонив вперед, так чтобы ступни касались поверхности. Это выглядит так, будто малыш уже готов бежать марафон! Конечно, на самом деле до настоящей ходьбы еще далеко, но этот рефлекс играет важную роль в подготовке к ней.

Интересно, что этот рефлекс обычно исчезает через 1-2 месяца после рождения и возвращается уже в виде осознанного навыка ближе к году. Некоторые исследователи предполагают, что временное исчезновение рефлекса шагания связано с увеличением массы тела ребенка — малышу становится слишком тяжело поднимать ноги в таком положении. Но мозг продолжает «тренироваться», готовясь к моменту, когда мышцы окрепнут достаточно для настоящей ходьбы.
Рефлекс Галанта: загадочная реакция
Рефлекс Галанта — это необычная реакция, когда новорожденный изгибает тело в сторону раздражителя при поглаживании вдоль позвоночника. Этот рефлекс назван в честь нейролога Эрнста Галанта, который впервые описал его в 1917 году. Функция этого рефлекса до конца не ясна, но некоторые специалисты считают, что он может играть роль в развитии двигательных навыков и координации.
В неонатальный период новорожденных рефлекс Галанта может влиять на качество сна малыша. Если ребенок спит на жесткой поверхности, давление на спину может вызывать этот рефлекс, заставляя малыша часто просыпаться. Вот почему некоторые педиатры рекомендуют использовать матрасы средней жесткости для новорожденных.
Асимметричный шейный тонический рефлекс: поза фехтовальщика
Асимметричный шейный тонический рефлекс (АШТР) — это реакция, при которой поворот головы новорожденного в одну сторону вызывает выпрямление руки и ноги с этой стороны, в то время как конечности с противоположной стороны сгибаются. Это положение напоминает позу фехтовальщика, готового к атаке. Забавно, не правда ли?
Этот рефлекс играет важную роль в развитии координации «глаз-рука» и подготовке к переворотам. Однако, если АШТР сохраняется слишком долго (после 6-7 месяцев), это может затруднять развитие навыков ползания и манипуляции с предметами. Вот почему важно следить за развитием рефлексов в неонатальный период новорожденных и обсуждать любые concerns с педиатром.
Уход за пуповинным остатком: Профилактика инфекций
Неонатальный период новорожденных — это время, когда родители сталкиваются с множеством новых задач, и одна из самых важных — уход за пуповинным остатком. Этот маленький кусочек ткани, который когда-то связывал малыша с мамой, теперь требует особого внимания. Представьте себе, что пуповинный остаток — это как последняя страница увлекательной книги под названием «Внутриутробное развитие». Нам нужно аккуратно перевернуть эту страницу, чтобы начать новую главу жизни малыша.

Но почему же уход за пуповиной так важен? Дело в том, что пока пуповинный остаток не отпал, он представляет собой открытые ворота для потенциальных инфекций. Это как незапертая дверь в крепости иммунной системы малыша. Наша задача — надежно охранять эту дверь, пока она естественным образом не закроется.
Сухость — ключ к успеху
Главное правило ухода за пуповинным остатком в неонатальный период новорожденных — это поддержание его в сухом состоянии. Влажная среда — идеальное место для размножения бактерий, поэтому наша цель — сделать пуповину неприветливым местом для микроорганизмов. Как этого добиться? Во-первых, следует избегать полного погружения малыша в воду до тех пор, пока пуповина не отпадет. Это не значит, что нельзя мыть ребенка — просто нужно делать это аккуратно, используя губку или мягкую ткань.
Интересно, что в некоторых культурах существуют традиции «бинтования» пуповины или применения различных веществ для ускорения ее высыхания. Однако современная медицина рекомендует просто оставить пуповину открытой, позволяя ей дышать и естественным образом высыхать. Это как если бы мы позволили природе самой завершить свою работу, не пытаясь ускорить процесс.
Антисептики: за и против
Долгое время считалось, что обработка пуповинного остатка антисептиками, такими как спирт или раствор хлоргексидина, необходима для предотвращения инфекций. Однако последние исследования показывают, что в большинстве случаев такая обработка не только не нужна, но может даже замедлить процесс отпадения пуповины. Представьте, что пуповина — это как засохший лист на дереве. Если мы постоянно будем смачивать его, он дольше будет держаться на ветке.
Всемирная организация здравоохранения (ВОЗ) рекомендует так называемый «сухой уход» за пуповиной в странах с низким уровнем неонатальной смертности. Это означает, что в большинстве случаев достаточно просто поддерживать пуповину чистой и сухой, без применения каких-либо дополнительных средств. Однако в регионах с высоким риском инфекций применение антисептиков может быть оправдано. Как всегда, лучше проконсультироваться с педиатром, чтобы выбрать оптимальный подход именно для вашего малыша.

Подгузники и пуповина: найти баланс
Отдельная тема — это как совместить уход за пуповиной с использованием подгузников. Ведь нам нужно сохранить пуповину сухой, но при этом защитить малыша от протеканий. Многие современные подгузники для новорожденных имеют специальный вырез для пуповины. Если такого выреза нет, можно просто загнуть верхний край подгузника, чтобы он не касался пуповинного остатка.
Интересно, что некоторые родители предпочитают использовать марлевые подгузники в первые дни жизни малыша, считая, что они лучше пропускают воздух. Однако исследования не показывают значительной разницы в скорости заживления пуповины при использовании тканевых или одноразовых подгузников. Главное — чтобы подгузник не тер и не раздражал область вокруг пуповины.
Признаки инфекции: быть начеку
В неонатальный период новорожденных родители должны быть особенно внимательны к любым изменениям в области пуповины. Покраснение кожи вокруг пуповинного остатка, неприятный запах, выделения или отек — это сигналы тревоги, которые требуют немедленного обращения к врачу. Представьте, что вы часовой на страже здоровья малыша. Ваша задача — вовремя заметить любые признаки «вторжения» и поднять тревогу.
Стоит отметить, что небольшое количество прозрачных или желтоватых выделений — это нормальное явление в процессе высыхания пуповины. Также не стоит пугаться, если вы заметите несколько капель крови в момент отпадения пуповинного остатка. Это как последний «прощальный подарок» от пуповины, которая выполнила свою важную миссию.
Пупочная грыжа: когда беспокоиться?
После отпадения пуповины у некоторых малышей может наблюдаться небольшое выпячивание в области пупка — пупочная грыжа. Это происходит из-за неполного закрытия мышц передней брюшной стенки. Многие родители пугаются, увидев это, но в большинстве случаев поводов для беспокойства нет. Представьте, что это как последняя складка на новой рубашке — со временем она разгладится сама.
Исследования показывают, что около 90% пупочных грыж у новорожденных закрываются самостоятельно к возрасту 1 года. Только в редких случаях, когда грыжа большая или вызывает дискомфорт у ребенка, может потребоваться хирургическое вмешательство. В неонатальный период новорожденных педиатры обычно рекомендуют просто наблюдать за грыжей, не пытаясь ее «вправить» или забинтовать.

Купание после отпадения пуповины
Когда пуповинный остаток наконец отпадает, для многих родителей это становится долгожданным моментом первого «настоящего» купания малыша. Но не спешите сразу погружать кроху в ванну! Место, где была пуповина, все еще заживает, и нужно дать ему время полностью закрыться. Обычно это занимает еще несколько дней после отпадения пуповины.
В этот период можно продолжать обтирать малыша влажной губкой, уделяя особое внимание области пупка. Мягко промокайте пупок после каждого подмывания, чтобы предотвратить скопление влаги. Это как если бы вы ухаживали за нежным растением — нужно обеспечить правильный баланс влаги и сухости, чтобы оно хорошо прижилось на новом месте.
Народные средства: мифы и реальность
В разных культурах существует множество народных средств для ухода за пуповиной. Кто-то советует прикладывать к пуповине мед, кто-то — посыпать ее золой или травами. Однако современная медицина не рекомендует использовать никакие дополнительные средства, кроме чистой воды и мыла (и то только если пуповина загрязнилась). Любые дополнительные вещества могут увеличить риск инфекции или аллергической реакции.
Интересно, что в некоторых традициях существует обычай хранить засохшую пуповину как талисман или использовать ее в различных ритуалах. С медицинской точки зрения в этом нет необходимости, но если для вашей семьи это важно, убедитесь, что пуповина полностью высохла, прежде чем сохранять ее. Главное — чтобы культурные традиции не шли вразрез с гигиеной и безопасностью малыша.
Заживление пупочной ранки
После отпадения пуповины на ее месте остается небольшая ранка, которая постепенно заживает. Этот процесс обычно занимает от нескольких дней до двух недель. В это время может наблюдаться небольшое количество прозрачных или желтоватых выделений — это нормально. Представьте, что это как последние капли воды, вытекающие из крана после того, как вы его закрыли.
В неонатальный период новорожденных важно продолжать поддерживать область пупка в чистоте и сухости. Если вы заметили покраснение, отек или гнойные выделения, немедленно обратитесь к врачу. Помните, что своевременное обращение за медицинской помощью может предотвратить развитие серьезных осложнений.

Желтуха новорожденных: Когда стоит беспокоиться
Неонатальный период — это первые 28 дней жизни малыша. Именно в это время происходят важнейшие изменения в организме ребенка, которые позволяют ему адаптироваться к жизни вне утробы матери. Давайте разберемся, какие ключевые этапы развития проходит новорожденный в этот период и на что стоит обратить особое внимание родителям.
Первая неделя: Время больших перемен
Сразу после рождения малыш попадает в совершенно новую для него среду. Представьте, что вас внезапно забросили на другую планету — примерно так себя чувствует новорожденный в первые дни жизни. Его организм начинает активно приспосабливаться к новым условиям. Что же происходит в это время?
- Легкие расправляются и начинают самостоятельно работать
- Кровообращение перестраивается на «взрослый» режим
- Пищеварительная система учится переваривать молоко
- Терморегуляция тела постепенно налаживается
В первые дни жизни малыш может потерять до 10% веса — и это нормально! Не паникуйте, если заметите, что кроха «усох». Это связано с выведением избыточной жидкости из организма. К концу первой недели вес обычно восстанавливается.
Вторая неделя: Знакомство с миром продолжается
На второй неделе неонатального периода новорожденных малыш продолжает активно изучать окружающий мир. Его органы чувств работают на полную мощность. Кроха уже может фокусировать взгляд на предметах, находящихся на расстоянии 20-30 см от его лица. Слух тоже улучшается — ребенок начинает реагировать на громкие звуки, поворачивая голову в их сторону.
В это время у многих малышей появляется так называемая физиологическая желтуха. Не пугайтесь, если заметите, что кожа ребенка приобрела желтоватый оттенок. В большинстве случаев это нормальное явление, связанное с незрелостью печени новорожденного. Однако если желтушность сохраняется дольше двух недель или становится очень интенсивной, обязательно обратитесь к педиатру.
Третья неделя: Время активного роста
К третьей неделе неонатального периода новорожденных малыш уже заметно подрос и окреп. Его движения становятся более координированными, а режим сна и бодрствования начинает потихоньку выстраиваться. Кроха уже может ненадолго удерживать головку, лежа на животе.
В это время многие родители замечают, что аппетит малыша заметно вырос. Не удивляйтесь, если ваш кроха начнет просить есть чаще обычного — это так называемый скачок роста. Организм ребенка активно растет и развивается, поэтому ему требуется больше энергии.
Четвертая неделя: Первые улыбки и гуление
Последняя неделя неонатального периода новорожденных — это время первых осознанных улыбок и попыток общения. Малыш начинает реагировать на лица близких людей, может улыбаться в ответ на улыбку мамы или папы. Некоторые крохи даже пробуют издавать первые звуки, похожие на гуление.
К концу первого месяца жизни вес ребенка обычно увеличивается на 600-800 грамм по сравнению с весом при рождении. Рост малыша тоже заметно меняется — в среднем на 3-4 см.
Важные моменты в развитии новорожденного
В течение неонатального периода новорожденных происходит множество важных изменений в организме малыша. Вот на что стоит обратить особое внимание:
- Рефлексы: У новорожденных есть целый набор врожденных рефлексов, которые помогают им выжить в первые недели жизни. Например, сосательный рефлекс, поисковый рефлекс (когда малыш поворачивает головку в сторону прикосновения к щеке), хватательный рефлекс. Постепенно эти рефлексы угасают, уступая место осознанным движениям.
- Зрение: В первые дни жизни малыш видит окружающий мир как в тумане. Но уже к концу первого месяца он может фокусировать взгляд на ярких предметах и лицах родителей.
- Слух: Новорожденные прекрасно слышат с самого рождения. Они узнают голос мамы и могут успокаиваться, слушая знакомые звуки.
- Кожа: Кожа новорожденного очень чувствительна. В первые недели на ней могут появляться различные высыпания, покраснения. Большинство из них проходит самостоятельно, но некоторые требуют внимания врача.
Особенности ухода за новорожденным
Уход за малышом в неонатальный период требует особого внимания и осторожности. Вот несколько ключевых моментов:
- Гигиена: Регулярно меняйте подгузники, проводите гигиенические процедуры после каждого кормления.
- Купание: Купать новорожденного рекомендуется ежедневно, используя специальные средства для детской кожи.
- Кормление: Придерживайтесь режима кормления, рекомендованного педиатром. Не забывайте о правильном положении малыша во время кормления.
- Прогулки: Свежий воздух очень полезен для новорожденного. Начинайте с коротких прогулок, постепенно увеличивая их продолжительность.
Когда обращаться к врачу
Несмотря на то, что неонатальный период новорожденных — это время естественных изменений в организме малыша, есть ситуации, когда необходимо срочно обратиться к педиатру:

- Повышение температуры тела выше 38°C
- Отказ от еды или вялое сосание
- Частый плач, который невозможно успокоить
- Необычные высыпания на коже
- Изменение цвета кожи (бледность, синюшность)
- Необычный стул (жидкий, с кровью или слизью)
Помните, что каждый ребенок уникален и развивается в своем темпе. Не стоит сравнивать своего малыша с другими детьми или ориентироваться только на средние показатели. Главное — внимательно наблюдать за ребенком, обеспечивать ему комфортные условия и своевременно обращаться к врачу при возникновении вопросов или сомнений.
Неонатальный период новорожденных — это удивительное время, когда маленький человечек делает свои первые шаги в большой мир. Наслаждайтесь каждым моментом, проведенным с малышом, ведь это время пролетит незаметно, оставив после себя массу теплых воспоминаний и первых достижений вашего крохи.
Первый осмотр педиатра: Оценка здоровья и развития малыша
Неонатальный период новорожденных — это настоящий марафон для малыша и его родителей. Каждый день приносит новые открытия и вызовы. Помните, как в детстве мы с замиранием сердца ждали дня рождения? Так вот, для новорожденного каждый день — это маленький праздник развития. Но как же разобраться во всех тонкостях этого удивительного периода?
Первые дни: Знакомство с большим миром
Представьте, что вы внезапно оказались на другой планете. Все вокруг новое, незнакомое, и даже дышать приходится по-другому. Примерно так себя чувствует новорожденный в первые дни жизни. Его организм совершает настоящий подвиг, адаптируясь к жизни вне утробы матери. Что же происходит в это время?
- Легкие малыша расправляются и начинают работать на полную мощность
- Сердечно-сосудистая система перестраивается на новый режим работы
- Пищеварительный тракт учится переваривать молоко
- Терморегуляция тела постепенно налаживается
В эти дни крохе как никогда нужны забота и поддержка. Он может казаться беспомощным, но на самом деле его организм работает на износ, чтобы приспособиться к новым условиям.
Неделя первая: Время больших перемен
Первая неделя неонатального периода новорожденных — это время стремительных изменений. Малыш может потерять до 10% своего веса, и это нормально! Не паникуйте, если заметите, что кроха «усох». Это связано с выведением избыточной жидкости из организма. К концу недели вес обычно восстанавливается.
В это время у многих малышей появляется физиологическая желтуха. Если вы заметили, что кожа ребенка приобрела желтоватый оттенок, не спешите бить тревогу. В большинстве случаев это нормальное явление, связанное с незрелостью печени новорожденного. Однако если желтушность сохраняется дольше двух недель или становится очень интенсивной, обязательно обратитесь к педиатру.
Вторая неделя: Открываем глаза на мир
На второй неделе неонатального периода новорожденных малыш начинает активно изучать окружающий мир. Его органы чувств работают в режиме сверхурочных. Кроха уже может фокусировать взгляд на предметах, находящихся на расстоянии 20-30 см от его лица. Представьте, что вы впервые надели очки — примерно так видит мир ваш малыш в эти дни.
Слух тоже улучшается — ребенок начинает реагировать на громкие звуки, поворачивая голову в их сторону. Это отличное время для знакомства с колыбельными и детскими песенками. Кто знает, может быть, именно сейчас вы воспитываете будущего меломана?
Третья неделя: Растем не по дням, а по часам
К третьей неделе неонатального периода новорожденных малыш уже заметно подрос и окреп. Его движения становятся более координированными, а режим сна и бодрствования начинает потихоньку выстраиваться. Кроха уже может ненадолго удерживать головку, лежа на животе. Это как если бы вы впервые попробовали поднять штангу — тяжело, но с каждым разом получается все лучше.
В это время многие родители замечают, что аппетит малыша заметно вырос. Не удивляйтесь, если ваш кроха начнет просить есть чаще обычного — это так называемый скачок роста. Организм ребенка активно растет и развивается, поэтому ему требуется больше энергии. Представьте, что вы готовитесь к марафону — вам тоже понадобилось бы больше калорий, верно?
Четвертая неделя: Первые улыбки и попытки общения
Последняя неделя неонатального периода новорожденных — это время первых осознанных улыбок и попыток общения. Малыш начинает реагировать на лица близких людей, может улыбаться в ответ на улыбку мамы или папы. Некоторые крохи даже пробуют издавать первые звуки, похожие на гуление. Это как если бы вы оказались в чужой стране и пытались освоить местный язык — первые слова даются с трудом, но какое же это удовольствие!

К концу первого месяца жизни вес ребенка обычно увеличивается на 600-800 грамм по сравнению с весом при рождении. Рост малыша тоже заметно меняется — в среднем на 3-4 см. Это как если бы взрослый человек за месяц вырос на 10-15 см!
Важные моменты в развитии новорожденного
В течение неонатального периода новорожденных происходит множество важных изменений в организме малыша. Вот на что стоит обратить особое внимание:
- Рефлексы: У новорожденных есть целый набор врожденных рефлексов, которые помогают им выжить в первые недели жизни. Например, сосательный рефлекс, поисковый рефлекс (когда малыш поворачивает головку в сторону прикосновения к щеке), хватательный рефлекс. Это как программное обеспечение, встроенное в компьютер — оно помогает системе работать с самого начала.
- Зрение: В первые дни жизни малыш видит окружающий мир как в тумане. Но уже к концу первого месяца он может фокусировать взгляд на ярких предметах и лицах родителей. Это похоже на настройку фокуса в фотоаппарате — сначала все размыто, но постепенно картинка становится четче.
- Слух: Новорожденные прекрасно слышат с самого рождения. Они узнают голос мамы и могут успокаиваться, слушая знакомые звуки. Это как если бы вы оказались в незнакомом месте, но вдруг услышали родную речь — сразу становится спокойнее, правда?
- Кожа: Кожа новорожденного очень чувствительна. В первые недели на ней могут появляться различные высыпания, покраснения. Большинство из них проходит самостоятельно, но некоторые требуют внимания врача. Кожа малыша — это как лакмусовая бумажка, которая может многое рассказать о его здоровье.
Особенности ухода за новорожденным
Уход за малышом в неонатальный период требует особого внимания и осторожности. Это как уход за редким и драгоценным растением — нужно знать все тонкости, чтобы оно хорошо росло. Вот несколько ключевых моментов:
- Гигиена: Регулярно меняйте подгузники, проводите гигиенические процедуры после каждого кормления. Это как ежедневная уборка в доме — кажется, что это мелочи, но из них складывается общее благополучие.
- Купание: Купать новорожденного рекомендуется ежедневно, используя специальные средства для детской кожи. Это не только гигиеническая процедура, но и отличный способ расслабить малыша перед сном.
- Кормление: Придерживайтесь режима кормления, рекомендованного педиатром. Не забывайте о правильном положении малыша во время кормления. Это как заправка автомобиля — важно не только количество топлива, но и то, как вы его заливаете.
- Прогулки: Свежий воздух очень полезен для новорожденного. Начинайте с коротких прогулок, постепенно увеличивая их продолжительность. Это как тренировки для спортсмена — начинаем с малого и постепенно наращиваем нагрузку.
Когда бить тревогу?
Несмотря на то, что неонатальный период новорожденных — это время естественных изменений в организме малыша, есть ситуации, когда необходимо срочно обратиться к педиатру. Это как система раннего оповещения — лучше перестраховаться, чем пропустить что-то важное. На что обратить внимание?

- Повышение температуры тела выше 38°C
- Отказ от еды или вялое сосание
- Частый плач, который невозможно успокоить
- Необычные высыпания на коже
- Изменение цвета кожи (бледность, синюшность)
- Необычный стул (жидкий, с кровью или слизью)
Помните, что каждый ребенок уникален и развивается в своем темпе. Не стоит сравнивать своего малыша с другими детьми или ориентироваться только на средние показатели. Это как в школе — кто-то раньше начинает читать, а кто-то лучше решает математические задачи. Главное — внимательно наблюдать за ребенком, обеспечивать ему комфортные условия и своевременно обращаться к врачу при возникновении вопросов или сомнений.
Неонатальный период новорожденных — это удивительное время, когда маленький человечек делает свои первые шаги в большой мир. Каждый день приносит новые открытия и достижения. Это как если бы вы отправились в путешествие на неизведанную планету — каждый день полон удивительных открытий и новых впечатлений.
Наслаждайтесь каждым моментом, проведенным с малышом, ведь это время пролетит незаметно, оставив после себя массу теплых воспоминаний и первых достижений вашего крохи. Кто знает, может быть, именно сейчас вы наблюдаете за первыми шагами будущего великого ученого, талантливого музыканта или просто замечательного человека?
