Содержание
Изосерологическая несовместимость крови матери и плода. Резус-конфликт
Похожие презентации:
Резус-иммунизация (сенсибилизация) во время беременности
Изосерологическая несовместимость крови матери и плода. Гемолитическая болезнь плода и новорождённого
Иммунологическая несовместимость между матерью и плодом
Иммунологическая несовместимость матери и плода (резус конфликт, несовместимость по системе АВ0)
Иммунный конфликт
Изосерологическая несовместимость крови матери и плода
Иммунология беременности. Изоантигенная несовместимость. Гемолитическая болезнь плода и новорожденного
Изосерологическая несовместимость крови матери и плода
Беременность и роды при резус-несовместимости крови матери и плода
Гемолитическая болезнь плода
Изосерологическая
несовместимость крови матери и
плода.
Классификация . Диагностика .
Тактика ведения
Выполнила: Алтынбек А
Гр: 701-02
www. themegallery.com
themegallery.com
2. Резус-иммунизация (сенсибилизация) во время беременности – появление у беременной женщины резус-антител в ответ на попадание в
РЕЗУС-ИММУНИЗАЦИЯ(СЕНСИБИЛИЗАЦИЯ)
ВО ВРЕМЯ БЕРЕМЕННОСТИ – ПОЯВЛЕНИЕ
У БЕРЕМЕННОЙ ЖЕНЩИНЫ РЕЗУСАНТИТЕЛ В ОТВЕТ НА ПОПАДАНИЕ В
КРОВЬ ФЕТАЛЬНЫХ ЭРИТРОЦИТАРНЫХ
РЕЗУС-АНТИГЕНОВ
3. Частота распространенности
ЧАСТОТА РАСПРОСТРАНЕННОСТИ• Европеоиды – 15% (баски35%)
• Монголоиды – 0,5-2%
• Негроиды
– 7%
4. ЭПИДЕМИОЛОГИЯ
Резус-положительные люди:-гомозиготные (DD)
-гетерозиготные (Dd)
Отец гомозиготен (DD) – 40-45%
+
Мать резус-отрицательная (dd)
Отец гетерозиготен (Dd) – 55-60%
+
Мать резус-отрицательная (dd)
Плод Rh-положительный в 100%
случаев
Плод Rh-положительный в 50%
случаев
Эритроцитарная сенсибилизация:
•Во время беременности
•После родов
– 1-1,5%
– 10%
6. РЕЗУС-ИММУНИЗАЦИЯ ВО ВРЕМЯ ПЕРВОЙ БЕРЕМЕННОСТИ
• Эритроциты проникают через плацентарныйбарьер:
• I триместре – в 5% случаев
• II триместре – в 15 % случаев
• III триместре – в 30% случаев
• Плодово-материнское кровотечение:
• при амниоцентезе во II и III триместрах – 20% беременных
• при самопроизвольных и искусственных
абортах – 15%
7.
 РЕЗУС-ИММУНИЗАЦИЯ ВО ВРЕМЯ РОДОВУ резус-отрицательных женщин, рожающих
РЕЗУС-ИММУНИЗАЦИЯ ВО ВРЕМЯ РОДОВУ резус-отрицательных женщин, рожающихрезус-положительных детей частота – 1015%
8. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВОЗНИКНОВЕНИЕ ИММУНИЗАЦИИ
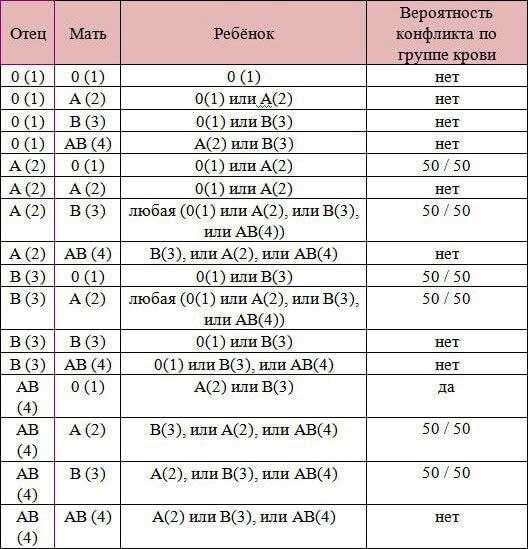
1. Объем плодово-материнской трансфузии2. Несовпадение матери и плода по системе АВ0
3. В анамнезе:
аборты
травматизация плаценты при инвазивной пренатальной
диагностике
кровотечения во время беременности
операция ручного отделения плаценты и выделения
последа
кесарево сечение
4
4. Генетические особенности иммунного ответа
ГЕМОЛИТИЧЕСКАЯ
БОЛЕЗНЬ ПЛОДА
10. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА ЛЕГКОЙ СТЕПЕНИ
• Частота 50%• Гемоглобин у плода 120 г/л и выше
(норма 160-180 г/л)
• Уровень билирубина у плода — 60 мкмоль/л
(норма 34 мкмоль/л)
11. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА СРЕДНЕЙ СТЕПЕНИ
• Частота 25-30%• Пренатальное лечение – однократная
внутриматочная трансфузия
(введение резус-отрицательной крови резусположительному плоду)
• Гемоглобин у плода 70-120 г/л
(норма 160-180 г/л)
12.
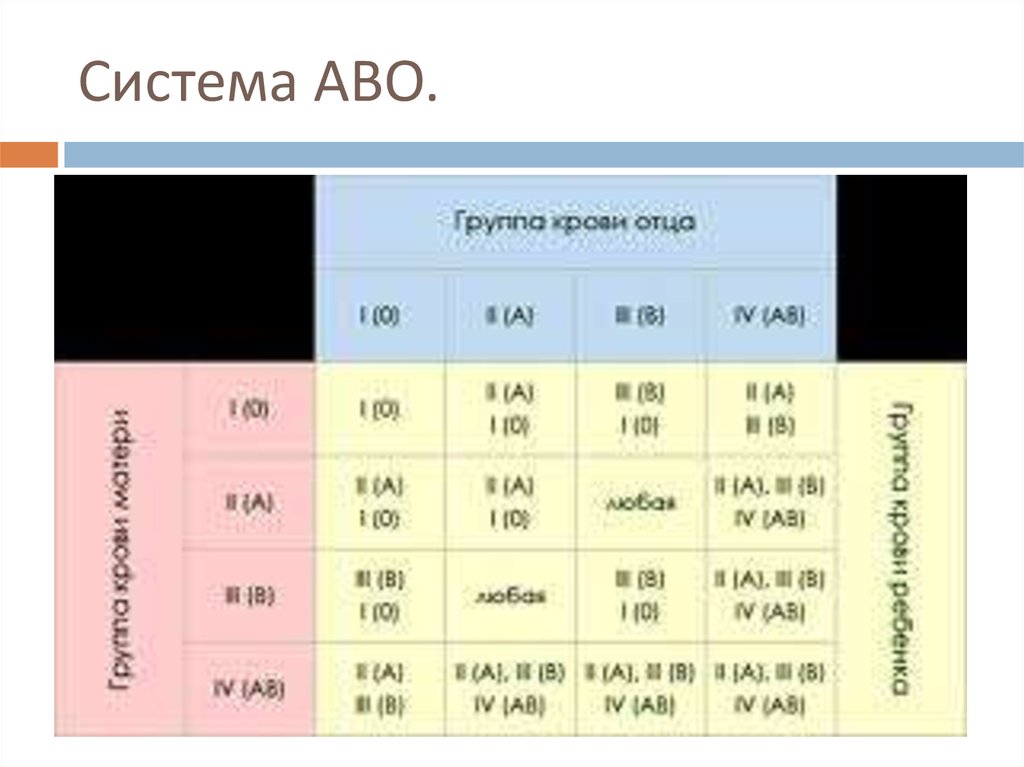 ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА ТЯЖЕЛОЙ СТЕПЕНИ• Частота 20-25%
ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ ПЛОДА ТЯЖЕЛОЙ СТЕПЕНИ• Частота 20-25%• Пренатальное лечение – внутриматочные
трансфузии до 26-32 недель беременности
(введение резус-отрицательной крови резусположительному плоду)
• Гемоглобин у плода менее 70 г/л
(норма 160-180 г/л)
• Водянка плода: генерализованный отек,
гепатоспленомегалия, гепатоцеллюлярные
нарушения, застойная сердечная недостаточность,
экстрамедуллярный эритропоэз, отек плаценты
14. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННОГО
• Гемолитическая анемия без желтухии водянки (наиболее легкая форма )
• Гемолитическая анемия с желтухой
• Гемолитическая анемия с желтухой и
водянкой
15. ГЕМОЛИТИЧЕСКАЯ БОЛЕЗНЬ НОВОРОЖДЕННОГО
Клиническиепризнаки
Степень тяжести гемолитической болезни
легкая
средняя
тяжелая
Анемия (Hb в
пуповинной
крови)
≥ 150 г/л
149-100 г/л
≤ 100 г/л
Желтуха
(билирубин в
пуповинной
крови)
≤ 85,5 мкмоль/л
85,6-136,8
мкмоль/л
≥ 136,9
мкмоль/л
Пастозность
подкожной
клетчатки
Пастозность и
асцит
Универсальный
отек
Отечный
синдром
16.
 Лечение гемолитической анемии новорожденногоЛЕЧЕНИЕ ГЕМОЛИТИЧЕСКОЙ АНЕМИИ
Лечение гемолитической анемии новорожденногоЛЕЧЕНИЕ ГЕМОЛИТИЧЕСКОЙ АНЕМИИНОВОРОЖДЕННОГО
• Гемолитическая анемия без желтухи и водянки –
инфузионная терапия, фототерапия (дневной или
синий свет, дл.волны-460-480нм)
• Гемолитическая анемия с желтухой – заменное
переливание крови
показания – билирубин- более 100мкмоль/л,
почасовой билирубин- более10мкм
• Гемолитическая анемия с желтухой и водянкой –
лечение не проводится, реанимация
противопоказана
17. ДИАГНОСТИКА
I Определение группы крови, резус-факторасупругов, резус-антител, генотипирование
резус-фактора
II Оценка анамнестических факторов риска:
• Внематочная беременность
• Прерывание беременностей
• Инвазивные процедуры в течение
предыдущих беременностей
• Кровотечения в течение предыдущих
беременностей
18. ДИАГНОСТИКА
Особенности родоразрешения(кесарево сечение, ревизия матки,
ручное отделение плаценты и
выделение последа)
• Проведение профилактики резусиммунизации в течение предыдущих
беременностей или в послеродовом
периоде
• Гемотрансфузии без учета резусфактора, использование одного
шприца наркоманами
III Информация о предыдущих детях или
исходах предыдущих беременностей
19.
 ДИАГНОСТИКА• Если мать и отец резус-отрицательны, нет
ДИАГНОСТИКА• Если мать и отец резус-отрицательны, нетнеобходимости в определении уровня
антител
• Резус-положительный партнер
динамическое определение титра антител
• Информация о предыдущих титрах антител
20. ДИАГНОСТИКА
Специальные методы обследования• Прямая и непрямая пробы Кумбса с применением
антиглобулиновой сывороткой
1:16 и более — амниоцентез
21. ВЕДЕНИЕ НЕИММУНИЗИРОВАННЫХ БЕРЕМЕННЫХ
• Определение титра антител:до 32 недели беременности –
ежемесячно
• с 32-й по 35-ую неделю – 2 раза в месяц
• с 35 недели – еженедельно
• В случае обнаружения на любом сроке
беременности резус-анти-D-антител беременную
следует вести как беременную с резусиммунизацией
22. ВЕДЕНИЕ НЕИММУНИЗИРОВАННЫХ БЕРЕМЕННЫХ
Введение антиRh0(D)иммуноглобулина23. ВЕДЕНИЕ СЕНСИБИЛИЗИРОВАННЫХ БЕРЕМЕННЫХ
Введение анти-Rh0(D)-иммуноглобулинаПРОТИВОПОКАЗАННО
Необходимо динамическое наблюдение за
титром АТ и комплекс витаминов для
беременных
24.
 ВЕДЕНИЕ РЕЗУС-ИММУНИЗИРОВАННЫХ БЕРЕМЕННЫХПри выявлении сенсибилизации в значимых
ВЕДЕНИЕ РЕЗУС-ИММУНИЗИРОВАННЫХ БЕРЕМЕННЫХПри выявлении сенсибилизации в значимыхтитрах (1:16 и более) у ранее не
иммунизированной беременной следующий
этап – амниоцентез
• Амниоцентез повторяется с интервалом от 1 до
4 недель
• Кордоцентез
25. СПЕКТРОФОТОМЕТРИЯ
Метод для идентификации и количественногоанализа веществ
Для оценки используется
шкалы Лили, Фреда и Квинан
26. СПЕКТРОФОТОМЕТРИЯ
По шкале Лили выделяют 3 прогностические зоны:1. Зона I (нижняя) – уровень гемоглобина в
пуповинной крови выше 120 г/л
2. Зона II (средняя) – уровень гемоглобина в
пуповинной крови 80-120 г/л. Досрочное
родоразрешение показано:
3.
Легкие плода зрелые
Предыдущая внутриутробная гибель плода произошла в
те же сроки
Резкое повышение оптической плотности амниотической
жидкости
Зона III (верхняя) – уровень гемоглобина в
пуповинной крови ниже 90 г/л. Возможная
антенатальная гибель плода в течение 7-10 суток.
Должна быть проведена трансфузия крови или
родоразрешение
www.themegallery.com
28. СПЕКТРОФОТОМЕТРИЯ
Шкала Фреда позволяет определить:
Группу крови и резус-фактор плода
Гемоглобин и гематокрит
Антитела, связанные с фетальными
эритроцитами (прямая реакция Кумбса)
Билирубин
Количество ретикулоцитов
Уровень сывороточного белка
29. УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА
Ранние признаки иммунной водянки плода – многоводие,гепатоспленомегалия, генерализованный отек
При выраженной водянке плода:
• Гидроперикард
• Асцит и гидроторакс в сочетании с многоводием – очень
неблагоприятный прогностический признак
• Кардиомегалия
• Отек кожи головы и конечностей
• Плохая сократимость и утолщение стенки желудочков
сердца
• Увеличение эхогенности кишечника из-за отека его стенок
• Гипертрофированная плацента, гомогенность плаценты
• Необычная поза плода — «поза Будды» — позвоночник и
конечности отведены от раздутого живота
• Снижение двигательной активности
30.
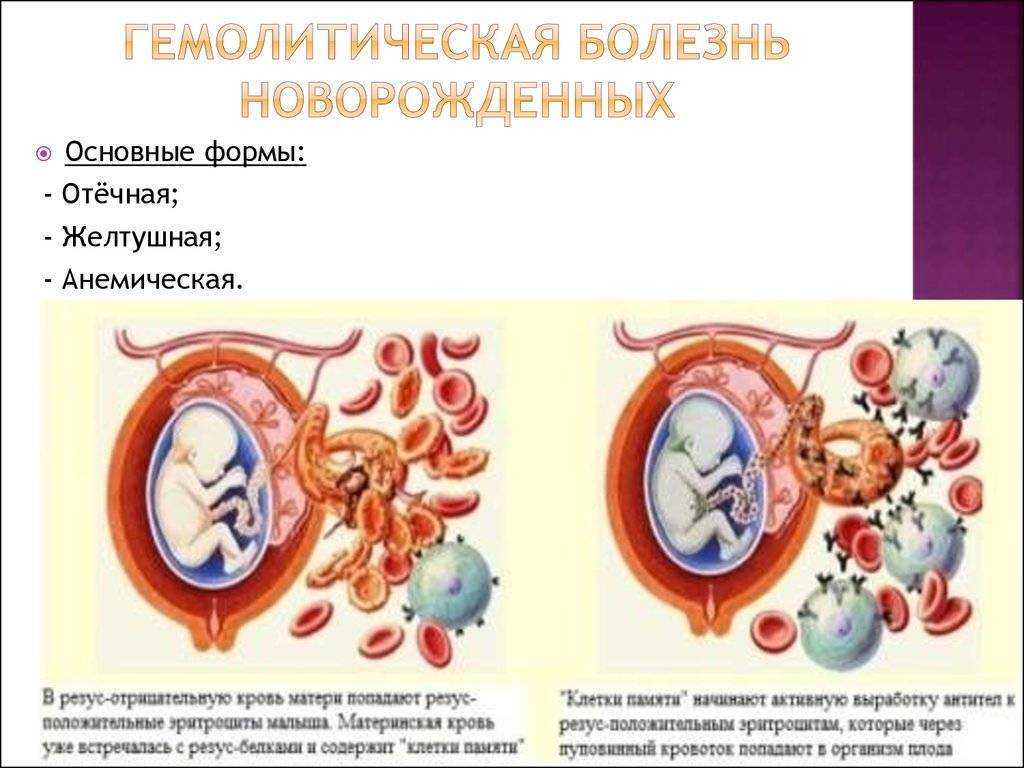 УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКАНа тяжесть гемолитической болезни плода указывают
УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКАНа тяжесть гемолитической болезни плода указываютследующие результаты измерения структур плода:
Диаметр вены пуповины
Вертикальный размер печени
Толщина плаценты
Увеличение скорости кровотока в нисходящей части
аорты
• Пиковая систолическая скорость кровотока в
средней мозговой артерии плода
До обнаружения нарушений состояния плода
динамический ультразвуковой контроль проводится
еженедельно, при выявлении поражения плода –
ежедневно или через день
Скорость кровотока
в средней мозговой
артерии
www.themegallery.com
34. ТАКТИКА ВЕДЕНИЯ БЕРЕМЕННОСТИ
• При сроке более 34 недели беременности приналичии дельта ОП-450 в зоне III при
спектрофотометрии или уровня фетального
гематокрита ниже 30%, при ультразвуковых
признаках водянки плода – родоразрешение
• При сроке менее 34 недели при аналогичных
показателях – внутриматочная трансфузия, либо
родоразрешение с профилактикой
респираторного дистресс-синдрома в течение
24-48 часов
35.
 ПРОФИЛАКТИКАВведение анти-Rh0(D)-иммуноглобулина
ПРОФИЛАКТИКАВведение анти-Rh0(D)-иммуноглобулинав срок 28 недели беременности и в
первые 72 часа после родов, абортов,
амниоцентеза, операции при
внематочной беременности
36. ПРОФИЛАКТИКА РЕЗУС-ИММУНИЗАЦИИ
Введение анти-Rh0(D)иммуноглобулинаМеханизм действия — антиRh0(D)-иммуноглобулин
(антитело) связывается с
Rh(+)[D(+)] клетками плода
(антиген)
37. НАЗНАЧЕНИЕ АНТИ-RH0(D)-ИММУНОГЛОБУЛИНА РЕЗУС-ОТРИЦАТЕЛЬНЫМ НЕСЕНСИБИЛИЗИРОВАННЫМ БЕРЕМЕННЫМ
ПРОФИЛАКТИКАРЕЗУС-ОТРИЦАТЕЛЬНЫМ
НЕСЕНСИБИЛИЗИРОВАННЫМ БЕРЕМЕННЫМ
• Искусственный или самопроизвольный аборт
• Эктопическая беременность
• Эвакуация пузырного заноса
• Инвазивная пренатальная диагностика
• Кровотечения во время беременности
• Закрытая травма брюшной полости матери (автокатастрофа)
• Наружный поворот при тазовом предлежании
Препараты
R
Rhophylac — Финляндия
КамРОУ
— Израиль
English Русский Правила
СПИСОК ЛИТЕРАТУРЫ \ КонсультантПлюс
1. Савельева Г.М., Курцер М.А., Панина О.Б., Сичинава Л.Г., Коноплянников А.Г. Гемолитическая болезнь плода у беременных с резус-сенсибилизацией. Диагностика, лечение, профилактика. Методическое письмо Минздравсоцразвития, 2012. — 18 с.
Савельева Г.М., Курцер М.А., Панина О.Б., Сичинава Л.Г., Коноплянников А.Г. Гемолитическая болезнь плода у беременных с резус-сенсибилизацией. Диагностика, лечение, профилактика. Методическое письмо Минздравсоцразвития, 2012. — 18 с.
2. Коноплянников А.Г., Павлова Н.Г. Изосерологическая несовместимость крови матери и плода. Гемолитическая болезнь плода и новорожденных. В кн.: Акушерство. Национальное руководство. 2015: с. 324 — 334.
3. Кулаков В.И. Новые технологии и научные приоритеты в акушерстве и гинекологии//Акуш. и гин. — 2002. — N 5. — С. 3 — 5.
4. Михайлов А.В., Константинова Н.Н., Пигина Т.В.//Внутриматочные переливания плоду как способ лечения отечной формы гемолитической болезни Акушерство и Гинекология. — 1990. — N 7. — С. 41 — 45.
5. Ультразвуковая диагностика иммунного и неиммунного отека плода/Клиническое руководство по ультразвуковой диагностике//Ред. Митьков В.В., Медведев М.В.-М., Видар, — 1996. — Т 2. — С. 164 — 180.
6. Внутриматочные вмешательства под ультразвуковым контролем во время беременности/Клиническое руководство по ультразвуковой диагностике//Ред. Митьков В.В., Медведев М.В. — М., Видар, — 1996. — Т 2. — С. 280 — 302.
Митьков В.В., Медведев М.В. — М., Видар, — 1996. — Т 2. — С. 280 — 302.
7. Савельева Г.М., Коноплянников А.Г., Курцер М.А. Резус-изоиммунизация. Старые проблемы. Новые решения//Вопр. гин., акуш. и перинат. — 2005. — Т. 4, N 3. — С. 89 — 93.
8. Сидельникова В.М. Антенатальная диагностика, лечение гемолитической болезни плода при резус-изоиммунизации и меры ее профилактики//Акуш. и гин. — 2005. — N 5. — С. 56 — 60.
9. Суханова Л.П. Динамика перинатальной смертности в акушерских стационарах России в 1991 — 2002 гг.//Акуш. и гин. — 2005. — N 4. — С. 46 — 48.
10. Фролова О.Г., Токова З.З. Основные показатели деятельности акушерско-гинекологической службы и репродуктивного здоровья//Акуш. и гин. — 2005. — N 1. — С. 3 — 6.
11. Delaney M., Matthews D.S. Hemolytic disease of fetus and newborn: managing the mother, fetus and newborn. Hematology Am.Soc.Hematol.Educ.Programme. — 2015. — Dec.5.2015(l): 146-151.
12. Harkness U.F., Spinnato J.A. Prevention and management of RhD isoimmunization. — Clin. Perinatol. — 2004. — Dec.31(4): 721-742.
— Clin. Perinatol. — 2004. — Dec.31(4): 721-742.
13. Crowther C., Middleton P., McBain R. Anti-D administration in pregnancy for preventing Rhesus alloimmumzation//Cochrane Database Syst. Rev. — 2013. — N 2.
14. Chilcott J., Tappenden P., Lloyd Jones M. et al. The economics of routine antenatal anti-D prophylaxis for pregnant women who are rhesus negative//BJOG. — 2004, Sep. — Vol. 111. — N 9. — P. 903 — 907.
15. Ravinet J., Carbonne B. Economic analysis of the prevention of anti-D immunization//J. Gynecol. Obstet. Biol. Reprod. (Paris). — 2006, Feb. — Vol. 35. — Suppl. 1. — P. 1S104-1S111.
16. Qureshi H., Massey E., Kirwan D. et al. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newbora. — Transfusion medicine. — 2014. — 24: 8-20.
17. Bennardello F., Coluzzi S., Curciarello G. et al. Recommendations for the prevention and treatment of haemolytic disease of the foetus and newborn. — Blood Transfus. — 2015; 13: 109-134.
— 2015; 13: 109-134.
18. Bennardello F., Curciarello G. Survey of the prevention and incidence of haemolytic disease of the newborn in Italy. Blood Transfus. — 2013; 11: 518-527.
19. Fung. K, Eason E. Prevention of Rh Alloimmumzation. JOGC, 2003; 133: 1-9.
20. Fyfe I., Ritchy M., Taruc С et al. Appropriate provision of anti-D prophylaxis to RhD negative pregnant women: a scoping review. Pregnancy and Childbirth. 2014; 14: 411-416.
21. Griffey R., Chen В., Krehbiel N. Performance in appropriate Rh testing and treatment with Rh immunoglobulin in emergency department. Ann. Emerg. Med. 2012; 59(4): 285-293.
22. Moise K.J., Argoti P.S. Management and prevention of red cell alloimmunization in pregnancy. A systematic review. Obst Gynecol 2012; 120: 1132-1139.
23. Karanth L., Jaafar S., Kanagasabai S. et al. Anti-D administration after spontaneous miscarriage for preventing Rhesus alloimmunization. Cochrane Database Syst Rev 2013; 3.
24. Pressman E.K. Ultrasound for Evaluation of Fetal Anemia. Ultrasound Clinics. 2013; 8(l): 79-87.
Ultrasound for Evaluation of Fetal Anemia. Ultrasound Clinics. 2013; 8(l): 79-87.
25. Garabedian C, Vaast P., Behal H. et al. Management of severe fetal anemia by Doppler measurement of middle cerebral artery: are there other benefits than reducing invasive procedures? European Journal of Obstetrics & Gynecology and Reproductive Biology. — 2015; 192: 27-30.
26. Babovic I., Plesinac S., Radojicic Z. et al. Middle cerebral artery Doppler in prediction degree of fetal anemia and the best timing for the second intrauterine intravascular transfusion in red cell alloimmune disease. Clin Exp Obstet Gynecol. — 2015; 42(6): 792-796.
27. Lopez-Carpintero N., Rodriguez-Gonzalez R., Gonzalez-Gonzalez A. et al. Role of middle cerebral artery Doppler in the management of Rhesus alloimmunization cases. Ginecol Obstet Мех. — 2010; 78(8): 410-417.
28. Scheier M., Hernandez-AndradeE., Carmo A. et al. Prediction of fetal anemia in rhesus disease by measurement of fetal middle cerebral artery peak systolic velocity.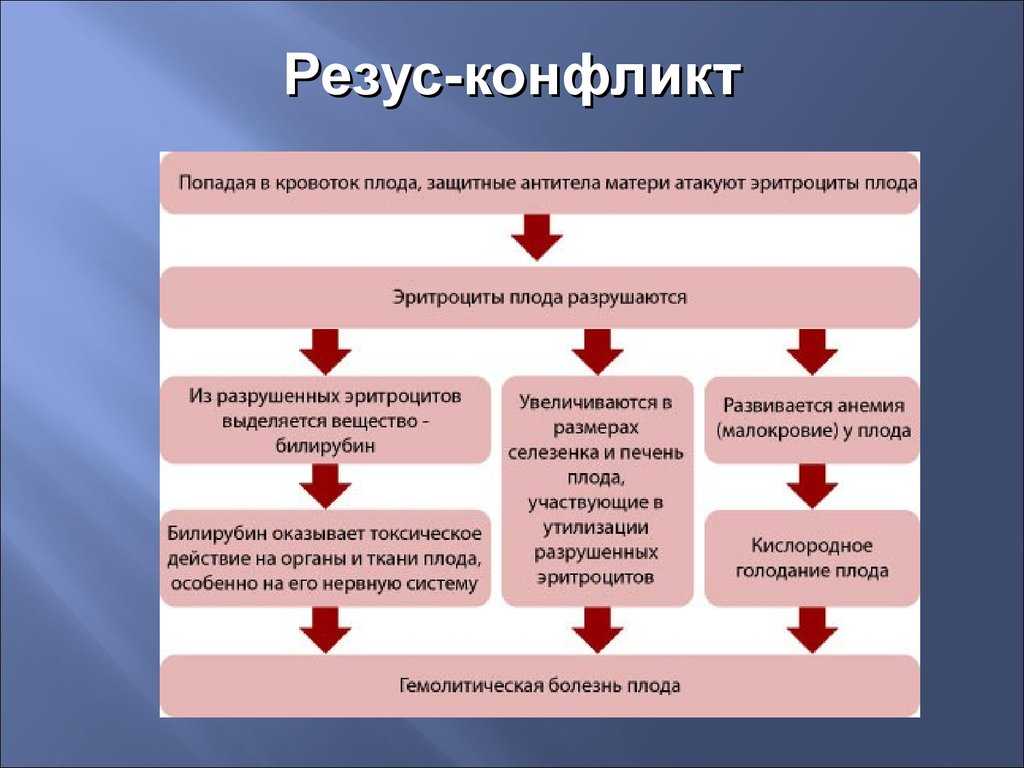 Ultrasound Obstet Gynecol 2004; 23: 432-436.
Ultrasound Obstet Gynecol 2004; 23: 432-436.
29. Kent J., Farrell A.-M., Soothill P. Routine administration of Anti-D: the ethical case for offering pregnant women fetal RHD genotyping and a review of policy and practice. BMC Pregnancy and Childbirth. — 2014, 14:87.
30. Clausen F., Christiansen M., Steffensen R. et al. Report of the first nationally implemented clinical routine screening for fetal RHD in D-pregnant women to ascertain the requirement for antenatal RhD prophylaxis. Transfusion Medicine. 2012; 52:752-758.
31. Finning K., Martin P., Summers J. et al. Effect of high throughput RH D typing of fetal DN A in maternal plasma on use of anti-Rh D immunoglobulin in Rh D negative pregnant women. Br. Med. Journal; 2008; 336:816-818.
32. Lindenburg I., Smits-Wintjens V.E., van Klink J.M. et al. Long-term neurodevelopmental outcome after intrauterine transfusion for hemolytic disease of the fetus/newborn: the LOTUS study. American Journal of Obstetrics and Gynecology; 2012. — 206(2):141-149.
— 206(2):141-149.
33. Deka D., Dadhwal V., Sharma A.K. et al. Perinatal survival and procedure-related complications after intrauterine transfusion for red cell alloimmunization. Arch Gynecol Obstet. — 2016; 293(5):967-973.
34. Lindenburg I.Т., van Kamp I.L., Oepkes D. Intrauterine blood transfusion: current indications and associated risks. Fetal Diagn Ther. — 2014; 36(4):263-271.
Резус-несовместимость: Медицинская энциклопедия MedlinePlus
Резус-несовместимость — это состояние, которое развивается, когда беременная женщина имеет резус-отрицательную кровь, а ребенок в ее утробе имеет резус-положительную кровь.
Во время беременности эритроциты еще не родившегося ребенка могут попасть в кровь матери через плаценту.
Если мать резус-отрицательна, ее иммунная система воспринимает резус-положительные клетки плода как чужеродное вещество. Организм матери вырабатывает антитела против клеток крови плода. Эти антитела могут вернуться через плаценту к развивающемуся ребенку.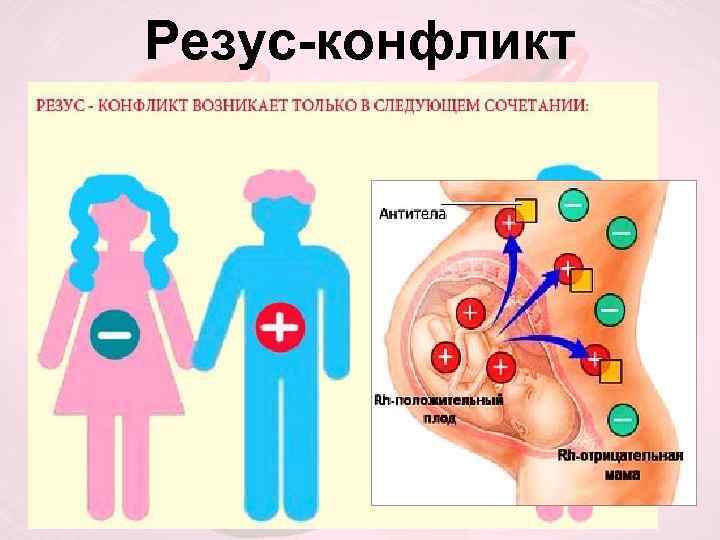
При разрушении эритроцитов образуется билирубин. Это приводит к тому, что младенец становится желтым (желтушным). Уровень билирубина в крови младенца может колебаться от умеренного до опасно высокого.
Первенцы часто не болеют, если у матери в прошлом не было выкидышей или абортов. Это повысит чувствительность ее иммунной системы. Это связано с тем, что для выработки антител у матери требуется время. Все дети, которые у нее будут позже, также резус-положительны, могут быть затронуты.
Резус-несовместимость развивается только тогда, когда мать резус-отрицательна, а ребенок резус-положителен. Эта проблема стала менее распространенной в местах, где предоставляется хороший дородовой уход. Это связано с тем, что обычно используются специальные иммунные глобулины, называемые RhoGAM.
Резус-несовместимость может вызывать симптомы от очень легких до смертельных. В самой легкой форме резус-несовместимость вызывает разрушение эритроцитов. Других эффектов нет.
Других эффектов нет.
После рождения у младенца могут быть:
- Пожелтение кожи и белков глаз (желтуха)
- Низкий мышечный тонус (гипотония) и вялость
Перед родами у матери может быть больше амниотической жидкости вокруг ее будущего ребенка (многоводие).
Может быть:
- Положительный результат прямой пробы Кумбса
- Уровень билирубина в пуповинной крови ребенка выше нормы.
- Признаки разрушения эритроцитов в крови младенца
Резус-несовместимость можно предотвратить с помощью RhoGAM. Поэтому профилактика остается лучшим лечением. Лечение младенца, который уже поражен, зависит от тяжести состояния.
Новорожденных с легкой резус-несовместимостью можно лечить с помощью фототерапии с использованием билирубиновых ламп. Также можно использовать внутривенный иммуноглобулин. Для младенцев с тяжелым поражением может потребоваться обменное переливание крови. Это необходимо для снижения уровня билирубина в крови.
При резус-несовместимости легкой степени ожидается полное выздоровление.
Осложнения могут включать:
- Повреждение головного мозга из-за высокого уровня билирубина (ядерная желтуха)
- Скопление жидкости и отек у ребенка (водянка плода)
- Нарушения психической функции, движения, слуха, речи и судороги
Позвоните своему поставщику медицинских услуг, если вы думаете или знаете, что беременны, но еще не посещали поставщика.
Резус-несовместимость практически полностью предотвратима. Медицинские работники должны внимательно следить за резус-отрицательными матерями во время беременности.
Специальные иммунные глобулины, называемые RhoGAM, в настоящее время используются для предотвращения резус-несовместимости у матерей с отрицательным резус-фактором.
Если отец младенца является резус-положительным или его группа крови неизвестна, матери делают инъекцию RhoGAM во втором триместре. Если ребенок резус-положительный, мать получит вторую инъекцию в течение нескольких дней после родов.
Эти инъекции предотвращают выработку антител против резус-положительной крови. Однако женщины с резус-отрицательной группой крови должны получать инъекции:
- Во время каждой беременности
- После выкидыша или аборта
- После пренатальных тестов, таких как амниоцентез и биопсия ворсин хориона
- После травмы живота во время беременности
Резус-индуцированная гемолитическая болезнь новорожденных; Эритробластоз плода
- Желтуха новорожденных – выделения
- Эритробластоз плода — микрофотография
- Новорожденный с желтухой
- Антитела
- Обменное переливание — серия
- Резус-несовместимость — серия
Каплан М., Вонг Р.Дж., Бергис Дж.К., Сибли Э., Стивенсон Д.К. Желтуха новорожденных и заболевания печени. В: Мартин Р.Дж., Фанарофф А.А., Уолш М.К., ред. Неонатальная и перинатальная медицина Фанарова и Мартина . 11-е изд. Филадельфия, Пенсильвания: Elsevier; 2020: глава 91.
Клигман Р.М., Сент-Геме Дж.В., Блюм Н.Дж., Шах С.С., Таскер Р.К., Уилсон К.М. Заболевания крови. В: Kliegman RM, St. Geme JW, Blum NJ, Shah SS, Tasker RC, Wilson KM, eds.
Мойзе К.Дж. Аллоиммунизация эритроцитов. В: Landon MB, Galan HL, Jauniaux ERM и др., ред. Акушерство Габбе: нормальная и проблемная беременность . 8-е изд. Филадельфия, Пенсильвания: Elsevier; 2021: глава 40.
Обновлено: Нил К. Канеширо, доктор медицинских наук, MHA, клинический профессор педиатрии Медицинской школы Вашингтонского университета, Сиэтл, Вашингтон. Также рассмотрены Дэвидом Зивом, доктором медицины, MHA, медицинским директором, Брендой Конауэй, редакционным директором, и A.D.A.M. Редакция.
Red Blood Cell Isoimmunisation and Pregnancy
- 1 Pathophysiology
- 2 Anti-D Immunoglobulin
- 2.1 Indications for Use
- 2.
 2 Investigations and Management
2 Investigations and Management
- 3 Red Blood Cell Isoimmunisation Screening and Prophylaxis
Red blood клеточная изоиммунизация описывает выработку антител в ответ на изоантиген, присутствующий на эритроците.
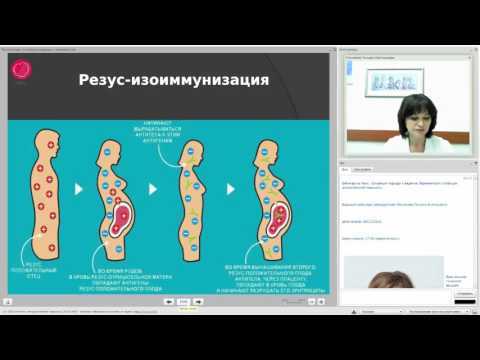
Материнская изоиммунизация происходит, когда иммунная система матери становится сенсибилизированной к антигенам на фетальные эритроциты , что приводит к продукции IgG-антител.
При последующих беременностях эти антитела могут проникать через плаценту и атаковать эритроциты плода, что приводит к гемолизу и анемии (известной как гемолитическая болезнь новорожденных).
В этой статье мы рассмотрим патофизиологию изоиммунизации эритроцитов, способы ее выявления и предотвращения во время беременности.
Патофизиология
При изоиммунизации эритроцитов, материнские антитела образуются в ответ на поверхностные антигены на эритроцитах плода.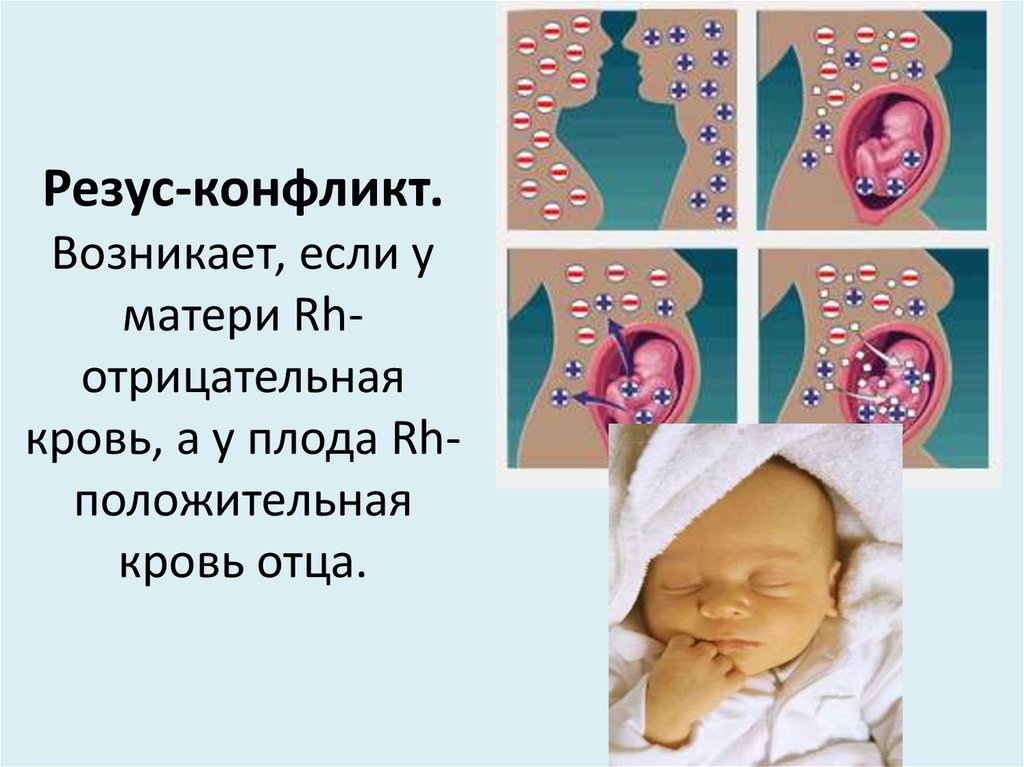 Это происходит, когда клетки плода попадают в материнский кровоток в результате « сенсибилизирующего события », такого как дородовое кровотечение или травма живота. Это также может произойти во время родов.
Это происходит, когда клетки плода попадают в материнский кровоток в результате « сенсибилизирующего события », такого как дородовое кровотечение или травма живота. Это также может произойти во время родов.
Во время первичного облучения редко возникают проблемы . Однако при последующих беременностях материнские антитела могут проникать через плаценту и атаковать эритроциты плода (если они несут один и тот же поверхностный антиген). Это приводит к гемолизу и последующей анемии плода.
Существует более 50 различных поверхностных антигенов, способных индуцировать материнскую изоиммунизацию. Наиболее распространенным набором является группа крови R Hesus D , для которой люди являются либо положительными (RhD+), либо отрицательными (RhD-).
Изоиммунизация резус-D возможна только у RhD- женщин и происходит при контакте с кровью RhD+ плода:
- Женщина RhD-, а ее партнер RhD+. Она беременеет плодом, который также является RhD+.
- Позже она забеременеет вторым ребенком, который также имеет RhD+ .
- Анти-D-антитела женщины проникают через плаценту во время этой беременности и попадают в кровоток плода, который содержит RhD+ кровь. Они связываются с RhD-антигенами плода на поверхностных мембранах эритроцитов.
- Это заставляет иммунную систему плода атаковать и разрушать собственные эритроциты, что приводит к анемии плода. это называется гемолитическая болезнь новорожденных (ГБН).
OpenStax College [CC BY 4.0]
Рис. 1. Изоиммунизация матери у RhD-женщины, подвергшейся воздействию RhD+ крови плода.
Иммуноглобулин анти-D
Если происходит сенсибилизирующее событие, изоиммунизацию матери можно предотвратить путем введения Иммуноглобулина анти-D . Он связывается с любыми RhD+ клетками в материнском кровотоке и не стимулирует иммунный ответ.
Он связывается с любыми RhD+ клетками в материнском кровотоке и не стимулирует иммунный ответ.
Примечание. Анти-D-иммуноглобулин никогда не требуется RhD+ женщинам, поскольку они не могут образовывать анти-D-антитела.
Показания к применению
Женщинам с отрицательным резус-фактором D введение анти-D-иммуноглобулина следует рассматривать после любого сенсибилизирующего события:
- Инвазивное акушерское исследование (например, амниоцентез или биопсия ворсин хориона)
- Дородовое кровотечение (АПГ)
- Внематочная беременность
- Внешняя головная версия
- Падение или травма живота
- Внутриутробная смерть
- Выкидыш
- Прерывание беременности
- Роды (нормальные, инструментальное или кесарево сечение)
Исследования и лечение
В Великобритании сенсибилизирующие события у RhD-женщин лечат в соответствии с их беременностью (см. Таблицу 1).
Существуют два основных анализа крови, которые следует рассмотреть после сенсибилизирующего события:
- Скрининг группы крови матери и антител – определяет группы крови ABO и RhD и выявляет любые антитела, направленные против поверхностных антигенов эритроцитов (кроме A и B ).

- Тест на фето-материнское кровотечение (FMH) — также известный как тест Кляйхауэра, он оценивает, сколько крови плода попало в кровоток матери. Если после 20 недель беременности произошло сенсибилизирующее событие, этот тест используется для определения того, сколько анти-D-иммуноглобулина следует вводить.
После родов необходимо проверить резус-статус ребенка. Если у ребенка RhD+ (а у матери RhD-), следует провести тест на FMH и ввести не менее 500 МЕ анти-D-иммуноглобулина. Доза может быть увеличена в зависимости от размера FMH.
Dr Graham Beards [CC BY-SA 4.0], через Wikimedia Commons
Рис. 2. Тест Кляйхауэра. Эритроциты плода видны как красные, в то время как взрослые клетки видны как «призраки»
| Беременность менее 12 недель | Показания : Внематочная беременность, пузырный занос, аборт или сильное маточное кровотечение Обследования: Группа крови матери и скрининг на антитела (для подтверждения RhD- и того, что антитела к D уже не сформированы). |

