Содержание
Вазодилатация и гипердинамический тип кровообращения — Студопедия
Поделись
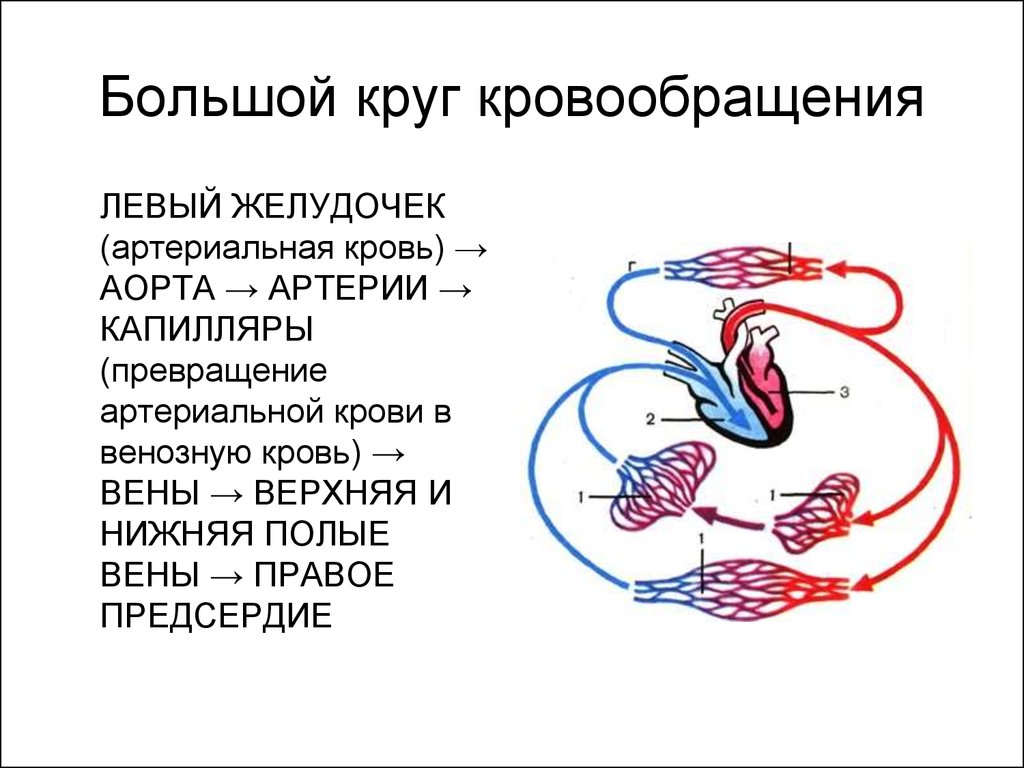
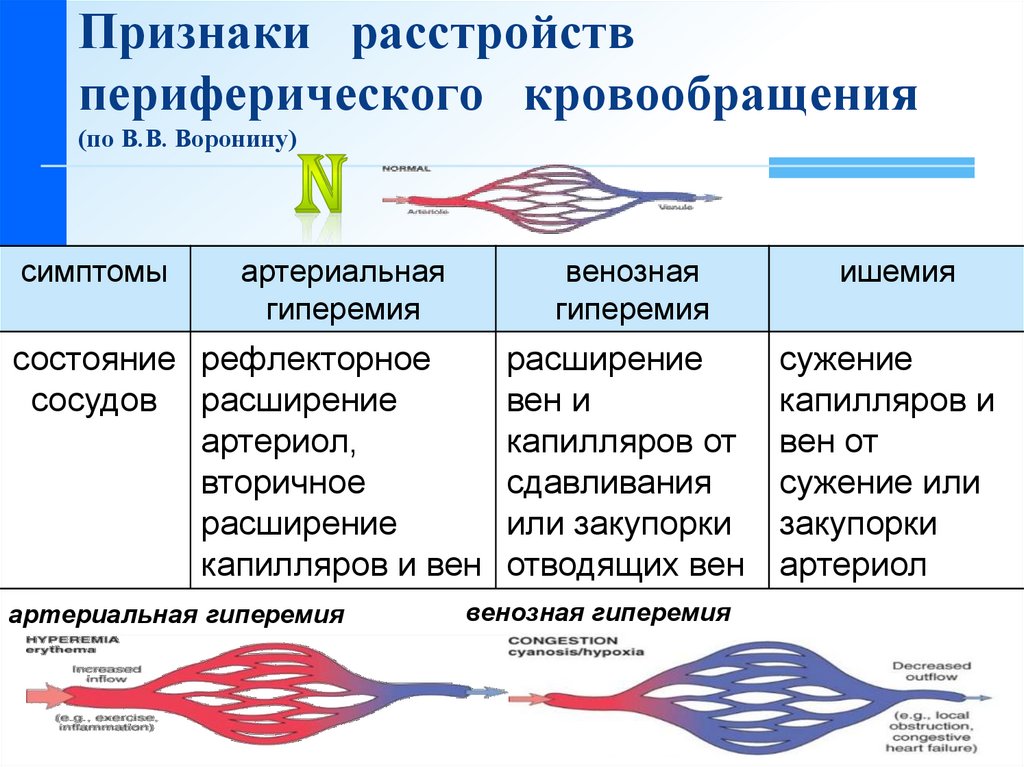
Эти изменения гемодинамики возможны при всех формах печёночно-клеточной недостаточности, но особенно — при декомпенсированном циррозе [35]. Они проявляются гиперемией конечностей, скачущим пульсом и капиллярной пульсацией. Периферический кровоток увеличивается, в основном за счёт кожного кровотока [24]. Усиливается приток артериальной крови в нижние конечности [6]. Увеличивается кровоток по воротной вене. Почечный кровоток, особенно перфузия коркового вещества, уменьшается. Увеличивается сердечный выброс [13, 29], что проявляется тахикардией, выраженным сердечным толчком, а во многих случаях и систолическим шумом (рис. 6-1 и 6-2). Эти изменения в системе кровообращения только в очень редких случаях приводят к сердечной недостаточности.
Артериальное давление низкое; в терминальной фазе это усугубляет нарушение функции почек. Нарушение кровотока в печени способствует развитию печёночной недостаточности, а снижение церебрального кровотока усугубляет нарушение психического статуса |10].
Периферическое сосудистое сопротивление уменьшается, как и артериовенозная разница по кислороду. При циррозе общее потребление кислорода организмом и оксигенация тканей снижаются [28]. Это связано с гипердинамическим типом кровообращения и с артериовенозным шунтированием. Таким образом, состояние повышенной вазодилатации при печёночной недостаточности может способствовать общей гипоксии тканей.
Тонус мышц сосудов понижается; доказательством этому служит сниженная вазоконстрикция при умственных нагрузках, при пробе Вальсальвы и при переходе из горизонтального положения тела в вертикальное |23, 24]. Поражение вегетативных нервов прогностически неблагоприятно [7]. Под влиянием сосудорасширяющих веществ, по-видимому, происходит раскрытие большого количества существующих, но неактивных в норме артериовенозных анастомозов.
Вазодилататоры, принимающие участие в изменениях гемодинамики, точно не установлены. Вероятно, их несколько. Какова бы ни была их природа, они зависят от поражённых гепатоцитов: либо синтезируются в них, либо недостаточно инактивируются, либо минуют их через внутри- или вне-печёночные портосистемные шунты. Вероятно, вазодилататоры образуются в кишечнике. При циррозе повышенная проницаемость слизистой оболочки кишечника и портосистемное шунтирование позволяют эндотоксину и цитокинам проникать в системное русло, что, возможно, и обусловливает наблюдаемые изменения [21, 22].
Оксид азота (NO), оказывающий мощное сосудорасширяющее действие (рис. 6-3), может служить причиной гипердинамического кровообращения и, следовательно, развития асцита, гепаторенального синдрома (см. главу 9) и портальной гипертензии (см. главу 10) [38j. NO синтезируется в эндотелии из L-аргинина; его действие связано с инактивацией гуанилатциклазы. Активностью NO-синтетазы можно управлять; эту реакцию подавляют аналоги
6-3), может служить причиной гипердинамического кровообращения и, следовательно, развития асцита, гепаторенального синдрома (см. главу 9) и портальной гипертензии (см. главу 10) [38j. NO синтезируется в эндотелии из L-аргинина; его действие связано с инактивацией гуанилатциклазы. Активностью NO-синтетазы можно управлять; эту реакцию подавляют аналоги
Рис. 6-1. ФКГ на верхушке (а) и на основании (б) сердца при циррозе печени. Выявляются систолический шум изгнания (М) и предсердный шум — пресистолический ритм галопа (G) [23].
Рис. 6-2. Сердечный выброс при циррозе печени во многих случаях повышен, но при билиарном циррозе остается нормальным. В норме сердечный индекс составляет в среднем 3,68±0,60 л/мин/м3, при циррозе печени — в среднем 5,36±1,98л/мин/м2 f29].
Рис. 6-3. Оксид азота (NO) — основной вазодилататор. Он образуется из L-аргинина с помощью фермента NО-синтетазы. Она может быть индуцирована эндотоксином и подавлена L-NMMA.
L-аргинина, например NG-монометил-L-аргинин (L-NMMA). Показано, что применение этих веществ устраняет многие сосудорасширяющие эффекты NO. У крыс с портальной гипертензией они уменьшали проявления гипердинамического кровообращения [19]. При циррозе печени у этих животных чувствительность к прессорному действию ингибиторов NO повышена; их введение повышает давление в воротной вене [30]. NO-синтетазу можно индуцировать стимуляцией бактериальным эндотоксином или цитокинами [26].
На кровообращение в воротной вене различные гастроинтестинальные пептиды, например вазоактивный интестинальный полипептид, субстанция Р и пептид, связанный с геном кальцитонина CGRP (II) [2], оказывают небольшое влияние. Глюкагон оказывает сосудорасширяющее действие и усиливает кровоток по непарной вене у больных циррозом, но мало влияет на сердечный индекс или на гемодинамику; таким образом, он почти не оказывает воздействия на системное сосудистое сопротивление [20]. Маловероятно, чтобы он был единственным вазодилататором, вызывающим описанные изменения.
Простагландины (El, E2 и Е12) обладают сосудорасширяющими свойствами; показано, что при хронических заболеваниях печени в воротную вену выделяются простаноиды [40]. Возможно, они частично обусловливают вазодилатацию.
При циррозе реактивность артерий на эндогенные вазоконстрикторы снижена [27].
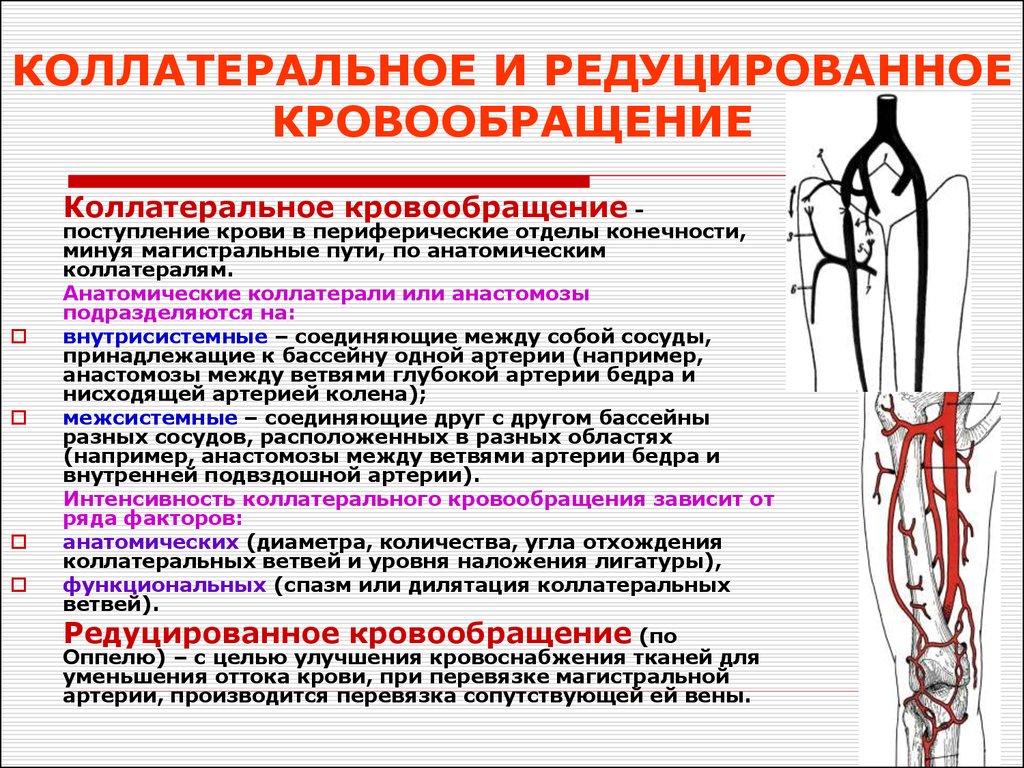
После трансплантации печени давление в воротной вене нормализуется, однако сохранение портосистемного коллатерального кровообращения не позволяет снижаться сердечному индексу и кровообращению во внутренних органах [9, 11].
Печёночно-лёгочный синдром [18]
Почти в трети случаев декомпенсированного цирроза насыщение артериальной крови кислородом уменьшено; у некоторых больных отмечается цианоз [32] (табл. 6-1, рис. 6-4). Вероятно, причиной этого является внутрилегочное шунтирование крови через микроскопические артериовенозные фистулы [12, 34]. Исследование лёгочной артерии методом инъекционных препаратов при циррозе печени выявляет значительное расширение её тонких периферических ветвей как в лёгочной ткани, так и в плевре, где в некоторых случаях наблюдаются сосудистые звёздочки (рис.
Таблица 6-1. Изменения в лёгких, осложняющие хроническое печёночно-клеточное заболевание
| Гипоксия | Высокое стояние диафрагмы |
| Внутрилегочное шунтирование крови | Базальный ателектаз |
| Нарушение вентиляционно-перфузионного соотношения | Первичная лёгочная гипертензия Портопульмональное шунтирование |
| Снижение уровня фактора переноса | Пятнистость лёгочного рисунка при рентгенографии |
| Плевральный выпот |
крови кислородом уменьшалось с 91 до 68%. Доказать наличие таких шунтов можно при аутопсии, заполняя сосудистое русло лёгких желатином с контрастным веществом [3].
Расширение сосудов лёгких и артериовенозное шунтирование можно выявить при эхокардиографии с контрастированием [16]. При сканировании лёгких с 99mТc, связанным с альбумином, или при ангиопульмонографии выявляется губчатое строение сосудов базальных отделов лёгких, соответствующее участкам инфильтрации на рентгенограммах.
Снижение диффузионной способности развивается при отсутствии рестриктивных нарушений вентиляции [37]. Вероятно, оно обусловлено расширением мелких кровеносных сосудов лёгких, осложняющим как далеко зашедший цирроз, так и фульминантную печёночную недостаточность [3, 36, 42]. Во всех случаях выявляется снижение уровня фактора переноса, вероятно, связанное с утолщением стенок мелких вен и капилляров слоем коллагена [36].
Рис. 6-4. Изменения в лёгких при печёночно-клеточной недостаточности.
Расширение сосудов лёгких сочетается с низким сопротивлением в них, которое не изменяется при гипоксии или нагрузке [1]. Это также ведёт к нарушению вентиляционно-перфузионного соотношения в лёгких [33|. Даже при сохранении вазоконстрикторной реакции лёгких на гипоксию давление в лёгочной артерии на фоне гипоксии и повышения уровня диоксида углерода оказывается сниженным. Показано образование портопульмональных анастомозов, но маловероятно, чтобы они влияли на уменьшение насыщения крови кислородом, поскольку в воротной вене содержание кислорода высокое. Кроме того, кровоток по ним, вероятно, незначителен.
Это также ведёт к нарушению вентиляционно-перфузионного соотношения в лёгких [33|. Даже при сохранении вазоконстрикторной реакции лёгких на гипоксию давление в лёгочной артерии на фоне гипоксии и повышения уровня диоксида углерода оказывается сниженным. Показано образование портопульмональных анастомозов, но маловероятно, чтобы они влияли на уменьшение насыщения крови кислородом, поскольку в воротной вене содержание кислорода высокое. Кроме того, кровоток по ним, вероятно, незначителен.
Наконец, снижению функции лёгких при циррозе печени могут способствовать высокое стояние диафрагмы (вследствие гепатомегалии или значительного асцита), плевральный выпот или хронические заболевания лёгких на фоне злостного курения и алкоголизма.
Симптом «барабанных палочек» выявляется часто, но он не всегда связан с цианозом и увеличением сердечного индекса. Обычно развиваются затруднение дыхания при вставании (платипноэ) и снижение оксигенации в положении стоя (ортодеоксия)|15|.
Наиболее выраженный цианоз и симптом «барабанных палочек» наблюдаются при хроническом активном гепатите и длительно существующем циррозе. При улучшении функции печени уменьшаются как цианоз, так и тени узлов в лёгочной ткани на рентгенограммах грудной клетки.
Механизм этих изменений остаётся неясным. Вероятно, их вызывает вещество, расширяющее сосуды лёгких, но связано ли это с нарушением синтеза или с нарушением метаболизма в поражённой печени, неизвестно |14].
Связь с трансплантацией печени
При подготовке к трансплантации печени следует обязательно провести исследование лёгких [14]. Необходимо выполнить рентгенографию грудной клетки. Следует определить РаО2, в положении больного стоя и лёжа, чтобы выявить ортодеоксию, которая указывает на вазодилатацию в лёгких. Её подтверждают с помощью контрастной эхокардиографии |15|. Кроме того, вазодилатацию в лёгких можно подтвердить при сканировании с 99m‘Тc, связанным с альбумином [15|.
После трансплантации печени внутрилегочное шунтирование, особенно диффузная прекапиллярная вазодилатация, уменьшается (рис. 6-7) [39]. У детей внутрилегочное шунтирование подвергается обратному развитию в течение нескольких недель после операции 117). При крупных внутрилегочных
Рис. 6-5. Цирроз печени. На макропрепарате плевры видно расширение сосудов, напоминающее сосудистые звездочки |3|.
Рис. 6-6. Артериограмма больного циррозом печени (срез на уровне базальных отделов левого лёгкого). Артерии (А) и вены (В) чередуются, видны артериовенозный шунт (X) и образующая его крупная артериальная ветвь. Для контрастирования использована бариевая взвесь [3|.
Рис. 6-7. Метод элиминации инертных газов выявляет прекращение внутрилегочного шунтирования и нормализацию вентиляционно-перфузионного соотношения после трансплантации печени [5|.
артериовенозных шунтах обратное развитие наблюдается не всегда и может потребоваться эмболизация спиралью, которую следует выполнить до трансплантации [31].
Поражение миокарда при сахарном диабете по данным эхокардиографии | Соколов
Аннотация
Эхокардиографические показатели центральной и внутрисердечной гемодинамики были проанализированы у 67 пациентов с компенсированным сахарным диабетом I и II типа длительностью от 2 до 6 лет. Контрольная группа состояла из 30 человек. Увеличение минутного объема, ударного объема, удельной мощности левого желудочка и снижение общего периферического сопротивления были выявлены в обеих группах пациентов. Эти сдвиги характерны для гиперкинетического типа центральной гемодинамики. Гипердинамический синдром был обусловлен гипертрофией левого желудочка у пациентов с инсулиннезависимым диабетом, а также из-за учащенного сердцебиения и скорости сокращения сердечно-сосудистой системы миокарда у пациентов с инсулинзависимым диабетом. Нарушение диастолической функции, выражающееся в увеличении конечного диастолического объема и сниженной скорости расслабления миокарда задней стенки левого желудочка, наблюдалось у всех пациентов, независимо от типа заболевания.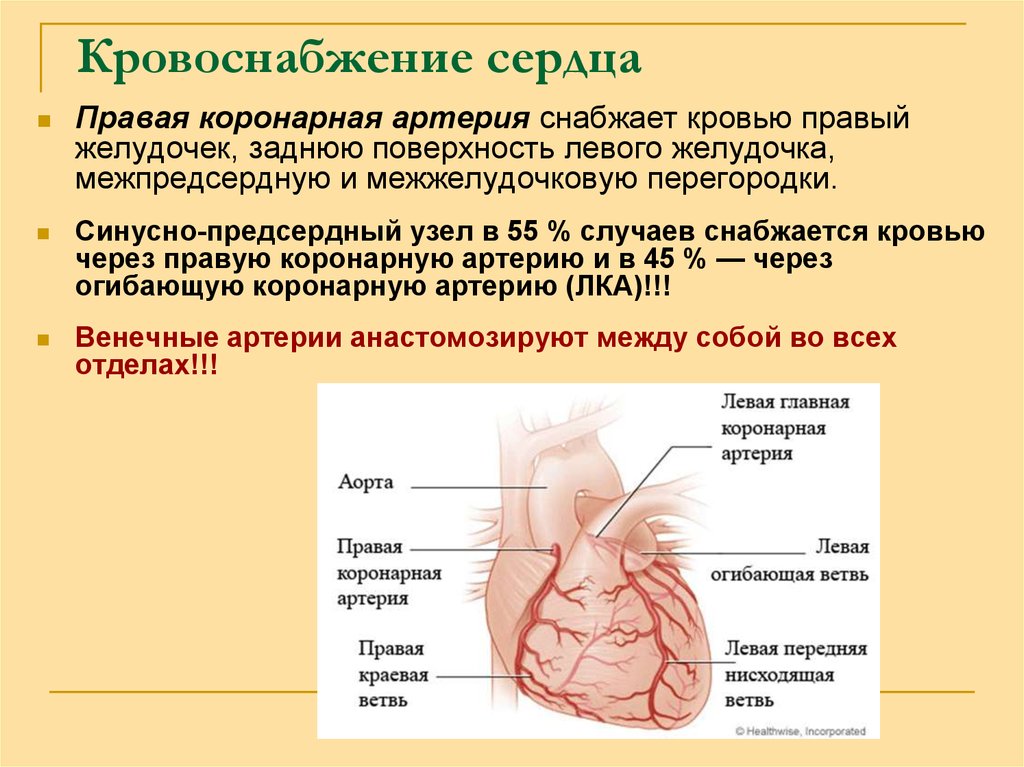 Вышеуказанные сдвиги являются предикторами снижения сократимости миокарда, ответственными за тяжелое и нетипичное течение ишемической болезни у диабетиков.
Вышеуказанные сдвиги являются предикторами снижения сократимости миокарда, ответственными за тяжелое и нетипичное течение ишемической болезни у диабетиков.
Течение сахарного диабета, как правило, сопровождается поражением сердечно-сосудистой системы, которое возникает с началом заболевания и вызывает высокую летальность больных [13,15,18].
Инсулинзависимый (ИЗСД) и инсулиннезави- симый (ИНСД) сахарный диабет различают по характеру сочетаний с патологией сердечно-сосудистой системы [1, 4]: ИЗСД сопровождается преимущественно развитием специфических микроангиопатий, у больных ИНСД, как правило, наблюдается поражение сердечно-сосудистой системы. Однако сведения о характере изменений гемодинамики при сахарном диабете, особенно в начальной стадии заболевания, немногочисленны! и разноречивы. По одним данным [2,6], для больных диабетом характерен гиперкинетический тип центральной гемодинамики, по другим [7,10] — гипокинетический. Отмечая связь диабета с артериальной гипертензией [17,22], некоторые авторы [20] указывают на зависимость уровня систолического артериального давления от продолжительности диабета.
Нет единства в оценке систолической и диастолической функций миокарда. Некоторые исследователи [3, 12] считают характерным для сахарного диабета снижение фракции изгнания, внутреннего размера полости левого желудочка и скорости укорочения . волокон миокарда, другие [19, 21] полагают, что систолическая и диастолическая функции левого желудочка могут ухудшаться только при продолжительном течении диабета.
Наряду с сообщениями о гипертрофии миокарда у больных сахарным диабетом [9,16] высказывалось мнение об уменьшении массы миокарда при декомпенсации диабета и восстановлении ее под влиянием нормализации метаболизма [8,11,14].
Интегративность патологических изменений при сахарном диабете, его взаимосвязь с ишемической болезнью сердца и гипертонической болезнью создают значительные трудности в своевременной диагностике и проведении лечебных мероприятий у этой категории больных. Наибольшие затруднения в диагностике представляют нетипичные проявления инфаркта миокарда на фоне сахарного диабета — при отсутствии или слабой выраженности болевого синдрома у 42% больных [5].
Материалы и методы
Для изучения характера изменений в миокарде при сахарном диабете обследовано 67 больных в стадии компенсации с продолжительностью заболевания от 2 до 6 лет, без клинических признаков недостаточности кровообращения: 28 больных (8 женщин и 20 мужчин) ИЗСД в возрасте 36,8 ± 2,52 года и 39 больных (12 женщин и 27 мужчин) ИНСД в возрасте 43,5 ± 2,24 года. Контрольную группу составили 30 здоровых лиц (9 женщин и 21 мужчина) в возрасте 29,4 ± 3,7 года.
Всем пациентам измеряли число сердечных сокращений (ЧСС) в минуту, артериальное давление (АД) — систолическое (САД), диастолическое (ДАД) и среднее (АДС1,). Эхокардиографию выполняли на аппарате 5К1-5000 (фирма «Хошх», Англия) путем М- и секторального сканирования. Изучали минутный (МО) и ударный (УО) объем, общее периферическое сопротивление (ОПС), удельную мощность (Ум) левого желудочка, массу миокарда (ММ) и индекс массы миокарда (ИММ) левого желудочка, конечный систолический (КСО) и конечный диастолический (КДО) объем, фракцию изгнания (ФИ), степень укорочения переднезаднего размера левого желудочка в систолу (% AS), скорость циркулярного укорочения волокон миокарда (Vcr), скорость сокращения (СС) и скорость расслабления (СР) задней стенки левого желудочка.
Показатели центральной и внутрисердечной гемодинамики у больных сахарным диабетом (М ± т)
Показатель | Здоровые лица (л = 30) | Больные ИЗСД (л = 28) | Больные ИНСД (л = 39) | Р\ | Р1 | р |
ЧСС в минуту | 67,6 ± 2,2 | 74,5 ± 2,3 | 71,23 ± 2,77 | < 0,05 | ||
САД ‘I | 116,4 ± 2,44 | 122,5 ± 4,3 | 125,66 ± 3,85 | — | < 0,05 | — |
ДАД \ мм рт. ст. | 76,4 ± 2,42 | 84,75 ± 2,76 | 84,67 ± 2,31 | < 0,05 | < 0,05 | |
АДср J | 89,76 ± 1,9 | 97,32 ± 3,25 | 98,1 ± 2,18 | < 0,05 | < 0,01 | |
МО, л/мин | 4,74 ± 0,34 | 6,66 ± 0,38 | 6,97 ± 0,42 | < 0,001 | <0,001 | |
УО, мл | 70,83 ± 5,78 | 90,84 ± 5,1 | 96,8 ± 6,34 | < 0,02 | < 0,01 | |
ОПС, дин ■ с ■ см’5 | 1508,4 ± 90,2 | 1246,7 ± 86,3 | 1217,0 ± 77,5 | < 0,05 | < 0,02 | |
УМ, кгм/мин/м2 | 3,26 ± 0,25 | 4,85 ± 0,3 | 4,65 ± 0,36 | < 0,001 | < 0,01 | |
ММ, г | 115,2 ± 5,1 | 116,8 ± 6,46 | 167,84 ± 6,21 | — | < 0,001 | < 0,001 |
ИММ, г/м2 | 66,49 ± 1,98 | 69,14 ± 2,6 | 84,18 ± 3,7 | — | < 0,001 | < 0,01 |
КСО ~1 | 32,64 ± 2,41 | 39,37 ± 4,68 | 39,45 + 4,62 | |||
КДО j мл | 104,8 ± 6,35 | 130,2 ± 9,32 | 136,25 ± 7,55 | < 0,05 | < 0,01 | |
ФИ, % | 69,37 ± 2,04 | 70,5 + 2,27 | 65,2 ± 1,95 | — | — | |
%4S | 39,5 ± 1,67 | 41,0 ± 1,83 | 41,1 ± 1,7 | — | — | |
Vcf> с’1 | 1,2 ± 0,08 | 1,47 ± 0,08 | 1,38 ± 0,07 | < 0,05 | — | |
СР } “А | 5,29 ± 0,46 13,2 ± 0,91 | 5,03 ± 0,46 9,81 ± 0,57 | 5,25 ± 0,3 9,53 ± 0,85 | < 0,01 | < 0,01 | — |
Примечание. Достоверность различий между показателями: рх — больных ИЗСД и здоровых, р2 — больных ИНСД и здоровых, р — больных ИЗСД и больных ИНСД.
Достоверность различий между показателями: рх — больных ИЗСД и здоровых, р2 — больных ИНСД и здоровых, р — больных ИЗСД и больных ИНСД.
Статистическая обработка результатов проведена с использованием критерия Стьюдента.
Результаты и их обсуждение
Из представленной таблицы видны отличия гемодинамических показателей больных сахарным диабетом от таковых в группе здоровых лиц. Достоверно более высокие МО, УО, УМ и более низкое ОПС у обследованных больных характеризуют гиперкинетический тип центральной гемодинамики. При обоих типах диабета отмечалось превышение контрольного уровня АДср. В формировании артериальной гипертензии одинаково важное для больных обеих групп значение имело ДАД, в то время как САД в большей мере возрастало при ИНСД. Особенностью же больных ИЗСД было достоверное увеличение ЧСС (р < 0,05) по сравнению с контрольной группой, отражающее одно из звеньев генеза гипердинамического синдрома при данном типе заболевания.
Изучение внутрисердечной гемодинамики раскрывает разные причины гиперкинетического синдрома при сахарном диабете I и II типов. Решающим фактором гипердинамии при ИНСД является резкое увеличение (/? < 0,001) ММ и
ИММ по сравнению не только со здоровыми, но и с больными ИЗСД, что свидетельствует о гипертрофии левого желудочка при диабете II типа.
Морфофункциональная гипертрофия миокарда при ИНСД обеспечивает усиленную функцию миокарда, увеличивая синтез нуклеиновых кислот и белков, приводя к дальнейшей гипертрофии миокарда. Увеличение ММ и ИММ направлено на предотвращение дефицита энергии в миокарде и острой сердечной недостаточности. Максимальная скорость и сила, а также энергетическая эффективность сокращения в гипертрофированном миокарде снижаются, а его функциональный резерв уменьшается после возникновения выраженной гипертрофии. Возникает комплекс повышенного изнашивания гипертрофированного миокарда.
У обследованных нами больных ИЗСД отсутствовал фактор кардиомегалии, а в происхождении повышенного сердечного выброса важную роль играло достоверное (р < 0,05) увеличение наряду с ЧСС и Vcf. Гиперфункция миокарда, проявляющаяся увеличением напряжения, влечет за собой выраженное повышение потребления кислорода, ресинтеза АТФ и не менее выраженную активацию синтеза нуклеиновых кислот и белков. В процессе непрерывной гиперфункции в условиях сахарного диабета возникает последовательная мобилизация энергетических и структурных резервов миокардиальных клеток с последующим истощением миокарда и нарушением его функций.
Гиперфункция миокарда, проявляющаяся увеличением напряжения, влечет за собой выраженное повышение потребления кислорода, ресинтеза АТФ и не менее выраженную активацию синтеза нуклеиновых кислот и белков. В процессе непрерывной гиперфункции в условиях сахарного диабета возникает последовательная мобилизация энергетических и структурных резервов миокардиальных клеток с последующим истощением миокарда и нарушением его функций.
Как видно из таблицы, общим для больных с разными типами сахарного диабета является значительное превышение нормального уровня КДО и снижение СР, свидетельствующее о нарушении диастолической релаксации левого желудочка. Зависимость насосной функции сердца от конечного ДАД в левом желудочке имеет нелинейный характер, а повышение конечного ДАД сверх оптимального практически не повышает уровень ударной работы. В отличие от этого зависимость пропульсивной работы сердца от КДО в тех же условиях линейна.
Причинами нарушения диастолической функции левого желудочка являются замедление расслабления миокарда, увеличение полости левого желудочка, увеличение ригидности стенки левого желудочка, ослабление эластической отдачи миокарда. При сахарном диабете нарушается способность миокарда полноценно расслабляться и наполняться кровью в диастолу. Особенность этого состояния связывается с увеличением ригидности (жесткости) миокарда, снижением его эластических свойств. В патогенезе увеличения жесткости — нарушение транспорта кальция, электромеханический дисбаланс, сопровождающиеся асинхронностью расслабления с механическими факторами. Особое значение придается именно внут- римиокардиальным факторам, связанным с дезорганизацией мышечных волокон гипертрофированного миокарда. Нарушения диастолической функции левого желудочка у обследованных нами больных на фоне гиперкинетического типа центральной гемодинамики являются предвестни- ( ком снижения сократительных свойств миокарда, выявляемого при нагрузочных пробах и в более поздние сроки заболевания.
При сахарном диабете нарушается способность миокарда полноценно расслабляться и наполняться кровью в диастолу. Особенность этого состояния связывается с увеличением ригидности (жесткости) миокарда, снижением его эластических свойств. В патогенезе увеличения жесткости — нарушение транспорта кальция, электромеханический дисбаланс, сопровождающиеся асинхронностью расслабления с механическими факторами. Особое значение придается именно внут- римиокардиальным факторам, связанным с дезорганизацией мышечных волокон гипертрофированного миокарда. Нарушения диастолической функции левого желудочка у обследованных нами больных на фоне гиперкинетического типа центральной гемодинамики являются предвестни- ( ком снижения сократительных свойств миокарда, выявляемого при нагрузочных пробах и в более поздние сроки заболевания.
Особенности внутрисердечной гемодинамики у больных сахарным диабетом находят отражение на ЭКГ. Нами отмечены многочисленные изменения ЭКГ, особенно при диабете II типа: в большинстве случаев отмечалось удлинение электрической систолы, изменение соотношения Ту] и Ту6. В 34,2% случаев регистрировались нарушения в периоде реполяризации зубца Т. от снижения до отрицательного зубца Т.
В 34,2% случаев регистрировались нарушения в периоде реполяризации зубца Т. от снижения до отрицательного зубца Т.
Выводы
- Изменения центральной гемодинамики у больных с компенсированной формой сахарного диабета в ранние сроки заболевания характеризовались гиперкинетическим синдромом (повышением МО, УО, УМ левого желудочка, снижением
1 ОПС), обусловленным у больных ИНСД гипертрофией левого желудочка, а у больных ИЗСД — увеличением ЧСС и Уср.
По данным внутрисердечной гемодинамики при отсутствии клинических признаков недостаточности кровообращения у больных сахарным диабетом I и II типов отмечены нарушения процессов диастолической релаксации в виде увеличения КДО и снижения СР задней стенки левого желудочка.
1. Анестиади В.В. Гормонально-метаболические аспекты предрасположенности к атеросклерозу при сахарном диабете: Автореф. дис. … канд. мед. наук. — Киев, 1985.
2. Балашов В.А., Диккер В.Е., Галенок В. А. и др. // Тер. арх. — 1985. — № 10. — С.139-142.
А. и др. // Тер. арх. — 1985. — № 10. — С.139-142.
3. Голубятникова Г.А. // Пробл. эндокринол. — 15)88. — № 6. — С.47-51. .
4. Давидепкова Е.Ф., Либерман И.С. Генетика сахарного диабета. — М.,1988.
5. Зефирова Г.С. // Клиническая эндокринология. — М., 1991 — С.192-262.
6. Зелинский Б.А. Функциональное состояние сердечно-сосудистой системы при сахарном диабете. — Киев, 1984.
7. Зубкова С.Т., Эпштейн Е.В, Булат О.В. // Пробл. эндокринол. — 1991. — № 1. — С. 20-22.
8. Ивериели В.П., Метревели Д.С., Цинцадзе Г.И. и др. // Кардиология. — 1984. — № 8. — С. 30-34.
9. Коган Б.М., Кузъмишин Л.Е, Соколова Д.А. // Сов. мед. — 1985. — № 4. — С. 76-79.
10. Коломойская М.Б., Гараган С.Ф, Гришина Р.А, Латыпова Г.А. // Пробл. эндокринол. — 1984. — № 6. — С. 7—10.
11. Литвиненко А.Ф. Функциональная диагностика и некоторые механизмы развития диабетических кардиомиопатий и ангиопатий: Дис. … д-ра мед. наук. — Киев, 1978.
12. Метревели Д.С., Мегреладзе И. И., Орджоникидзе С.П. и др. // Тер. арх. — 1982. — № 10. — С. 18—21.
И., Орджоникидзе С.П. и др. // Тер. арх. — 1982. — № 10. — С. 18—21.
13. Панков Ю.А., Чехранова М.К., Бутнев В.Ю. // Пробл. эндокринол. — 1990. — № 4. — С. 3—11.
14. Применение метода эхокардиографии в диагностике диабетической кардиопатии: Метод, рекомендации. — Тбилиси, 1985.
15. Славина Л. С. Сердце при эндокринных заболеваниях. М., 1979.
16. Airaksinen К.Е.J., Koistinen М.J., Ikaneimo М.J. et al. // Diabetes Саге. — 1989. — Vol. 12. — Р. 159-161.
17. Danielsen R. // Acta med. scand. — 1988. — Vol.224, № 3. — P. 249—256.
18. Panzram Y, Pissarek D, Lundershausen R, Schauer U. J. W. // Dtsch. med. Wochenschr. — 1987. — Bd 112, № 34. S. 1283— 1287.
19. Park J. W., Ziegler A. G., Janka H. U. et al. // Klin. Wochenschr. — 1988. — Bd 66, № 17. — S. 773-778.
20. Teuscher A., Egger M., Herman J. B. // Arch, intern. Med. — Vol 149, № 9. — P. 1142-1945.
21. Thuesen L., Christiansen J.S., Mogensen С.E, Henningsen P. / / Acta med. scand. — 1988. — Vol. 224, № 4. — P. 343—348.
— Vol. 224, № 4. — P. 343—348.
22. Uusitupa M, Neskanen L, Siitonen O, Pyorala K. // Diabet. Metabol. — 1987. — Vol. 13, № 3. — P. 369-374.
[Гипердинамическое кровообращение у пациентов с циррозом печени и портальной гипертензией]
Обзор
. 2009 г., сен; 54 (3): 143-8.
doi: 10.4166/kjg.2009.54.3.143.
[Статья в Корейский]
Мун Ён Ким 1 , Сун Ку Байк
принадлежность
- 1 Кафедра внутренних болезней, Институт фундаментальных медицинских наук, Медицинский колледж Вонджу Университета Йонсей, Вонджу, Корея.
- PMID: 19844149
- DOI:
10.
 4166/кг.2009.54.3.143
4166/кг.2009.54.3.143
Бесплатная статья
Обзор
[Статья в Корейский]
Мун Янг Ким и др. Корейский J Гастроэнтерол. 2009 Сентябрь
Бесплатная статья
. 2009 г., сен; 54 (3): 143-8.
doi: 10.4166/kjg.2009.54.3.143.
Авторы
Мун Янг Ким 1 , Сун Ку Байк
принадлежность
- 1 Кафедра внутренних болезней, Институт фундаментальной медицины, Медицинский колледж Вонджу Университета Йонсей, Вонджу, Корея.
- PMID: 19844149
- DOI: 10.4166/кг.2009.54.3.143
Абстрактный
Гипердинамическое кровообращение у пациентов с циррозом печени характеризуется повышенным сердечным выбросом и частотой сердечных сокращений, а также сниженным системным сосудистым сопротивлением с низким артериальным давлением и в настоящее время сосредоточено на понимании патогенеза из-за возможности разработки нового метода лечения. В основном эти гемодинамические изменения возникают при портальной гипертензии. Портосистемные коллатерали развиваются, чтобы уравновесить повышенное сопротивление внутрипеченочных сосудов портальному кровотоку и вызвать увеличение венозного возврата к сердцу. Повышенное напряжение сдвига в сосудистых эндотелиальных клетках, связанное с высоким кровотоком за счет портосистемного шунтирования, способствует этой активизации eNOS, что приводит к перепроизводству NO. Кроме того, обход портосистемных коллатералей и избегание деградации избыточно вырабатываемых циркулирующих вазодилататоров в пораженной печени может способствовать вазодилатации периферических артерий. Вазодилатация системного и чревного кровообращения приводит к снижению системного сосудистого сопротивления и увеличению сердечного выброса и чревного кровотока. Кроме того, нейрогуморальные сосудосуживающие системы, включая системную нервную систему, ренин-ангиотензин-альдостероновую систему и вазопрессин, интенсивно активируются вторично по отношению к вазодилатации. Однако гипердинамическое кровообращение будет более усугубляться активированными сосудосуживающими системами. При прогрессировании цирротического процесса гипердинамические чередования могут быть более глубокими за счет гипореактивности к вазоконстрикторам и усиленного шунтирования в сочетании с вегетативной нейропатией. В конце концов, расширение внутренних артерий приводит к увеличению портального венозного притока, поддерживая повышенное портальное венозное давление.
Кроме того, обход портосистемных коллатералей и избегание деградации избыточно вырабатываемых циркулирующих вазодилататоров в пораженной печени может способствовать вазодилатации периферических артерий. Вазодилатация системного и чревного кровообращения приводит к снижению системного сосудистого сопротивления и увеличению сердечного выброса и чревного кровотока. Кроме того, нейрогуморальные сосудосуживающие системы, включая системную нервную систему, ренин-ангиотензин-альдостероновую систему и вазопрессин, интенсивно активируются вторично по отношению к вазодилатации. Однако гипердинамическое кровообращение будет более усугубляться активированными сосудосуживающими системами. При прогрессировании цирротического процесса гипердинамические чередования могут быть более глубокими за счет гипореактивности к вазоконстрикторам и усиленного шунтирования в сочетании с вегетативной нейропатией. В конце концов, расширение внутренних артерий приводит к увеличению портального венозного притока, поддерживая повышенное портальное венозное давление. Гипердинамическое кровообращение тесно связано с портальной гипертензией при циррозе печени, поэтому разумно иметь полное представление о патогенезе гипердинамического кровообращения для разработки нового метода лечения.
Гипердинамическое кровообращение тесно связано с портальной гипертензией при циррозе печени, поэтому разумно иметь полное представление о патогенезе гипердинамического кровообращения для разработки нового метода лечения.
Похожие статьи
Гипердинамическое кровообращение при циррозе печени: обзор.
Блендис Л., Вонг Ф. Блендис Л. и соавт. Фармакол Тер. 2001 март; 89(3):221-31. doi: 10.1016/s0163-7258(01)00124-3. Фармакол Тер. 2001. PMID: 11516477 Обзор.
Дилатация внутренних органов и гипердинамический циркуляторный синдром при циррозе печени.
Болоньези М., Ди Пасколи М., Верардо А., Гатта А. Болоньези М. и др. Мир J Гастроэнтерол. 2014 14 марта; 20 (10): 2555-63. дои: 10.3748/wjg.
 v20.i10.2555.
Мир J Гастроэнтерол. 2014.
PMID: 24627591
Бесплатная статья ЧВК.
Обзор.
v20.i10.2555.
Мир J Гастроэнтерол. 2014.
PMID: 24627591
Бесплатная статья ЧВК.
Обзор.Патофизиология портальной гипертензии.
Bosch J, Pizcueta P, Feu F, Fernández M, García-Pagan JC. Бош Дж. и др. Гастроэнтерол Клин Норт Ам. 1992 марта; 21(1):1-14. Гастроэнтерол Клин Норт Ам. 1992. PMID: 1568769 Обзор.
Патофизиология артериальной вазодилатации и гипердинамического кровообращения при циррозе печени.
Мёллер С., Бендтсен Ф. Мёллер С. и соавт. Печень инт. 2018 апр; 38 (4): 570-580. doi: 10.1111/liv.13589. Epub 2018 15 января. Печень инт. 2018. PMID: 28921803 Обзор.
Благоприятные эффекты куркумина у цирротических крыс с портальной гипертензией.

Хсу С.Дж., Ли Д.Ю., Линь Т.И., Се Ю.Х., Хуан Х.К., Ли Ф.Ю., Линь Х.К., Хоу М.С., Ли С.Д. Хсу С.Дж. и др. Представитель Biosci, 15 декабря 2017 г .; 37 (6): BSR20171015. дои: 10.1042/BSR20171015. Печать 2017 22 декабря. Представитель Biosci, 2017 г. PMID: 29162665 Бесплатная статья ЧВК.
Посмотреть все похожие статьи
Цитируется
Применение УЗИ для диагностики цирроза/портальной гипертензии.
Хан С.К., Ким М.Ю., Кан С.Х., Байк С.К. Хан С.К. и др. J Med Ultrason (2001). 2022 июль; 49 (3): 321-331. doi: 10.1007/s10396-022-01191-w. Epub 2022 18 февраля. J Med Ultrason (2001). 2022. PMID: 35179669 Обзор.
Гемодинамические изменения и раннее восстановление функции печеночного трансплантата после трансплантации печени.

Дашти С.Х., Касраянфард А., Эбрахими А., Нассири-Тооси М., Пакшир М.С., Рахими М., Джафарян А. Дашти С.Х. и др. Int J Organ Transplant Med. 2020;11(1):1-7. Int J Organ Transplant Med. 2020. PMID: 33324472 Бесплатная статья ЧВК.
Клинические рекомендации KASL по циррозу печени: асцит и связанные с ним осложнения.
Корейская ассоциация изучения печени (KASL). Корейская ассоциация изучения печени (KASL). Клин Мол Гепатол. 2018 сен; 24 (3): 230-277. doi: 10.3350/cmh.2018.1005. Epub 2018 9 июля. Клин Мол Гепатол. 2018. PMID: 29991196 Бесплатная статья ЧВК. Обзор. Аннотация недоступна.
Роль ренин-ангиотензиновой системы в развитии фиброза печени и портальной гипертензии.
Шим К.
 Ю., Ом Ю.В., Ким М.Ю., Канг Ш., Байк С.К.
Шим К.Ю. и др.
Корейский J Intern Med. 2018 май; 33(3):453-461. doi: 10.3904/kjim.2017.317. Epub 2018 21 февраля.
Корейский J Intern Med. 2018.
PMID: 29462546
Бесплатная статья ЧВК.
Обзор.
Ю., Ом Ю.В., Ким М.Ю., Канг Ш., Байк С.К.
Шим К.Ю. и др.
Корейский J Intern Med. 2018 май; 33(3):453-461. doi: 10.3904/kjim.2017.317. Epub 2018 21 февраля.
Корейский J Intern Med. 2018.
PMID: 29462546
Бесплатная статья ЧВК.
Обзор.Лечение рефрактерного асцита при циррозе: мы устарели?
Аннамалай А., Уисдом Л., Херада М., Нурредин М., Аюб В., Сундарам В., Кляйн А., Ниссен Н. Аннамалай А. и др. Мир J Гепатол. 2016 8 октября; 8 (28): 1182-1193. дои: 10.4254/wjh.v8.i28.1182. Мир J Гепатол. 2016. PMID: 27729954 Бесплатная статья ЧВК. Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Гипердинамическое кровообращение при циррозе: обзор
Обзор
. 2001 март; 89(3):221-31.
2001 март; 89(3):221-31.
doi: 10.1016/s0163-7258(01)00124-3.
л Блендис 1 , Ф Вонг
принадлежность
- 1 Институт гастроэнтерологии, Тель-Авивский медицинский центр Сураски, улица Вейцмана, 6, Тель-Авив 64239, Израиль. [email protected]
- PMID: 11516477
- DOI: 10.1016/s0163-7258(01)00124-3
Обзор
L Blendis et al. Фармакол Тер. 2001 март
. 2001 март; 89(3):221-31.
2001 март; 89(3):221-31.
doi: 10.1016/s0163-7258(01)00124-3.
Авторы
л Блендис 1 , Ф Вонг
принадлежность
- 1 Институт гастроэнтерологии, Тель-Авивский медицинский центр Сураски, улица Вейцмана, 6, Тель-Авив 64239, Израиль. [email protected]
- PMID: 11516477
- DOI: 10.1016/s0163-7258(01)00124-3
Абстрактный
Гипердинамическая циркуляция начинается в портальном венозном русле как следствие портальной гипертензии из-за повышенного сопротивления кровотоку из-за измененной морфологии печеночных сосудов при хроническом заболевании печени. Расширение воротной вены связано с усилением кровотока, а также с открытием или образованием вено-венозных шунтов и спленомегалией. В то же время портальная гипертензия приводит к субклинической задержке натрия, что приводит к расширению всех отделов жидкости организма, включая системный и центральный объемы крови. Это увеличение объема крови связано с релаксацией сосудов, проявляющейся подавлением ренин-ангиотензин-альдостероновой системы, первоначально только в положении больного лежа. Острое уменьшение объема у таких пациентов приводит к нормализации гипердинамического кровообращения, в то время как острое увеличение объема приводит к усилению натрийуреза. По мере прогрессирования заболевания печени и ухудшения ее функции системная гипердинамическая циркуляция становится более выраженной с активацией ренин-ангиотензин-альдостероновой системы. Наличие вазодилатации при сильно повышенных уровнях циркулирующих вазоконстрикторов можно объяснить гипореактивностью сосудов из-за повышения уровня вазодилататоров, таких как оксид азота, а также развитием вегетативной невропатии.
Расширение воротной вены связано с усилением кровотока, а также с открытием или образованием вено-венозных шунтов и спленомегалией. В то же время портальная гипертензия приводит к субклинической задержке натрия, что приводит к расширению всех отделов жидкости организма, включая системный и центральный объемы крови. Это увеличение объема крови связано с релаксацией сосудов, проявляющейся подавлением ренин-ангиотензин-альдостероновой системы, первоначально только в положении больного лежа. Острое уменьшение объема у таких пациентов приводит к нормализации гипердинамического кровообращения, в то время как острое увеличение объема приводит к усилению натрийуреза. По мере прогрессирования заболевания печени и ухудшения ее функции системная гипердинамическая циркуляция становится более выраженной с активацией ренин-ангиотензин-альдостероновой системы. Наличие вазодилатации при сильно повышенных уровнях циркулирующих вазоконстрикторов можно объяснить гипореактивностью сосудов из-за повышения уровня вазодилататоров, таких как оксид азота, а также развитием вегетативной невропатии. Однако вазодилатация не является генерализованной, а ограничивается определенными сосудистыми руслами, такими как чревное и легочное русла. Даже в этом случае статус может меняться в зависимости от естественного течения болезни, поскольку даже кровоток в портальной вене может уменьшаться и становиться обратным при прогрессирующем заболевании. Необратимость этих изменений после трансплантации печени может быть связана с ремоделированием и ангиогенезом.
Однако вазодилатация не является генерализованной, а ограничивается определенными сосудистыми руслами, такими как чревное и легочное русла. Даже в этом случае статус может меняться в зависимости от естественного течения болезни, поскольку даже кровоток в портальной вене может уменьшаться и становиться обратным при прогрессирующем заболевании. Необратимость этих изменений после трансплантации печени может быть связана с ремоделированием и ангиогенезом.
Похожие статьи
Гипердинамическое кровообращение у больных циррозом печени и портальной гипертензией.
Ким М.Ю., Байк СК. Ким М.Ю. и др. Корейский J Гастроэнтерол. 2009 г., сен; 54 (3): 143-8. doi: 10.4166/kjg.2009.54.3.143. Корейский J Гастроэнтерол. 2009. PMID: 19844149 Обзор. Корейский.
Патофизиология и рациональная основа терапии.

Грасия-Санчо Дж., Маесо-Диас Р., Бош Дж. Грасия-Санчо Дж. и др. Копать Дис. 2015;33(4):508-14. дои: 10.1159/000374099. Epub 2015 6 июля. Копать Дис. 2015. PMID: 26159267
Дилатация внутренних органов и гипердинамический циркуляторный синдром при циррозе печени.
Болоньези М., Ди Пасколи М., Верардо А., Гатта А. Болоньези М. и др. Мир J Гастроэнтерол. 2014 14 марта; 20 (10): 2555-63. дои: 10.3748/wjg.v20.i10.2555. Мир J Гастроэнтерол. 2014. PMID: 24627591 Бесплатная статья ЧВК. Обзор.
Циркулирующие продукты оксида азота отражают не только высвобождение оксида азота при циррозе печени и портальной гипертензии.
Афзелиус П., Базеги Н., Бие П., Бендтсен Ф., Вестбо Дж.
 , Меллер С.
Афцелиус П. и др.
Печень инт. 2011 Октябрь; 31 (9): 1381-7. doi: 10.1111/j.1478-3231.2011.02576.x. Epub 2011 5 июля.
Печень инт. 2011.
PMID: 21745317
, Меллер С.
Афцелиус П. и др.
Печень инт. 2011 Октябрь; 31 (9): 1381-7. doi: 10.1111/j.1478-3231.2011.02576.x. Epub 2011 5 июля.
Печень инт. 2011.
PMID: 21745317Патофизиология портальной гипертензии.
Bosch J, Pizcueta P, Feu F, Fernández M, García-Pagan JC. Бош Дж. и др. Гастроэнтерол Клин Норт Ам. 1992 март; 21(1):1-14. Гастроэнтерол Клин Норт Ам. 1992. PMID: 1568769 Обзор.
Посмотреть все похожие статьи
Цитируется
Венозная тромбоэмболия у госпитальных пациентов с циррозом печени: систематический обзор.
да Крус Рено Л., Тустуми Ф., Вайсберг Д.Р., Роша-Сантос В., Пиньейру Р.С., Маседо Р.А., Насиф Л.С., Дукатти Л., Де Мартино Р.
 Б., Тревизан А.М., Карнейро-Д’Альбукерке Л., Андраус В.
да Круз Рено Л. и др.
Front Med (Лозанна). 2022 7 ноября; 9:1027882. doi: 10.3389/fmed.2022.1027882. Электронная коллекция 2022.
Front Med (Лозанна). 2022.
PMID: 36419795
Бесплатная статья ЧВК.
Б., Тревизан А.М., Карнейро-Д’Альбукерке Л., Андраус В.
да Круз Рено Л. и др.
Front Med (Лозанна). 2022 7 ноября; 9:1027882. doi: 10.3389/fmed.2022.1027882. Электронная коллекция 2022.
Front Med (Лозанна). 2022.
PMID: 36419795
Бесплатная статья ЧВК.Сравнение портальной гипертонической гастропатии и сосудистой эктазии антрального отдела желудка: обновление.
Раджабния М., Хатами Б., Кетаби Могхадам П., Мохаммади М., Рафизаде М., Мангели Ф., Фатхи М., Джаханян А. Раджабния М. и соавт. Gastroenterol Hepatol Bed Bench. Лето 2022 г .; 15 (3): 204–218. дои: 10.22037/ghfbb.v15i3.2561. Gastroenterol Hepatol Bed Bench. 2022. PMID: 36311963 Бесплатная статья ЧВК. Обзор.
Исторические аспекты асцита и гепаторенального синдрома.
Вонг Ф., Блендис Л. Вонг Ф. и др. Clin Liver Dis (Хобокен). 2021 29 октября; 18 (Приложение 1): 14-27. doi: 10.1002/cld.1090. электронная коллекция 2021 окт. Clin Liver Dis (Хобокен). 2021. PMID: 34745581 Бесплатная статья ЧВК. Обзор.
Различные структурные и динамические компоненты портальной гипертензии в различных животных моделях и этиологии заболеваний печени человека.
Кенигсхофер П., Хофер Б.С., Брусиловская К., Симбруннер Б., Петренко О., Веран К., Герак М., Штифт Дж., Лампихлер К., Тимельталер Г., Бауэр Д., Хартл Л., Робл Б., Сибила М., Подессер Б.К., Оберхубер Г., Швабль П., Мандорфер М., Траунер М., Рейбергер Т. Кенигсхофер П. и соавт. Гепатология. 2022 март; 75 (3): 610-622. doi: 10.1002/hep.32220. Epub 2021 20 декабря. Гепатология. 2022. PMID: 34716927 Бесплатная статья ЧВК.
Желчные кислоты, цирроз печени и внепеченочная сосудистая дисфункция.