Содержание
Синдром задержки роста плода: определение и классификация
Вы когда-нибудь задумывались, что происходит внутри вашего растущего животика во время беременности? Ведь там творится настоящее чудо! Но иногда природа преподносит сюрпризы, и один из них — синдром задержки роста плода (СЗРП). Звучит пугающе, не так ли? Но давайте разберемся, что это за зверь такой и стоит ли его бояться.
СЗРП — это состояние, при котором малыш растет медленнее, чем его сверстники в утробе. Представьте себе, что все детки в классе вымахали, а ваш карапуз остался коротышкой. Примерно так же происходит и в животике у мамы. Но не спешите паниковать! СЗРП бывает разной степени тяжести, и сегодня мы поговорим о самой легкой — СЗРП 1 степени при беременности.
Итак, что же такое СЗРП 1 степени при беременности? Это когда вес малыша отстает от нормы на 10-20%. Звучит не так уж и страшно, правда? Это как если бы ваш ребенок весил не 3 кг, а 2,7 кг. Согласитесь, разница не такая уж и большая. Но все же, почему это происходит?
Причин может быть множество: от генетических особенностей до проблем с плацентой. Иногда виноваты вредные привычки мамы (да-да, курение и алкоголь — это табу!), а иногда — хронические заболевания. Бывает, что просто не хватает питательных веществ. Вот и получается, что малыш недополучает «строительный материал» для роста.
Как распознать СЗРП 1 степени?
Вы наверняка спросите: «А как же понять, что у меня СЗРП 1 степени при беременности? Что это такое в реальной жизни?» Спокойно, дорогие будущие мамочки! Для этого существуют регулярные осмотры у врача и УЗИ. Именно на УЗИ доктор измерит окружность животика малыша, длину его бедренной кости и другие параметры. Если что-то не так, он сразу забьет тревогу.
Но иногда и сама мама может заподозрить неладное. Например, если живот растет медленнее, чем должен, или если шевеления малыша становятся менее активными. Однако не стоит ставить себе диагноз самостоятельно — лучше обратиться к специалисту.

Что делать, если диагностировали СЗРП 1 степени?
Вот тут-то и начинается самое интересное! Если вам поставили диагноз СЗРП 1 степени при беременности, не паникуйте. Это не приговор, а сигнал к действию. Врач назначит дополнительные обследования, чтобы выяснить причину задержки роста. Возможно, вам придется сдать анализы крови, пройти допплерографию (это такое УЗИ, которое позволяет оценить кровоток в сосудах плаценты и пуповины).
После того, как причина будет установлена, начнется лечение. Оно может включать в себя изменение образа жизни (больше отдыха, правильное питание), прием витаминов и микроэлементов, а иногда и медикаментозную терапию. Главное — строго следовать рекомендациям врача и не заниматься самолечением.
Жизнь с диагнозом СЗРП 1 степени
Знаете, что самое удивительное? Многие малыши с СЗРП 1 степени после рождения быстро догоняют своих сверстников. Они как те самые гадкие утята, которые превращаются в прекрасных лебедей. Так что не стоит отчаиваться раньше времени!
Конечно, беременность с таким диагнозом потребует от вас больше внимания и заботы. Возможно, придется чаще посещать врача, проходить УЗИ и другие обследования. Но разве это не маленькая цена за здоровье вашего малыша?
Помните, что СЗРП 1 степени — это не приговор. Это просто особенность развития вашего ребенка. Кто знает, может быть, именно эта «задержка» сделает его особенным и уникальным? Ведь все великие люди чем-то отличались от других, не так ли?
Профилактика СЗРП: лучше предупредить, чем лечить
А теперь давайте поговорим о том, как предотвратить СЗРП. Ведь, как говорится, лучше предупредить болезнь, чем ее лечить. Итак, что же можно сделать?
- Правильное питание. Ешьте разнообразно и полезно. Ваш рацион должен включать достаточно белка, полезных жиров, углеводов, витаминов и минералов.
- Физическая активность. Нет, не нужно бегать марафоны. Достаточно регулярных прогулок на свежем воздухе и легкой гимнастики для беременных.
- Отказ от вредных привычек. Курение, алкоголь, наркотики — это табу для беременных.
- Регулярное наблюдение у врача. Не пропускайте визиты к гинекологу и вовремя сдавайте все анализы.
- Контроль хронических заболеваний. Если у вас есть какие-то хронические болезни, обязательно обсудите с врачом, как их контролировать во время беременности.
Помните, что ваше здоровье и здоровье вашего малыша — в ваших руках. Будьте внимательны к себе и своему организму, прислушивайтесь к рекомендациям врача, и тогда СЗРП 1 степени при беременности не станет для вас проблемой.

Мифы и реальность о СЗРП 1 степени
В заключение давайте развеем несколько мифов о СЗРП 1 степени. Ведь информация — это сила, особенно когда речь идет о здоровье вашего малыша.
- Миф 1: СЗРП 1 степени означает, что ребенок родится недоношенным. Реальность: СЗРП и недоношенность — это разные вещи. СЗРП может быть и у доношенных детей.
- Миф 2: Если у меня СЗРП 1 степени, значит, я плохая мать. Реальность: СЗРП может возникнуть по многим причинам, многие из которых не зависят от матери.
- Миф 3: СЗРП 1 степени означает, что ребенок будет отставать в развитии после рождения. Реальность: Многие дети с СЗРП 1 степени быстро догоняют сверстников после рождения.
Итак, мы разобрались, что такое СЗРП 1 степени при беременности. Это не приговор, а всего лишь повод быть более внимательным к своему здоровью и здоровью малыша. С правильным подходом и заботой врача, вы сможете преодолеть эту трудность и родить здорового и счастливого малыша. Помните, что каждая беременность уникальна, и ваша — не исключение. Верьте в себя и своего ребенка, и все обязательно будет хорошо!
Причины возникновения СЗРП 1 степени: факторы риска для матери и плода
Представьте себе, что ваш малыш — это нежный цветок, растущий в уютной теплице вашего животика. Как и любому растению, ему нужны правильные условия для роста. Но что делать, если эти условия нарушаются? Тут-то и может возникнуть синдром задержки роста плода (СЗРП) 1 степени. Но не спешите паниковать! Давайте разберемся, что это за зверь такой и откуда он берется.
СЗРП 1 степени при беременности — это когда ваш кроха отстает в росте на 10-20% от своих «одноклассников» в утробе. Звучит как-то не очень, да? Но на самом деле, это самая легкая форма задержки роста. Считайте, что ваш малыш просто немного подзадержался на старте, но еще может нагнать своих сверстников.
Материнские факторы: когда мама невольно «тормозит» рост малыша
Итак, что же может стать причиной такого «торможения»? Начнем с самого очевидного — с мамы. Ведь именно она создает ту самую «теплицу» для своего цветочка. Какие же факторы риска существуют со стороны матери?

- Возраст: Да-да, возраст имеет значение! Слишком юные (до 18 лет) или, наоборот, возрастные (после 35 лет) мамочки чаще сталкиваются с СЗРП.
- Вредные привычки: Курение, алкоголь, наркотики — это настоящий яд для малыша. Они могут серьезно затормозить его рост.
- Недостаточное питание: Если мама не ест за двоих (в хорошем смысле), малышу может не хватать «строительного материала» для роста.
- Хронические заболевания: Гипертония, диабет, заболевания почек и сердца могут негативно влиять на рост плода.
- Инфекции: Некоторые инфекции, особенно вирусные, могут замедлить рост малыша.
Но не думайте, что если у вас есть какой-то из этих факторов, то СЗРП неизбежен. Это лишь повод быть более внимательной к своему здоровью и чаще посещать врача.
Плацентарные проблемы: когда «кормилица» подводит
Теперь давайте поговорим о плаценте. Эта удивительная «кормилица» обеспечивает малыша всем необходимым. Но иногда она может подвести. Какие проблемы с плацентой могут привести к СЗРП 1 степени?
- Плацентарная недостаточность: Когда плацента не справляется со своими обязанностями и не может обеспечить малыша всем необходимым.
- Аномалии плаценты: Неправильное прикрепление или форма плаценты могут ухудшить питание плода.
- Инфаркты плаценты: Звучит страшно, но это просто участки отмершей ткани в плаценте, которые мешают ей нормально работать.
Эти проблемы могут возникнуть из-за различных причин: от генетических особенностей до внешних факторов. Главное — вовремя их обнаружить и начать лечение.
Генетические факторы: когда виноваты гены
А теперь давайте поговорим о генетике. Иногда СЗРП 1 степени — это просто особенность развития вашего малыша, заложенная в его генах. Это как если бы вы посадили семечко кактуса и ждали, что вырастет пальма. Не вырастет, как ни старайся!
Какие генетические факторы могут привести к СЗРП?
- Хромосомные аномалии: Иногда в генетическом коде малыша происходят сбои, которые могут повлиять на его рост.
- Наследственные заболевания: Некоторые генетические заболевания могут проявляться уже в утробе в виде задержки роста.
- Многоплодная беременность: Когда малышей двое или больше, им приходится делить ресурсы, что может привести к отставанию в росте одного или нескольких плодов.
Но не пугайтесь раньше времени! Большинство генетических проблем выявляются на ранних сроках беременности. А СЗРП 1 степени — это еще не приговор, а повод быть более внимательными к здоровью малыша.

Внешние факторы: когда окружающая среда не на нашей стороне
Иногда причина СЗРП 1 степени кроется не внутри, а снаружи. Окружающая среда может сильно влиять на развитие малыша. Какие внешние факторы могут стать причиной задержки роста?
- Экологические проблемы: Загрязнение воздуха, воды и почвы может негативно сказаться на развитии плода.
- Радиация: Даже небольшие дозы радиации могут повлиять на рост малыша.
- Стресс: Да-да, постоянное напряжение мамы может передаваться малышу и тормозить его рост.
- Лекарства: Некоторые медикаменты могут замедлять рост плода. Поэтому всегда консультируйтесь с врачом перед приемом любых лекарств.
Конечно, мы не можем контролировать все факторы окружающей среды. Но в наших силах минимизировать их влияние. Например, можно переехать в более экологически чистый район или научиться управлять стрессом.
Как распознать СЗРП 1 степени?
Теперь, когда мы знаем о причинах, давайте поговорим о том, как распознать СЗРП 1 степени. Ведь, как говорится, кто предупрежден, тот вооружен! Какие же признаки могут указывать на то, что у вашего малыша СЗРП 1 степени?
- Отставание в росте: На УЗИ врач может заметить, что размеры плода меньше нормы для данного срока беременности.
- Маленький живот: Если ваш животик растет медленнее, чем должен, это может быть признаком СЗРП.
- Снижение активности плода: Если малыш стал шевелиться реже или менее активно, это тоже может быть сигналом.
Но помните, что только врач может поставить диагноз СЗРП 1 степени. Не пытайтесь диагностировать себя сами!
Что делать, если диагностирован СЗРП 1 степени?
Итак, диагноз поставлен. Что теперь? Не паникуйте! СЗРП 1 степени — это не приговор, а повод для более тщательного наблюдения и лечения. Вот что обычно рекомендуют врачи:
- Более частые визиты к врачу: Возможно, вам придется посещать гинеколога чаще обычного.
- Дополнительные УЗИ: Чтобы следить за ростом малыша в динамике.
- Допплерография: Для оценки кровотока в пуповине и плаценте.
- Коррекция образа жизни: Возможно, придется изменить режим дня, питание или физическую активность.
- Медикаментозное лечение: В некоторых случаях врач может назначить лекарства для улучшения кровотока в плаценте.
Главное — строго следовать рекомендациям врача и не заниматься самолечением. Помните, здоровье вашего малыша — в ваших руках!
Прогноз при СЗРП 1 степени
И напоследок давайте поговорим о том, что ждет малышей с СЗРП 1 степени после рождения. Спойлер: все не так страшно, как может показаться на первый взгляд!
Большинство детей с СЗРП 1 степени после рождения быстро догоняют своих сверстников в росте и весе. Это как с теми черепашками из сказки — медленный старт не мешает им в итоге прийти к финишу вместе со всеми. Конечно, таким деткам может потребоваться немного больше внимания и заботы в первые месяцы жизни. Но с правильным уходом и питанием они обычно ничем не отличаются от своих сверстников уже к году.
Однако важно помнить, что каждый случай уникален. Поэтому после рождения малыша с СЗРП 1 степени важно регулярно посещать педиатра и следить за его развитием. Но не волнуйтесь раньше времени — ваша любовь и забота способны творить чудеса!
Таким образом, СЗРП 1 степени при беременности — это не конец света, а лишь небольшое препятствие на пути к рождению здорового малыша. С правильным подходом, вниманием к своему здоровью и регулярным наблюдением у врача вы сможете преодолеть эту трудность. Помните, что каждая беременность уникальна, и ваша — не исключение. Верьте в себя и своего малыша, и все обязательно будет хорошо!
Диагностика СЗРП: как выявить проблему на ранних сроках беременности
Представьте, что ваша беременность — это увлекательное путешествие, а ваш малыш — драгоценный груз на борту. Как любой опытный капитан, вы хотите быть уверены, что ваш корабль идет верным курсом, а груз в целости и сохранности. Но что делать, если возникает подозрение, что не все идет по плану? Тут-то и приходит на помощь диагностика СЗРП (синдрома задержки роста плода). Давайте разберемся, как же выявить эту коварную проблему на ранних сроках беременности.
Итак, СЗРП 1 степени при беременности — что это такое? Если говорить простым языком, это когда ваш малыш растет чуть медленнее, чем его сверстники в утробе. Представьте себе класс, где все дети вымахали, а один остался коротышкой. Вот примерно так же происходит и в животике у мамы. Но не паникуйте раньше времени! СЗРП 1 степени — это самая легкая форма задержки роста, и при правильном подходе все может наладиться.
Ультразвуковое исследование: заглянуть в гости к малышу
Первый и самый важный метод диагностики СЗРП — это УЗИ. Это как если бы у вас была волшебная подзорная труба, через которую можно заглянуть прямо в животик к малышу. Что же врач может увидеть на УЗИ?
- Размеры плода: Врач измерит окружность головки, живота и длину бедренной кости малыша. Если эти показатели отстают от нормы, это может указывать на СЗРП.
- Количество околоплодных вод: При СЗРП их часто бывает меньше нормы.
- Состояние плаценты: Врач оценит ее размер, структуру и расположение.
УЗИ обычно проводят в каждом триместре беременности. Но если есть подозрение на СЗРП, врач может назначить дополнительные исследования. Не пропускайте эти важные встречи с вашим малышом!
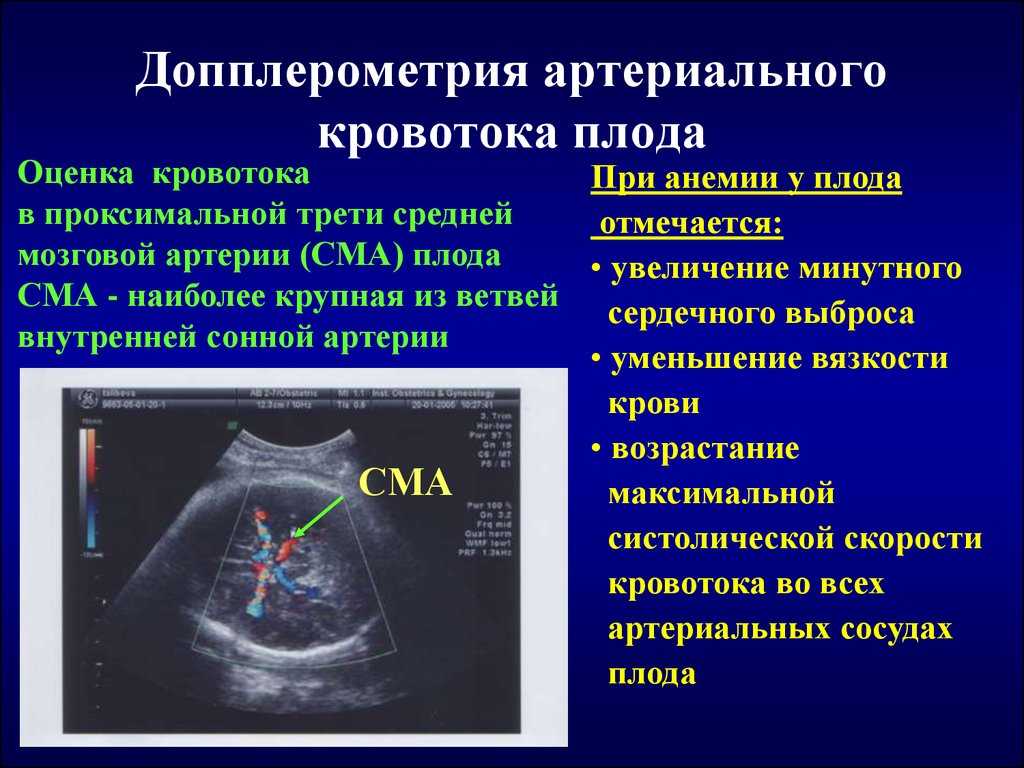
Допплерометрия: послушать, как бьется сердечко
Следующий важный метод диагностики — допплерометрия. Это как если бы у вас был суперчувствительный стетоскоп, которым можно услышать не только сердцебиение малыша, но и то, как кровь течет по его сосудам. Что же можно узнать с помощью допплерометрии?
- Скорость кровотока в пуповине: Если она снижена, это может указывать на проблемы с питанием плода.
- Состояние сосудов плаценты: Врач оценит, насколько хорошо плацента справляется со своей работой.
- Кровоток в мозге плода: При СЗРП он может быть усилен, так как организм малыша старается обеспечить мозг кислородом в первую очередь.
Допплерометрию обычно проводят во втором и третьем триместрах беременности. Это безболезненная и безопасная процедура, так что не стоит ее бояться.
Измерение высоты дна матки: простой, но эффективный метод
А теперь давайте поговорим о самом простом, но от этого не менее важном методе диагностики СЗРП — измерении высоты дна матки (ВДМ). Это как если бы вы измеряли, насколько вырос ваш любимый цветок в горшке. Что нужно знать о ВДМ?
- Измерение проводится на каждом приеме у гинеколога, начиная с 20 недели беременности.
- ВДМ должна примерно соответствовать сроку беременности в сантиметрах (например, на 28 неделе ВДМ должна быть около 28 см).
- Если ВДМ отстает от нормы на 2-4 см, это может быть признаком СЗРП.
Конечно, ВДМ — не самый точный метод, на нее могут влиять многие факторы (например, телосложение мамы или многоводие). Но в сочетании с другими методами она дает важную информацию о росте малыша.
Биохимические маркеры: что расскажет кровь мамы
Теперь давайте заглянем в лабораторию и посмотрим, что может рассказать нам кровь мамы о здоровье малыша. Биохимические маркеры — это как шпионы, которые проникают в кровь мамы и приносят информацию о состоянии плода. Какие же маркеры могут указывать на СЗРП?
- Плацентарный фактор роста (PlGF): Его снижение может указывать на проблемы с плацентой.
- Ассоциированный с беременностью протеин плазмы А (PAPP-A): Низкий уровень этого белка связан с повышенным риском СЗРП.
- Альфа-фетопротеин (АФП): Его повышение может быть признаком нарушения развития плода.
Эти анализы обычно сдают в первом и втором триместрах беременности. Они помогают врачу оценить риск развития СЗРП и других осложнений.
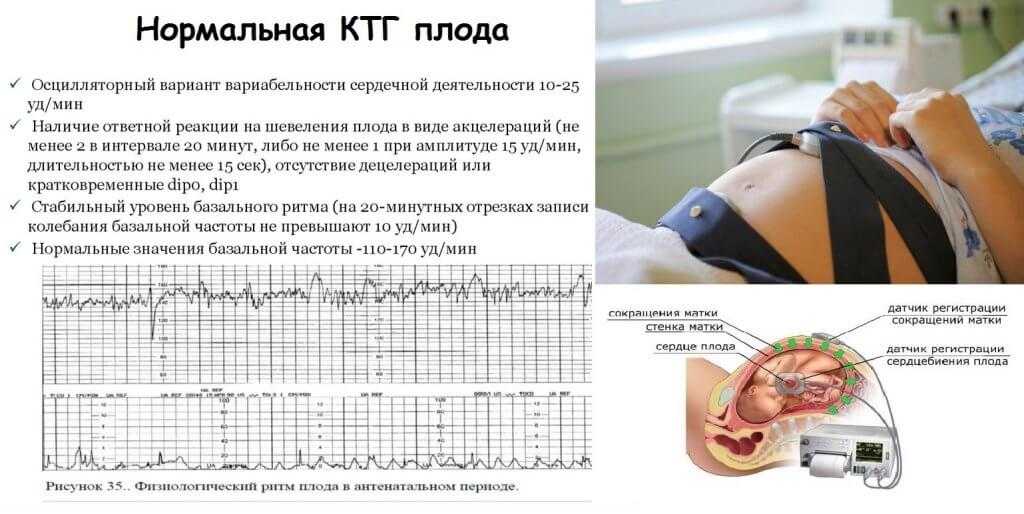
Кардиотокография: прислушаемся к ритму жизни
Еще один важный метод диагностики — кардиотокография (КТГ). Это как если бы вы слушали самую важную мелодию в мире — ритм сердца вашего малыша. Что можно узнать с помощью КТГ?
- Частоту сердечных сокращений плода: При СЗРП она может быть снижена или, наоборот, повышена.
- Вариабельность сердечного ритма: Ее снижение может указывать на кислородное голодание плода.
- Реакцию плода на шевеления: При СЗРП малыш может быть менее активным.
КТГ обычно проводят в третьем триместре беременности, особенно если есть подозрение на СЗРП. Это безопасный и информативный метод, который помогает оценить состояние малыша.
Генетические исследования: заглянем в код жизни
Иногда причина СЗРП кроется в генах. В этом случае на помощь приходят генетические исследования. Это как если бы вы пытались прочитать инструкцию по сборке вашего малыша, написанную на очень сложном языке. Какие генетические исследования могут быть полезны?
- Неинвазивный пренатальный тест (НИПТ): Это анализ крови мамы, который может выявить некоторые хромосомные аномалии плода.
- Амниоцентез: Это исследование околоплодных вод, которое дает более полную информацию о генетике плода.
- Биопсия хориона: Это исследование ткани плаценты, которое также может выявить генетические нарушения.
Эти исследования обычно проводят, если есть серьезные подозрения на генетические причины СЗРП. Они более сложные и имеют некоторые риски, поэтому назначаются только по строгим показаниям.

Комплексный подход: собираем пазл
Помните, что диагностика СЗРП 1 степени при беременности — это не одно исследование, а целый комплекс мер. Это как собирать сложный пазл: каждый метод дает свой кусочек информации, и только вместе они складываются в полную картину. Поэтому не пренебрегайте ни одним из назначенных врачом исследований!
Важно помнить, что ранняя диагностика СЗРП — это ключ к успешному лечению. Чем раньше выявлена проблема, тем больше шансов ее исправить. Поэтому не пропускайте визиты к врачу, внимательно следите за своим состоянием и не стесняйтесь задавать вопросы. Ведь здоровье вашего малыша — это самое важное!
И помните, СЗРП 1 степени — это не приговор, а всего лишь небольшое препятствие на пути к рождению здорового малыша. С правильной диагностикой и лечением вы сможете преодолеть эту трудность. Верьте в себя и своего кроху, и все обязательно будет хорошо!
Особенности течения беременности при синдроме задержки роста плода 1 степени
Представьте, что ваша беременность — это увлекательное путешествие на воздушном шаре. Вы парите в небесах, наслаждаясь видами и предвкушая встречу с малышом. Но вдруг замечаете, что шар летит чуть медленнее, чем должен. Это и есть СЗРП 1 степени при беременности. Что это такое? Это состояние, когда ваш кроха растет чуть медленнее, чем его сверстники в утробе. Но не паникуйте! Это не конец света, а лишь небольшое препятствие на пути к счастливому материнству.
СЗРП 1 степени — самая легкая форма задержки роста плода. Это как если бы ваш малыш немного отстал в школьной эстафете, но все еще имеет все шансы догнать лидеров. При этом состоянии вес плода отстает от нормы на 10-20%. Звучит пугающе? Но на деле это может быть разница всего в 200-300 граммов. Не так уж и много, правда?
Симптомы: когда бить тревогу?
Как же понять, что у вас СЗРП 1 степени? К сожалению, явных симптомов, которые могла бы заметить будущая мама, практически нет. Это не простуда, когда нос заложен и горло болит. СЗРП 1 степени — это коварный гость, который приходит незаметно. Но есть несколько моментов, на которые стоит обратить внимание:

- Малоподвижность плода: Если ваш «футболист» вдруг стал меньше пинаться, это повод для беспокойства.
- Медленный рост живота: Если подруги удивляются, какой у вас маленький животик для вашего срока, возможно, это не просто «компактная» беременность.
- Отеки: Хотя отеки могут быть и при нормальной беременности, при СЗРП они часто более выражены.
Но помните, только врач может поставить диагноз СЗРП 1 степени. Поэтому регулярные визиты к гинекологу — это не прихоть, а необходимость!
Как протекает беременность при СЗРП 1 степени?
Итак, диагноз поставлен. Что теперь? Как будет протекать ваша беременность? Спешу вас успокоить: в большинстве случаев беременность при СЗРП 1 степени протекает без серьезных осложнений. Это не та ситуация, когда вас тут же укладывают на сохранение и запрещают даже чихать. Но некоторые особенности все же есть:
- Более частые визиты к врачу: Вам, вероятно, придется чаще посещать гинеколога для мониторинга состояния плода.
- Дополнительные УЗИ: Врачу нужно будет чаще «заглядывать» к вашему малышу, чтобы следить за его ростом.
- Особый режим: Возможно, вам порекомендуют больше отдыхать и избегать стрессов (как будто это так просто!).
- Диета: Вам могут назначить специальную диету, богатую белком и витаминами.
Но не думайте, что вас запрут в четырех стенах! При СЗРП 1 степени беременность обычно протекает довольно спокойно, просто под более пристальным наблюдением врачей.
Риски и осложнения: стоит ли волноваться?
Теперь давайте поговорим о том, что волнует всех будущих мам: о рисках. СЗРП 1 степени — это не приговор, но и не повод расслабляться. Какие осложнения могут возникнуть?
- Преждевременные роды: Малыш может решить, что ему пора на выход раньше срока.
- Гипоксия плода: Из-за проблем с плацентой малышу может не хватать кислорода.
- Низкий вес при рождении: Ваш кроха может родиться чуть меньше, чем ожидалось.
- Адаптационные проблемы после рождения: Малышу может потребоваться больше времени, чтобы привыкнуть к жизни вне утробы.
Но не пугайтесь! При правильном ведении беременности эти риски можно свести к минимуму. Помните, СЗРП 1 степени — это не болезнь, а состояние, которое требует повышенного внимания.

Лечение: как помочь малышу расти?
А теперь самое интересное: как же помочь нашему маленькому «тормозу» набрать скорость? К сожалению, волшебной таблетки, которая мгновенно решит все проблемы, не существует. Но есть целый комплекс мер, которые помогут вашему малышу расти и развиваться:
- Медикаментозная терапия: Врач может назначить препараты для улучшения кровотока в плаценте.
- Витаминотерапия: Особенно важны фолиевая кислота, железо и витамин D.
- Диета: Богатая белком пища поможет малышу получить все необходимые «стройматериалы».
- Режим дня: Больше отдыха, меньше стресса — вот девиз беременной с СЗРП.
- Физическая активность: Легкие упражнения помогут улучшить кровообращение.
Помните, каждый случай уникален, и только ваш врач может составить оптимальный план лечения именно для вас и вашего малыша.
Прогноз: что ждет малыша после рождения?
Вот мы и подошли к самому волнующему вопросу: что будет после рождения? Спешу вас обрадовать: прогноз при СЗРП 1 степени обычно благоприятный. Большинство деток быстро догоняют своих сверстников в росте и весе. Это как с теми ребятами, которые поздно пошли в школу, но потом стали отличниками!
Конечно, вашему малышу может потребоваться чуть больше внимания и заботы в первые месяцы жизни. Возможно, придется чаще посещать педиатра и более тщательно следить за питанием. Но с вашей любовью и заботой ваш кроха быстро нагонит и перегонит всех!
Истории из жизни: СЗРП — не приговор!
Чтобы вы не думали, что все это сухая теория, давайте послушаем реальную историю. Моя подруга Анна столкнулась с диагнозом СЗРП 1 степени на 28 неделе беременности. Сначала она, конечно, испугалась. Но врач успокоил ее и назначил лечение. Анна строго соблюдала диету, больше отдыхала и регулярно посещала врача. В результате на 39 неделе она родила прекрасного малыша весом 3100 г. Сейчас ее сыну 5 лет, и он ничем не отличается от сверстников. Более того, он самый высокий в своей группе в детском саду!
Так что СЗРП 1 степени при беременности — это не конец света, а всего лишь небольшое препятствие на пути к счастливому материнству. С правильным подходом, вниманием к своему здоровью и регулярным наблюдением у врача вы сможете преодолеть эту трудность. Помните, что каждая беременность уникальна, и ваша — не исключение. Верьте в себя и своего малыша, и все обязательно будет хорошо!
Методы лечения и коррекции СЗРП: медикаментозная терапия и немедикаментозные подходы
Итак, вы узнали о диагнозе СЗРП 1 степени при беременности. Что это такое? Это когда ваш малыш растет чуть медленнее, чем его утробные «одноклассники». Но не паникуйте! Это не приговор, а всего лишь сигнал к действию. Давайте разберемся, как помочь вашему крохе набрать нужные обороты и догнать сверстников в росте и весе.
Медикаментозная терапия: волшебные пилюли или научный подход?
Начнем с самого, казалось бы, очевидного — лекарств. Но тут не все так просто, как может показаться на первый взгляд. Нет такой волшебной таблетки, которая мгновенно решит все проблемы. Медикаментозная терапия при СЗРП 1 степени — это целый комплекс мер, направленных на улучшение состояния мамы и малыша.
- Антикоагулянты: Эти препараты улучшают кровоток в плаценте, помогая малышу получать больше питательных веществ. Но не спешите бежать в аптеку — их назначает только врач!
- Антиоксиданты: Они защищают клетки от повреждений и помогают организму лучше усваивать кислород. Витамин Е и С — ваши лучшие друзья в этой ситуации.
- Метаболические препараты: Они улучшают обмен веществ и помогают малышу эффективнее использовать полученные питательные вещества.
- Витаминно-минеральные комплексы: Особенно важны фолиевая кислота, железо и витамин D. Они помогают малышу расти и развиваться правильно.
Помните, что все эти препараты должен назначать только врач. Самолечение при беременности — это как игра в русскую рулетку, только на кону здоровье вашего малыша.
Немедикаментозные подходы: природа нам в помощь
А теперь давайте поговорим о том, что вы можете сделать сами, без таблеток и уколов. Немедикаментозные методы лечения СЗРП 1 степени не менее важны, чем лекарства. И, что приятно, они полностью в ваших руках!
- Диета: Правильное питание — это основа основ. Ваш рацион должен быть богат белком, железом и фолиевой кислотой. Представьте, что вы кормите не только себя, но и маленького строителя внутри вас, которому нужны качественные материалы для работы.
- Режим дня: Больше отдыхайте! Сон — это не роскошь, а необходимость. Попробуйте спать не менее 8 часов ночью и 1-2 часа днем. Ваш организм скажет вам спасибо, а малыш получит больше энергии для роста.
- Умеренная физическая активность: Нет, мы не предлагаем вам бежать марафон. Легкая гимнастика для беременных или плавание помогут улучшить кровообращение и обеспечат малыша большим количеством кислорода.
- Свежий воздух: Чаще гуляйте на свежем воздухе. Это не только приятно, но и полезно для вас и малыша. Кислород — лучший друг растущего организма!
- Позитивный настрой: Не забывайте о психологическом комфорте. Стресс — худший враг беременности. Слушайте приятную музыку, читайте хорошие книги, общайтесь с позитивными людьми.
Эти простые методы могут творить чудеса. Многие мамы отмечают, что после коррекции образа жизни их малыши начинали расти гораздо активнее.
Альтернативные методы: йога, акупунктура и другие экзотические подходы
А как насчет чего-нибудь необычного? В последнее время все больше будущих мам обращаются к альтернативным методам лечения СЗРП 1 степени. Давайте рассмотрим некоторые из них:
- Йога для беременных: Помогает улучшить кровообращение и снять стресс. Но помните, что не все асаны подходят для беременных!
- Акупунктура: Некоторые исследования показывают, что она может улучшить кровоток в плаценте. Но обязательно консультируйтесь с врачом перед тем, как лечь под иголки!
- Гипнотерапия: Может помочь снизить уровень стресса и улучшить эмоциональное состояние мамы.
- Ароматерапия: Некоторые эфирные масла могут улучшить самочувствие и снять тревожность. Но будьте осторожны — не все масла безопасны при беременности!
Помните, что эти методы должны быть дополнением, а не заменой традиционного лечения. Всегда консультируйтесь с врачом перед тем, как пробовать что-то новое.
Мониторинг эффективности лечения: как понять, что все идет по плану?
Вы начали лечение, но как понять, что оно работает? Как убедиться, что ваш малыш действительно догоняет сверстников в росте? Вот несколько ключевых моментов, на которые стоит обратить внимание:
- УЗИ: Регулярные ультразвуковые исследования покажут, как растет малыш. Врач измерит окружность животика, головки и длину бедренной кости.
- Допплерометрия: Этот метод позволяет оценить кровоток в сосудах плаценты и пуповины. Улучшение показателей — хороший знак!
- КТГ (кардиотокография): Позволяет оценить сердцебиение плода и его реакцию на шевеления. Нормализация этих показателей говорит об улучшении состояния малыша.
- Измерение высоты дна матки: Этот простой метод тоже может показать, как растет малыш.
- Ваше самочувствие: Да-да, оно тоже важно! Если вы чувствуете себя лучше, более энергичны — это хороший знак.
Помните, что лечение СЗРП 1 степени — это марафон, а не спринт. Не ждите мгновенных результатов, будьте терпеливы и верьте в лучшее!
Возможные осложнения и как их избежать
Конечно, любое лечение может иметь побочные эффекты. Что нужно знать о возможных осложнениях при лечении СЗРП 1 степени?

- Аллергические реакции на лекарства: Всегда сообщайте врачу о любых аллергиях, которые у вас были раньше.
- Проблемы с желудком при приеме некоторых препаратов: Если появилась тошнота или изжога, сообщите об этом врачу.
- Головокружение или слабость: Это может быть связано с изменением режима дня или диеты. Не игнорируйте эти симптомы!
- Отеки: Следите за своим весом и объемом живота. Резкое увеличение может говорить о проблемах с почками или сердцем.
Помните, что любые необычные симптомы — повод обратиться к врачу. Лучше перестраховаться, чем упустить что-то важное!
Психологическая поддержка: важность позитивного настроя
Знаете, что часто забывают при лечении СЗРП 1 степени? Психологическое состояние мамы! А ведь это не менее важно, чем все таблетки и процедуры вместе взятые. Как же поддержать себя в этот непростой период?
- Общение с другими мамами: Найдите группу поддержки, где вы сможете поделиться своими переживаниями и получить совет от тех, кто прошел через это.
- Медитация: Простые техники релаксации могут творить чудеса с вашим настроением и уровнем стресса.
- Хобби: Найдите занятие, которое приносит вам радость. Вышивание, рисование, пение — все, что поднимает настроение!
- Разговор с малышом: Да-да, разговаривайте с вашим крохой. Рассказывайте ему, как вы его ждете и любите. Это поможет вам установить эмоциональную связь и снизить тревожность.
Помните, ваше эмоциональное состояние напрямую влияет на малыша. Счастливая мама — счастливый малыш!
Итак, мы разобрались, что такое СЗРП 1 степени при беременности и как с этим бороться. Помните, что это состояние поддается коррекции, особенно если вовремя начать лечение. Сочетание медикаментозной терапии, правильного образа жизни и позитивного настроя творит чудеса. Верьте в себя и своего малыша, и все обязательно будет хорошо!
Прогноз и возможные осложнения для ребенка при СЗРП 1 степени
Синдром задержки развития плода (СЗРП) 1 степени — это не просто медицинский термин, а реальная ситуация, с которой сталкиваются многие будущие мамы. Что же это за зверь такой? СЗРП 1 степени — это когда малыш в животике растет чуть медленнее, чем его сверстники. Представьте, что все детки — это бегуны на марафоне, и вдруг один решил перейти на быстрый шаг. Он все еще движется вперед, но чуть-чуть отстает от основной группы.

Почему это происходит? Причин может быть масса: от генетических особенностей до проблем с плацентой. Иногда виноваты вредные привычки мамы (эй, курильщицы, это намек!), а иногда природа просто решила немного притормозить. Ключевое слово здесь — «немного». При СЗРП 1 степени отставание в росте составляет всего 2-3 недели. Это как если бы ваш малыш решил устроить себе небольшие каникулы в росте.
Но давайте не будем паниковать раньше времени. СЗРП 1 степени — это не приговор, а скорее повод уделить больше внимания своему здоровью и здоровью малыша. Врачи в таких случаях становятся настоящими детективами, пытаясь выяснить причину замедления роста. Они проводят целый ряд исследований: от простого УЗИ до сложных анализов крови и даже генетических тестов.
Как же понять, что у вашего крохи именно СЗРП 1 степени? Обычно это выявляется на плановом УЗИ. Врач измеряет размеры плода и сравнивает их с нормами для данного срока беременности. Если малыш отстает, но не критично — это и есть первая степень СЗРП. Звучит страшно? На самом деле, это самая легкая форма задержки развития.
Теперь о прогнозах. В большинстве случаев при правильном ведении беременности малыши с СЗРП 1 степени догоняют своих сверстников еще до рождения или в первые месяцы жизни. Это как в школе — кто-то схватывает материал сразу, а кому-то нужно чуть больше времени, но в итоге все приходят к финишу.
Однако, нельзя закрывать глаза на возможные осложнения. У деток с СЗРП 1 степени может быть немного снижен иммунитет, они могут быть более подвержены респираторным заболеваниям в первые месяцы жизни. Некоторые исследования показывают, что у таких малышей чуть выше риск развития метаболического синдрома во взрослом возрасте. Но не спешите паниковать! Эти риски минимальны и вполне поддаются коррекции.
Что же делать будущей маме? Во-первых, строго следовать рекомендациям врача. Возможно, вам назначат дополнительные витамины или препараты для улучшения кровотока в плаценте. Во-вторых, пересмотреть свой образ жизни. Может, пора отказаться от вредных привычек или добавить в рацион больше белка и железа? В-третьих, больше отдыхать. Стресс — злейший враг беременности, а при СЗРП особенно.
Интересный факт: некоторые исследования показывают, что дети с СЗРП 1 степени часто вырастают более целеустремленными и успешными. Возможно, эта небольшая задержка в росте заставляет их с самого начала бороться и не сдаваться. Кто знает, может ваш малыш станет новым Стивом Джобсом или Илоном Маском?
Важно помнить, что СЗРП 1 степени — это не болезнь, а состояние. Это как если бы ваш малыш решил взять паузу, чтобы лучше подготовиться к выходу в большой мир. И ваша задача — создать для него максимально комфортные условия для этой подготовки.
Кстати, о комфорте. Многие будущие мамы в панике начинают искать в интернете чудо-средства от СЗРП. Народные методы, заговоры, чудо-диеты — чего только не встретишь! Но давайте будем честны: единственное, что действительно поможет — это внимательное отношение к своему здоровью и регулярное наблюдение у врача.
А что после рождения? Большинство малышей с СЗРП 1 степени при рождении весят чуть меньше нормы, но быстро набирают вес. Педиатры рекомендуют таким деткам естественное вскармливание — материнское молоко просто незаменимо для укрепления иммунитета и правильного развития. Если же с грудным вскармливанием не сложилось, не отчаивайтесь — современные смеси способны обеспечить малыша всем необходимым.
Интересно, что некоторые исследования показывают: дети с СЗРП 1 степени часто оказываются более развитыми интеллектуально. Может, пока тело отдыхало, мозг работал на полную катушку? В любом случае, не стоит воспринимать СЗРП как приговор — это скорее вызов, который вы и ваш малыш обязательно преодолеете вместе.
В заключение хочется сказать: СЗРП 1 степени — это не конец света, а лишь небольшое препятствие на пути к счастливому материнству. С правильным подходом, вниманием к своему здоровью и позитивным настроем вы обязательно преодолеете эту трудность. И помните: каждый ребенок уникален, и ваш малыш — не исключение. Возможно, эта небольшая задержка в росте — просто его способ сказать: «Мама, я особенный!»
Профилактика синдрома задержки роста плода: рекомендации для беременных женщин
Беременность — это удивительное путешествие, но иногда на пути встречаются неожиданные повороты. Один из них — синдром задержки роста плода (СЗРП) 1 степени. Что это за зверь такой? Представьте, что ваш малыш — это маленький садовник, который старательно выращивает себя в вашем животике. СЗРП 1 степени — это когда у нашего садовника слегка замедлился рост, как будто он решил устроить себе небольшой перерыв.
Но не спешите паниковать! СЗРП 1 степени — это не приговор, а скорее сигнал, что вашему маленькому садовнику нужно чуть больше заботы и внимания. Как же помочь крохе набрать нужные обороты? Давайте разберемся!
Первым делом, нужно понять, что СЗРП 1 степени при беременности — это отставание в росте плода на 2-3 недели от нормы. Это как если бы ваш малыш решил немного притормозить в своем марафоне развития. Причин для такого «перерыва» может быть много: от генетических особенностей до проблем с плацентой. Иногда виноваты внешние факторы, вроде стресса или неправильного питания мамы.
Итак, как же предотвратить СЗРП 1 степени? Начнем с самого очевидного — питания. Ваш рацион должен быть разнообразным и богатым всеми необходимыми веществами. Представьте, что вы — шеф-повар в ресторане высокой кухни, а ваш малыш — самый важный гость. Что бы вы ему предложили? Конечно же, только самое лучшее!
Белок — это строительный материал для вашего крохи. Включите в свой рацион нежирное мясо, рыбу, яйца, молочные продукты. А как насчет растительного белка? Бобовые, орехи, семена — все это прекрасные источники. Не забывайте о фруктах и овощах — это настоящая кладовая витаминов и минералов. Особенно важны продукты, богатые фолиевой кислотой и железом. Представьте, что это кирпичики и цемент для строительства здоровья вашего малыша.
Но одного питания мало. Физическая активность — вот второй кит, на котором держится профилактика СЗРП. Нет, я не призываю вас бежать марафон или заниматься тяжелой атлетикой. Легкая гимнастика, плавание, йога для беременных — вот ваши лучшие друзья. Движение улучшает кровообращение, а значит, ваш малыш получает больше кислорода и питательных веществ. Это как если бы вы открыли все окна в доме, чтобы впустить свежий воздух!
Теперь о том, чего следует избегать. Вредные привычки — это табу для будущей мамы. Алкоголь, курение, наркотики — все это может серьезно навредить вашему крохе. Представьте, что вы сажаете нежный росток. Станете ли вы поливать его кислотой вместо воды? Конечно, нет! Так же и с вредными привычками — они как яд для вашего малыша.

Стресс — еще один враг здоровой беременности. В современном мире сложно полностью избежать стрессовых ситуаций, но можно научиться с ними справляться. Медитация, дыхательные упражнения, приятная музыка — все это поможет вам расслабиться. Помните, ваше спокойствие — это спокойствие вашего малыша.
Регулярные визиты к врачу — это не просто галочка в списке дел беременной женщины. Это возможность вовремя заметить любые отклонения и принять меры. УЗИ, анализы крови, измерение давления — все это помогает следить за здоровьем мамы и малыша. Не пропускайте приемы у врача, даже если чувствуете себя прекрасно. Лучше перестраховаться, чем потом кусать локти.
Интересный факт: исследования показывают, что женщины, которые во время беременности регулярно разговаривают со своим малышом, реже сталкиваются с проблемами развития плода. Так что не стесняйтесь общаться с крохой, рассказывайте ему сказки, пойте песенки. Кто знает, может быть, именно ваш голос станет для него лучшим стимулом к росту и развитию?
А как насчет витаминов и добавок? Да, они важны, но принимать их нужно только по назначению врача. Самолечение во время беременности — это как игра в русскую рулетку. Никогда не знаешь, что выстрелит. Фолиевая кислота, железо, кальций — все это может быть полезно, но дозировку должен определять специалист.
Еще один важный момент — сон. Полноценный отдых необходим как маме, так и малышу. Старайтесь спать не менее 8 часов в сутки. Если мучает бессонница, попробуйте теплое молоко с медом перед сном или легкий массаж. Только не увлекайтесь травяными чаями — не все они безопасны во время беременности.
Кстати, о безопасности. Будьте осторожны с лекарствами. Даже обычный аспирин может навредить малышу. Любые препараты принимайте только по назначению врача. Это как с едой — вы же не станете кормить новорожденного стейком, верно? Так и с лекарствами — то, что безопасно для взрослого, может быть опасно для малыша.
Не забывайте о личной гигиене. Регулярно мойте руки, избегайте контакта с больными людьми. Ваш иммунитет сейчас работает на двоих, не стоит его перегружать. Это как защитный купол вокруг вас и малыша — чем он крепче, тем лучше.

И последнее, но не менее важное — позитивный настрой. Да-да, не удивляйтесь! Исследования показывают, что позитивное мышление мамы благотворно влияет на развитие плода. Так что улыбайтесь чаще, общайтесь с приятными людьми, занимайтесь тем, что приносит вам радость. Ваше хорошее настроение — это лучший подарок для малыша.
Помните, СЗРП 1 степени — это не приговор, а повод уделить больше внимания себе и своему малышу. С правильным подходом, заботой и любовью вы обязательно преодолеете эту небольшую преграду на пути к счастливому материнству. Ваш малыш — уникальное создание, и эта небольшая задержка в росте — возможно, просто его способ сказать: «Мама, я особенный!» Так что не паникуйте, а наслаждайтесь каждым моментом своей беременности. Ведь это удивительное путешествие, и вы — главный капитан на этом корабле!
