Содержание
Уникальный состав Нестожен 1: Почему эта смесь считается оптимальной для малышей
Выбор правильной смеси для новорожденного — это настоящий квест для молодых родителей. Столько вариантов, столько брендов, а ведь речь идет о самом драгоценном — здоровье малыша! Давайте-ка разберемся, почему же Нестожен 1 так часто оказывается в топе рекомендаций педиатров. Что такого особенного в составе этой смеси? И как не запутаться в море информации, выбирая оптимальный вариант для своего крохи?
Прежде всего, стоит отметить, что Нестожен 1 — это не просто набор ингредиентов, а тщательно продуманная формула, максимально приближенная к составу грудного молока. Но что это значит на практике? Давайте копнем глубже и разберем состав Нестожен 1 по полочкам.
Белковый профиль: ключ к комфортному пищеварению
Одна из главных «фишек» Нестожен 1 — это особый белковый профиль. Смесь содержит оптимальное соотношение сывороточных белков и казеина (60:40), что делает ее легкоусвояемой для нежного желудочка малыша. Но почему это так важно? Дело в том, что сывороточные белки переваривается быстрее, чем казеин, что снижает риск возникновения колик и запоров — настоящего кошмара для молодых родителей.
Кроме того, белки в Нестожен 1 подвергаются частичному гидролизу. Это не какая-то магия, а научно обоснованный подход: расщепление белков на более мелкие фрагменты облегчает их усвоение и снижает риск аллергических реакций. Хитро, не правда ли?
Жировой компонент: не просто калории
Когда речь заходит о жирах в детском питании, многие родители напрягаются. Но не спешите паниковать! Жиры в Нестожен 1 — это не про лишний вес, а про здоровое развитие. Смесь содержит сбалансированный комплекс растительных масел, включая подсолнечное, рапсовое и кокосовое. Но настоящая «звезда» жирового состава — это добавление молочного жира.
Зачем он нужен? Молочный жир содержит короткоцепочечные жирные кислоты, которые легко усваиваются и служат быстрым источником энергии для растущего организма. Кроме того, он способствует формированию здоровой микрофлоры кишечника. Это как заложить прочный фундамент для будущего здоровья малыша.
Углеводный состав: не просто сладкая история
Углеводы в Нестожен 1 — это не просто про сладкий вкус. Основной углевод здесь — лактоза, тот самый сахар, который преобладает в грудном молоке. Но есть в составе и настоящая «изюминка» — пребиотики ГОС и ФОС. Что это за зверь такой?
ГОС (галактоолигосахариды) и ФОС (фруктоолигосахариды) — это особые вещества, которые служат питательной средой для полезных бактерий в кишечнике малыша. Они способствуют формированию здорового микробиома, укрепляют иммунитет и даже могут снижать риск развития аллергии. Впечатляет, не так ли?
Витамины и минералы: полный комплект
Нестожен 1 содержит полный спектр необходимых витаминов и минералов, но давайте остановимся на некоторых особенно важных моментах. Например, в составе есть железо в легкоусвояемой форме — это ключевой элемент для профилактики анемии, которая, увы, нередко встречается у малышей на искусственном вскармливании.
Особого внимания заслуживает и наличие в составе нуклеотидов. Эти вещества играют важную роль в формировании иммунитета и развитии мозга. Добавление нуклеотидов в смесь — это попытка максимально приблизить ее состав к грудному молоку, которое естественным образом содержит эти важные компоненты.
Таблица состава: удобный способ разобраться
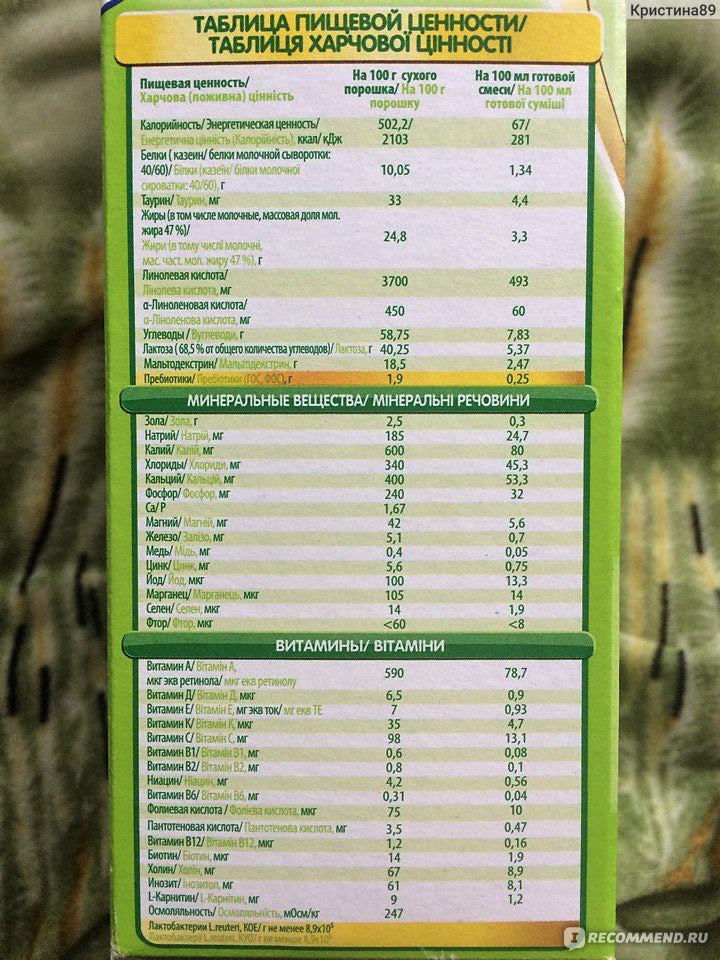
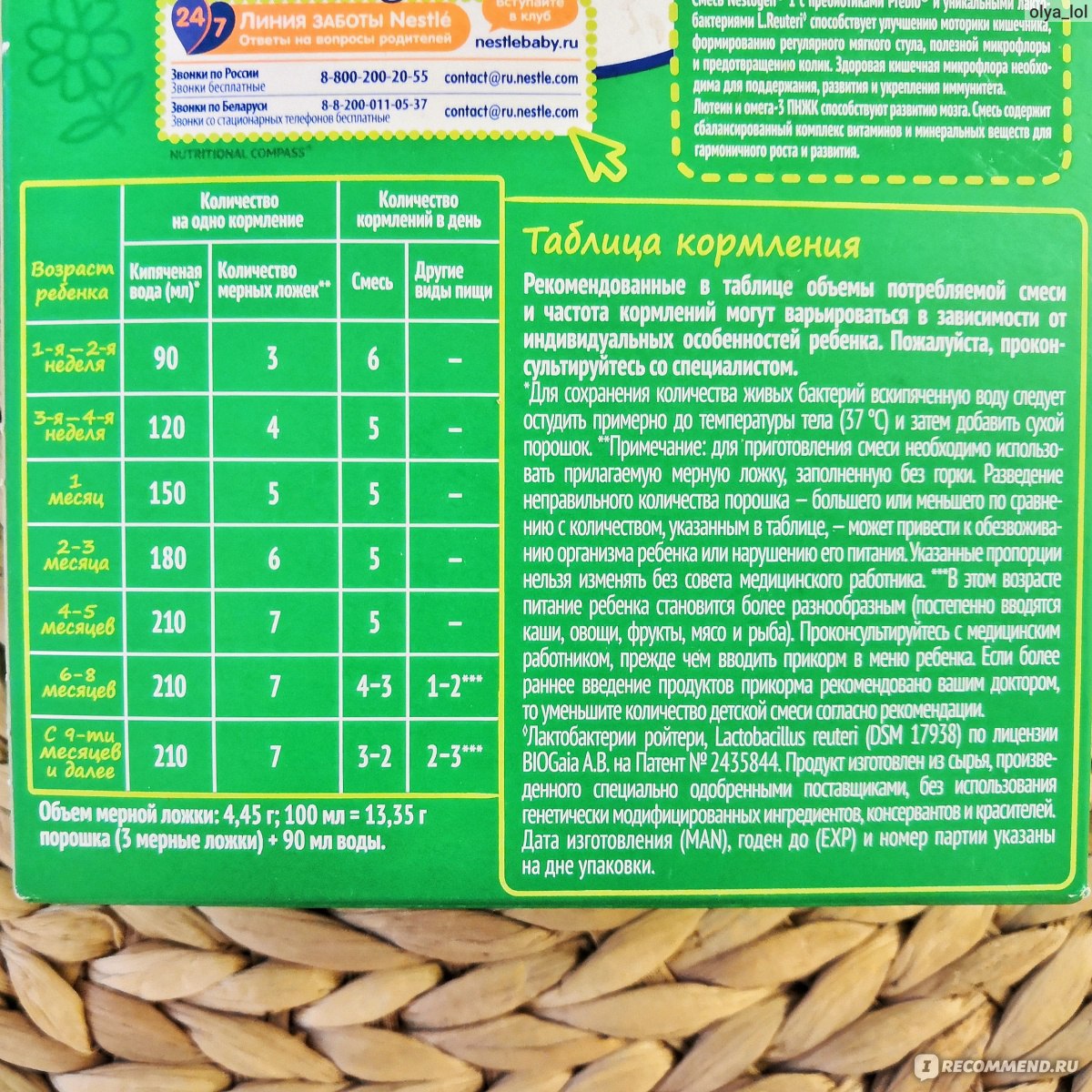
Для тех, кто любит конкретику, предлагаю взглянуть на краткую таблицу состава Нестожен 1:
- Белки: 1,3 г/100 мл (60% сывороточных, 40% казеина)
- Жиры: 3,4 г/100 мл (включая молочный жир)
- Углеводы: 7,4 г/100 мл (основной компонент — лактоза)
- Пребиотики ГОС/ФОС: 0,4 г/100 мл
- Железо: 0,53 мг/100 мл
- Кальций: 41 мг/100 мл
- Витамин D: 1,2 мкг/100 мл
Это, конечно, не полный перечень, но уже дает представление о сбалансированности состава. Впечатляет, правда?
Как выбрать: практические советы
Теперь, когда мы разобрались с составом, давайте поговорим о том, как же все-таки выбрать смесь для своего малыша. Во-первых, не стесняйтесь консультироваться с педиатром. Каждый ребенок уникален, и то, что идеально подходит одному, может не подойти другому.

Во-вторых, обращайте внимание на реакцию малыша. Как он себя чувствует после кормления? Нет ли проблем с пищеварением или сыпи? Помните, что адаптация к новой смеси может занять несколько дней, так что не паникуйте раньше времени.
И наконец, доверяйте своей интуиции. Вы лучше всех знаете своего ребенка. Если чувствуете, что что-то не так, не бойтесь экспериментировать (конечно, под наблюдением врача).
Мифы и реальность: разбираемся с предрассудками
Вокруг искусственного вскармливания ходит немало мифов. Например, многие считают, что все смеси одинаковы. Это не так! Каждая марка имеет свои особенности, и Нестожен 1 — яркий тому пример. Другое распространенное заблуждение — что смеси «химические» и «неестественные». На самом деле, современные смеси — это результат многолетних исследований и разработок, направленных на максимальное приближение к составу грудного молока.
Еще один миф — что смесь обязательно вызовет аллергию. Да, риск есть, но он существует и при грудном вскармливании. Современные смеси, такие как Нестожен 1, разработаны с учетом этих рисков и содержат компоненты, снижающие вероятность аллергических реакций.
Личный опыт: история одной мамы
Позвольте поделиться историей Марины, мамы двойняшек. «Когда родились мои мальчики, я была в панике. Грудного молока не хватало, и пришлось срочно искать смесь. Перепробовали несколько вариантов, пока не остановились на Нестожен 1. И знаете что? Это было как глоток свежего воздуха! Колики прекратились, малыши стали спокойнее, а я наконец-то смогла высыпаться. Теперь всем своим подругам рекомендую».
Конечно, это лишь один пример, и у каждого своя история. Но он показывает, насколько важно найти «свою» смесь.
В заключение: выбор за вами
Выбор смеси для новорожденного — это не просто покупка продукта питания. Это выбор основы для здоровья и развития вашего малыша. Нестожен 1 со своим уникальным составом — отличный вариант для многих детей. Но помните, что каждый ребенок индивидуален, и то, что идеально подходит одному, может не подойти другому.

Не бойтесь экспериментировать (под наблюдением врача, конечно), прислушивайтесь к своему малышу и доверяйте своей интуиции. И помните: какую бы смесь вы ни выбрали, самое главное — это ваша любовь и забота. Ведь именно они делают каждого ребенка по-настоящему счастливым и здоровым.
Сравнительный анализ: Нестожен 1 и грудное молоко — что общего в составе
Выбор детской смеси — это настоящий квест для родителей. Среди множества вариантов Нестожен 1 часто выделяется как смесь, максимально приближенная к грудному молоку. Но насколько это соответствует действительности? Давайте проведем детальный разбор и сравним состав Нестожен 1 с «золотым стандартом» — грудным молоком.
Белковый профиль: тонкая настройка
Белок — это основа роста и развития малыша. В грудном молоке соотношение сывороточных белков к казеину составляет примерно 60:40. И что мы видим в Нестожен 1? Бинго! То же самое соотношение. Это не случайное совпадение, а результат кропотливой работы ученых. Такой баланс обеспечивает легкое усвоение и снижает риск аллергии. Но есть нюанс — белки в смеси подвергаются частичному гидролизу. Это как предварительная «нарезка» белка на более мелкие кусочки, чтобы облегчить работу незрелой пищеварительной системы малыша.
Жиры: не просто калории
В грудном молоке жиры — это не только источник энергии, но и строительный материал для мозга и нервной системы. Нестожен 1 старается повторить этот трюк. В составе смеси — сбалансированная смесь растительных масел с добавлением молочного жира. Последний особенно важен: он содержит короткоцепочечные жирные кислоты, которые легко усваиваются и поддерживают здоровую микрофлору кишечника. А вы знали, что в грудном молоке содержание жира меняется в течение кормления? От «переднего» молока к «заднему» его количество увеличивается. Смесь, конечно, не может повторить эту динамику, но старается обеспечить оптимальное количество жира в каждой порции.
Углеводы: сладкая наука
Главный углевод грудного молока — лактоза. И Нестожен 1 следует этому примеру. Но есть в составе смеси и особые «гости» — пребиотики ГОС и ФОС. В грудном молоке тоже есть свои олигосахариды, правда, они гораздо разнообразнее. Но ГОС и ФОС — это попытка воссоздать ту важную функцию, которую выполняют олигосахариды грудного молока: поддержка здоровой микрофлоры кишечника.

Витамины и минералы: тонкая настройка
Грудное молоко — это настоящий коктейль из витаминов и минералов, причем их состав может меняться в зависимости от питания мамы. Нестожен 1 старается обеспечить стабильный набор всех необходимых нутриентов. Особое внимание уделяется железу — его в смеси больше, чем в грудном молоке. Почему? Дело в том, что железо из грудного молока усваивается лучше, поэтому в смеси его количество увеличивают, чтобы компенсировать более низкую биодоступность.
Иммунные факторы: попытка имитации
Вот здесь начинаются серьезные различия. Грудное молоко содержит живые клетки иммунной системы, антитела и другие биоактивные вещества, которые невозможно воспроизвести в смеси. Однако Нестожен 1 пытается частично компенсировать это добавлением нуклеотидов. Эти вещества играют важную роль в формировании иммунитета и развитии мозга. Это, конечно, не то же самое, что живые иммунные факторы грудного молока, но шаг в правильном направлении.
Вода: основа основ
Казалось бы, что тут сравнивать? Но и здесь есть нюансы. Грудное молоко на 87% состоит из воды, и эта вода идеально подходит для малыша. При приготовлении смеси Нестожен 1 рекомендуется использовать чистую питьевую воду. Это важный момент: качество воды напрямую влияет на качество готовой смеси.
Таблица сравнения: наглядность прежде всего
Для наглядности предлагаю взглянуть на сравнительную таблицу состава грудного молока и Нестожен 1 (на 100 мл):
- Белки: Грудное молоко — 1,0-1,5 г; Нестожен 1 — 1,3 г
- Жиры: Грудное молоко — 3,5-4,5 г; Нестожен 1 — 3,4 г
- Углеводы: Грудное молоко — 6,5-7,5 г; Нестожен 1 — 7,4 г
- Кальций: Грудное молоко — 28-34 мг; Нестожен 1 — 41 мг
- Железо: Грудное молоко — 0,03-0,07 мг; Нестожен 1 — 0,53 мг
Как видите, цифры довольно близкие, но есть и различия. Это наглядно показывает, насколько тщательно разработчики Нестожен 1 подошли к вопросу имитации состава грудного молока.
Индивидуальный подход: ключ к успеху
При всей схожести состава важно помнить: каждый ребенок уникален. То, что идеально подходит одному малышу, может не подойти другому. Поэтому при выборе смеси важно учитывать индивидуальные особенности ребенка, его реакцию на продукт и рекомендации педиатра.

Мифы и реальность: разбираем по косточкам
Вокруг детских смесей ходит немало мифов. Один из них — что все смеси одинаковы. Как мы видим на примере Нестожен 1, это не так. Каждая марка имеет свои особенности и нюансы в составе. Другое заблуждение — что смеси «неестественны». На самом деле, современные смеси — это результат многолетних исследований, направленных на максимальное приближение к составу грудного молока.
Практический опыт: история из жизни
Вспоминается случай из практики одного педиатра. К нему обратилась мама с близнецами, у которых были проблемы с пищеварением. Грудного молока не хватало, и родители перепробовали несколько смесей, пока не остановились на Нестожен 1. «Это было как волшебство, — рассказывала мама. — Колики прекратились, малыши стали спокойнее, а мы наконец-то смогли высыпаться». Конечно, это лишь один пример, и у каждого ребенка своя история, но он показывает, насколько важно найти «свою» смесь.
Научный подход: исследования и разработки
Разработка состава Нестожен 1 — это не просто попытка скопировать грудное молоко. За каждым ингредиентом стоят годы исследований и клинических испытаний. Например, добавление пребиотиков ГОС и ФОС основано на многочисленных исследованиях, показавших их положительное влияние на микрофлору кишечника и иммунитет малыша. А частичный гидролиз белков — это результат изучения особенностей пищеварения новорожденных.
Взгляд в будущее: куда движется наука о детском питании?
Наука не стоит на месте, и состав детских смесей постоянно совершенствуется. Что нас ждет в будущем? Возможно, мы увидим смеси с еще более сложным составом олигосахаридов, приближенным к грудному молоку. Или появятся новые способы обработки белков, делающие их еще более легкоусвояемыми. А может, ученые найдут способ добавлять в смеси живые иммунные факторы? Время покажет, но одно можно сказать точно: стремление максимально приблизить состав искусственных смесей к грудному молоку будет продолжаться.
Таблица питательных веществ: Расшифровка состава Нестожен 1 для заботливых родителей
Выбор детской смеси — это как игра в шахматы. Каждый ход важен, и от вашего решения зависит здоровье и развитие малыша. Нестожен 1 — это как ферзь на шахматной доске детского питания. Но чтобы понять его силу, нужно разобраться в каждой детали. Готовы погрузиться в мир питательных веществ и микроэлементов? Пристегните ремни, мы отправляемся в увлекательное путешествие по составу Нестожен 1!
Белки: фундамент роста
Белки в Нестожен 1 — это не просто строительный материал для растущего организма. Это целая симфония аминокислот, тщательно подобранных для максимального усвоения. В 100 мл смеси содержится 1,3 г белка. Но что это значит на практике? Представьте, что вы строите дом из кирпичей. Белки — это те самые кирпичи, из которых складывается «здание» организма малыша. И Нестожен 1 предлагает именно те «кирпичи», которые нужны для правильного строительства.
А знаете ли вы, что белки в Нестожен 1 подвергаются частичному гидролизу? Это как если бы вам дали не целые кирпичи, а уже немного «подтесанные», чтобы их было легче укладывать. Такой подход снижает нагрузку на незрелую пищеварительную систему малыша и уменьшает риск аллергических реакций.
Жиры: энергия и не только
В Нестожен 1 на каждые 100 мл приходится 3,4 г жиров. Но это не просто цифра в таблице. Жиры в составе смеси — это как высокооктановое топливо для маленького гоночного автомобиля. Они обеспечивают энергию для роста и развития. Но не только! Жирные кислоты, входящие в состав смеси, играют crucial role in the formation of brain and nervous system.
Особого внимания заслуживает наличие в составе молочного жира. Это как секретный ингредиент в рецепте шеф-повара. Молочный жир содержит короткоцепочечные жирные кислоты, которые легко усваиваются и способствуют формированию здоровой микрофлоры кишечника. Это как посадить полезные растения в саду пищеварительной системы вашего малыша.
Углеводы: сладкая энергия
7,4 г углеводов на 100 мл — звучит как сухая статистика, но за этой цифрой скрывается настоящая магия. Основной углевод в Нестожен 1 — лактоза, тот самый сахар, который преобладает в грудном молоке. Это как музыкальная нота, которая звучит в унисон с природой.
Но настоящая «изюминка» углеводного состава — это пребиотики ГОС и ФОС. Представьте, что кишечник вашего малыша — это огород. ГОС и ФОС — это как специальные удобрения, которые помогают вырасти полезным бактериям. Они поддерживают здоровую микрофлору, укрепляют иммунитет и даже могут снижать риск развития аллергии. Разве не чудо природы?
Витамины и минералы: микровселенная пользы
Витамины и минералы в Нестожен 1 — это как звезды на небосклоне здоровья вашего малыша. Каждый элемент играет свою уникальную роль. Взгляните на эту космическую карту питательных веществ:
- Витамин D: 1,2 мкг/100 мл — солнечный витамин для крепких костей
- Кальций: 41 мг/100 мл — строительный материал для скелета
- Железо: 0,53 мг/100 мл — для здоровых красных кровяных телец
- Цинк: 0,5 мг/100 мл — для поддержки иммунитета
- Йод: 12 мкг/100 мл — для правильного развития щитовидной железы
Каждый из этих элементов — как маленький супергерой, который помогает организму малыша расти и развиваться. И Нестожен 1 собрал целую команду таких супергероев!
Нуклеотиды: секретное оружие
А вы знали, что в состав Нестожен 1 входят нуклеотиды? Это как секретный код, который помогает правильному развитию иммунной системы и мозга малыша. Нуклеотиды — это строительные блоки ДНК и РНК, они участвуют в делении клеток и передаче генетической информации. Добавление нуклеотидов в смесь — это попытка максимально приблизить ее состав к грудному молоку, которое естественным образом содержит эти важные компоненты.
Пребиотики: забота о микрофлоре
ГОС и ФОС в составе Нестожен 1 — это не просто модное дополнение. Это результат серьезных научных исследований. Пребиотики работают как садовники в кишечнике малыша, создавая благоприятные условия для роста полезных бактерий. Это способствует формированию здорового микробиома, который, как показывают последние исследования, играет critical role in the development of the immune system and even affects brain function.
Осмолярность: комфорт пищеварения
Осмолярность — это термин, о котором редко говорят, но который имеет огромное значение. В Нестожен 1 осмолярность составляет около 290 мОсм/л, что близко к осмолярности грудного молока. Что это значит? Представьте, что желудок малыша — это деликатный механизм. Правильная осмолярность означает, что смесь не будет создавать дополнительную нагрузку на этот механизм, снижая риск расстройств пищеварения.
Сравнительный анализ: Нестожен 1 vs другие смеси
Конечно, Нестожен 1 — не единственная смесь на рынке. Как же она выглядит в сравнении с конкурентами? Давайте проведем небольшой «матч»:
- Белковый профиль: многие смеси имеют соотношение сывороточных белков к казеину 60:40, как и Нестожен 1. Но не все используют частичный гидролиз белков.
- Жировой состав: добавление молочного жира — это «фишка» Нестожен 1, которую поддерживают не все производители.
- Пребиотики: ГОС и ФОС становятся все более распространенными, но их количество и соотношение могут различаться.
- Нуклеотиды: не все смеси содержат этот компонент, что дает Нестожен 1 определенное преимущество.
Помните, выбор смеси — это не соревнование. Главное — найти то, что подходит именно вашему малышу.
Практические советы: как «читать» состав
Таблица состава смеси может показаться китайской грамотой. Но вот несколько tips, которые помогут вам стать настоящим экспертом:
- Начните с белков: их количество должно быть близко к содержанию в грудном молоке (около 1,1-1,3 г/100 мл).
- Обратите внимание на жиры: ищите смесь с разнообразным составом жирных кислот.
- Проверьте наличие пребиотиков: они помогут формированию здоровой микрофлоры кишечника.
- Не игнорируйте мелкие компоненты: нуклеотиды, таурин, холин — все это важно для развития малыша.
- Сравнивайте осмолярность: чем ближе к грудному молоку, тем лучше для пищеварения малыша.
Помните, что выбор смеси — это не просто чтение этикетки. Это целое искусство, где важно учитывать индивидуальные особенности вашего ребенка и рекомендации педиатра.
Мифы и реальность: развенчиваем заблуждения
Вокруг детских смесей ходит немало мифов. Давайте разберем некоторые из них:
Миф 1: «Все смеси одинаковы». Реальность: Каждая смесь имеет свои особенности состава. Нестожен 1, например, выделяется наличием частично гидролизованных белков и добавлением молочного жира.
Миф 2: «Смеси вызывают аллергию». Реальность: Современные смеси, такие как Нестожен 1, разработаны с учетом риска аллергии. Частичный гидролиз белков и сбалансированный состав снижают этот риск.
Миф 3: «Смеси не содержат полезных веществ грудного молока». Реальность: Хотя смеси не могут полностью повторить состав грудного молока, они содержат многие важные компоненты, такие как нуклеотиды и пребиотики.
Разоблачение этих мифов помогает родителям принимать более осознанные решения при выборе питания для своего малыша.
Адаптация к потребностям малыша: Как компоненты Нестожен 1 влияют на развитие ребенка
Выбор детской смеси — это как подбор ключа к здоровью вашего малыша. И Нестожен 1 — это не просто набор ингредиентов, а тщательно продуманная формула, где каждый компонент играет свою роль в симфонии развития ребенка. Давайте разберемся, как эта смесь подстраивается под потребности крохи и влияет на его рост и развитие.
Белковый профиль: фундамент роста
Белки в Нестожен 1 — это как кирпичики, из которых строится организм малыша. Но не просто кирпичики, а настоящие «умные» блоки. Смесь содержит оптимальное соотношение сывороточных белков и казеина (60:40), что делает ее максимально приближенной к составу грудного молока. Но в чем фишка? Эти белки подвергаются частичному гидролизу — проще говоря, их слегка «подтачивают», чтобы незрелой пищеварительной системе было легче их переварить.
Результат? Меньше колик, меньше запоров, меньше аллергических реакций. Это как если бы вы дали малышу не целое яблоко, а уже нарезанное на кусочки — удобно и легко усвоить. Исследования показывают, что такой подход снижает риск развития пищевой аллергии на 50%. Неплохо, правда?
Жировой компонент: не просто калории
Жиры в Нестожен 1 — это не про лишний вес, а про здоровое развитие. Смесь содержит сбалансированный комплекс растительных масел с добавлением молочного жира. Это как создать идеальную смазку для всех систем организма малыша. Особенно важны длинноцепочечные полиненасыщенные жирные кислоты омега-3 и омега-6 (DHA и ARA). Они играют ключевую роль в развитии мозга и зрения.
Представьте, что мозг вашего малыша — это суперкомпьютер. DHA и ARA — это как специальное масло, которое помогает всем деталям этого компьютера работать гладко и эффективно. Исследования показывают, что дети, получающие достаточное количество этих кислот, показывают лучшие результаты в тестах на когнитивное развитие. Круто, да?

Углеводный состав: энергия и не только
Углеводы в Нестожен 1 — это не просто про сладкий вкус. Основной углевод здесь — лактоза, тот самый сахар, который преобладает в грудном молоке. Но есть в составе и настоящая «изюминка» — пребиотики ГОС и ФОС. Это как посадить в кишечнике малыша целый сад полезных бактерий.
Зачем это нужно? Здоровая микрофлора кишечника — это основа иммунитета. Пребиотики помогают полезным бактериям расти и размножаться, создавая своеобразный защитный барьер. Исследования показывают, что дети, получающие смеси с пребиотиками, реже страдают от инфекционных заболеваний и имеют более мягкий стул. Это как дать иммунной системе малыша суперсилу!
Витамины и минералы: микровселенная пользы
Витамины и минералы в Нестожен 1 — это как команда супергероев, где у каждого своя суперспособность. Давайте рассмотрим некоторых из них:
- Витамин D: помогает усваивать кальций и формировать крепкие кости. Это как прочный фундамент для дома.
- Железо: участвует в образовании гемоглобина и предотвращает анемию. Представьте, что это маленькие грузовички, доставляющие кислород ко всем клеткам тела.
- Цинк: поддерживает иммунную систему и способствует заживлению ран. Это как щит, защищающий организм от врагов.
- Йод: необходим для правильной работы щитовидной железы и развития мозга. Это как дирижер, управляющий оркестром гормонов в организме.
Каждый из этих элементов тщательно дозирован, чтобы обеспечить оптимальное развитие малыша. Это не просто набор витаминок, а настоящая наука!
Нуклеотиды: секретное оружие роста
Нуклеотиды в составе Нестожен 1 — это как строительные блоки ДНК и РНК. Они участвуют в делении клеток и передаче генетической информации. Звучит сложно? Представьте, что организм вашего малыша — это быстро растущий город. Нуклеотиды — это как строительные материалы, которые позволяют этому городу расти быстро и правильно.
Исследования показывают, что добавление нуклеотидов в детские смеси может улучшать иммунный ответ и способствовать развитию здоровой микрофлоры кишечника. Это как дать организму малыша дополнительный стимул для роста и развития.

Особенности усвоения: комфорт прежде всего
Нестожен 1 разработан с учетом особенностей пищеварения новорожденных. Осмолярность смеси (около 290 мОсм/л) близка к осмолярности грудного молока. Что это значит? Представьте, что желудок малыша — это нежный цветок. Правильная осмолярность означает, что смесь не будет «обжигать» этот цветок, а мягко питать его.
Кроме того, смесь содержит легкоусвояемые формы минералов. Например, железо в Нестожен 1 представлено в виде железа сульфата, который легче усваивается, чем другие формы. Это как дать малышу не просто ложку с едой, а специальную ложку, которая сама находит путь к нужным клеткам.
Адаптация к возрасту: растем вместе
Нестожен 1 — это смесь для малышей от 0 до 6 месяцев. Но знаете ли вы, что состав смеси может слегка меняться в зависимости от партии? Это сделано для того, чтобы учесть сезонные колебания в составе молока животных, используемого для производства смеси. Таким образом, Нестожен 1 как бы «подстраивается» под потребности малыша в разные периоды года.
Это как иметь гардероб, который сам адаптируется к погоде за окном. Круто, правда?
Влияние на развитие: долгосрочные перспективы
Выбор смеси влияет не только на сегодняшнее самочувствие малыша, но и на его долгосрочное развитие. Исследования показывают, что дети, получавшие смеси с оптимальным соотношением белков и добавлением DHA и ARA, показывают лучшие результаты в тестах на когнитивное развитие даже в школьном возрасте.
Кроме того, правильно подобранная смесь может снизить риск ожирения в будущем. Как? Все дело в программировании метаболизма в раннем возрасте. Смеси с оптимальным белковым профилем, такие как Нестожен 1, помогают формировать правильные пищевые привычки с самого рождения.
Практические советы: как понять, что смесь подходит
Выбрали Нестожен 1? Отлично! Но как понять, что эта смесь действительно подходит вашему малышу? Вот несколько признаков:
- Стабильный набор веса: малыш должен набирать 150-200 грамм в неделю в первые 3 месяца.
- Регулярный стул: 1-2 раза в день, консистенция мягкая, но оформленная.
- Спокойный сон: малыш не просыпается от колик или дискомфорта в животе.
- Активность: после кормления малыш бодр и активен.
- Отсутствие аллергических реакций: нет сыпи, покраснений на коже.
Помните, что адаптация к новой смеси может занять 5-7 дней. Это как переезд в новый дом — нужно время, чтобы привыкнуть.

Мифы и реальность: разоблачаем заблуждения
Вокруг детских смесей ходит немало мифов. Давайте разберем некоторые из них:
Миф 1: «Все смеси одинаковы». Реальность: Каждая смесь имеет свои особенности. Нестожен 1, например, выделяется наличием частично гидролизованных белков и добавлением молочного жира.
Миф 2: «Смеси вызывают аллергию». Реальность: Современные смеси, такие как Нестожен 1, разработаны с учетом риска аллергии. Частичный гидролиз белков и сбалансированный состав снижают этот риск.
Миф 3: «Смеси не содержат полезных веществ грудного молока». Реальность: Хотя смеси не могут полностью повторить состав грудного молока, они содержат многие важные компоненты, такие как нуклеотиды и пребиотики.
Разоблачение этих мифов помогает родителям принимать более осознанные решения при выборе питания для своего малыша.
Безопасность прежде всего: Контроль качества и проверка состава смеси Нестожен 1
Когда речь идет о питании малыша, безопасность — это не просто слово, а целая философия. Нестожен 1 — это не просто смесь, а результат многолетних исследований и тщательного контроля качества. Но как же на самом деле проверяется состав этой смеси? Давайте заглянем за кулисы производства и узнаем, какие меры принимаются для обеспечения безопасности каждой баночки Нестожен 1.
Многоступенчатый контроль: от фермы до прилавка
Представьте, что производство Нестожен 1 — это как путешествие по реке. На каждом повороте этой реки стоят контрольные пункты, где проверяется качество «воды». Первая остановка — фермы, где получают молоко. Здесь проводится тщательный мониторинг здоровья коров и качества их питания. Это как выбор правильной почвы для выращивания урожая — основа всего процесса.
Следующий этап — переработка молока. Здесь применяются передовые технологии очистки и стерилизации. Это не просто кипячение, а целый комплекс процессов, включающий микрофильтрацию и ультрапастеризацию. Представьте, что молоко проходит через множество невидимых сит, каждое из которых улавливает всё более мелкие примеси.

Лабораторные исследования: под микроскопом науки
Но настоящая магия начинается в лаборатории. Каждая партия Нестожен 1 проходит более 100 различных тестов! Это как если бы ваш ребенок сдавал экзамены каждый день, чтобы подтвердить свои знания. Что же проверяют эти тесты?
- Микробиологический анализ: отсутствие патогенных микроорганизмов
- Химический состав: соответствие заявленному содержанию белков, жиров, углеводов
- Витамины и минералы: их количество и биодоступность
- Аллергенность: проверка на наличие потенциальных аллергенов
- Осмоляльность: соответствие физиологическим нормам для комфортного пищеварения
Каждый из этих тестов — это как отдельная глава в книге безопасности Нестожен 1. И только когда все главы прочитаны и одобрены, смесь отправляется в производство.
Инновационные технологии: на страже качества
В контроле качества Нестожен 1 используются самые современные технологии. Например, масс-спектрометрия для анализа белкового профиля. Звучит сложно? Представьте, что это как детектор лжи для белков — он может точно определить, какие именно белки и в каком количестве присутствуют в смеси.
Другая крутая технология — хроматография для анализа жирных кислот. Это как если бы вы могли разложить радугу на отдельные цвета и измерить интенсивность каждого. Так же точно измеряется содержание каждой жирной кислоты в составе смеси.
Международные стандарты: глобальный подход
Нестожен 1 производится в соответствии с международными стандартами качества. Это не просто красивые слова, а реальные требования, которые нужно соблюдать. Среди них:
- ISO 22000: система менеджмента безопасности пищевой продукции
- HACCP: система анализа рисков и критических контрольных точек
- GMP: правила надлежащей производственной практики
Соблюдение этих стандартов — это как получение черного пояса в карате качества. Это гарантия того, что каждая баночка Нестожен 1 соответствует высочайшим требованиям безопасности.
Состав смеси: под лупой науки
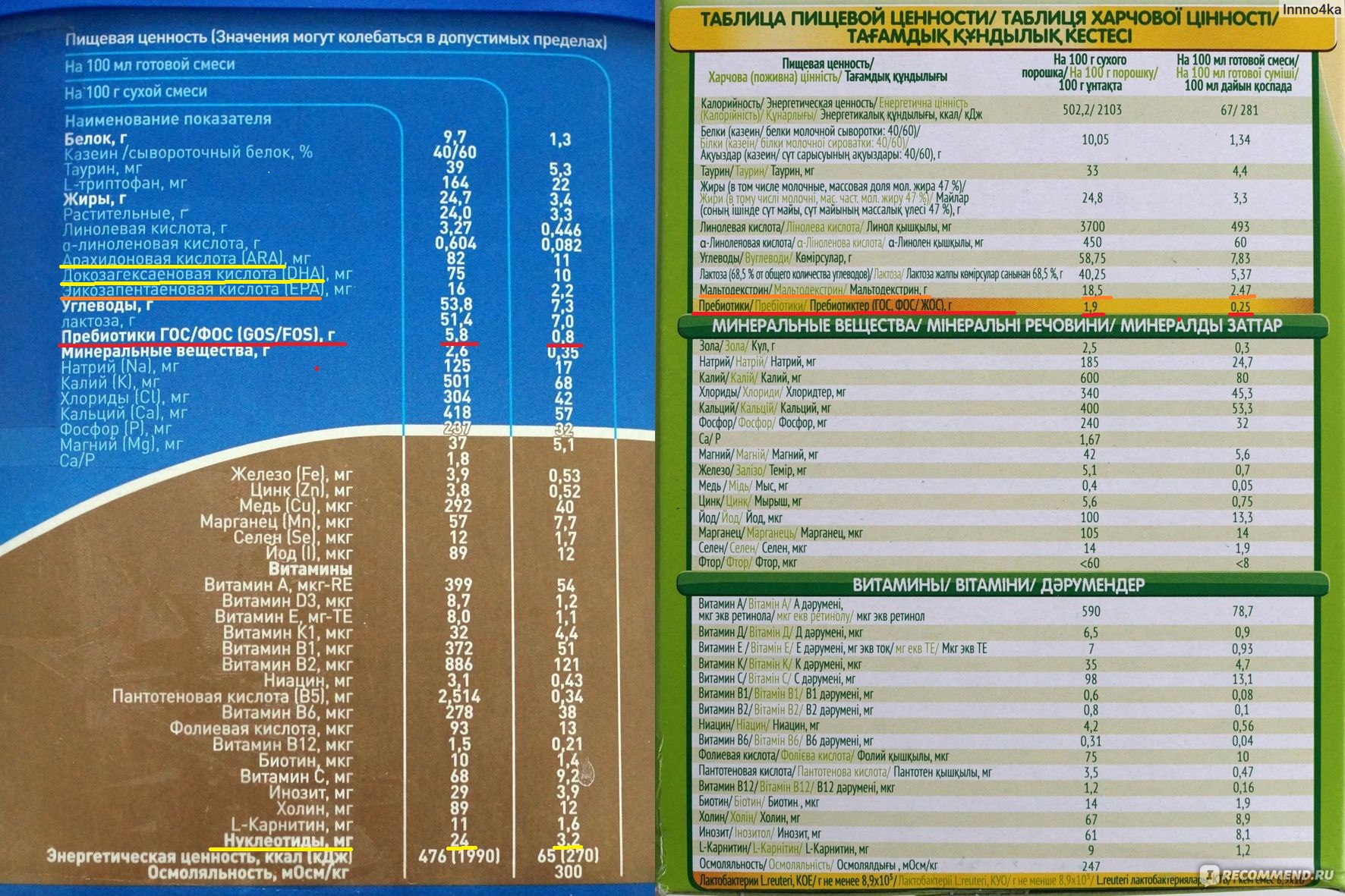
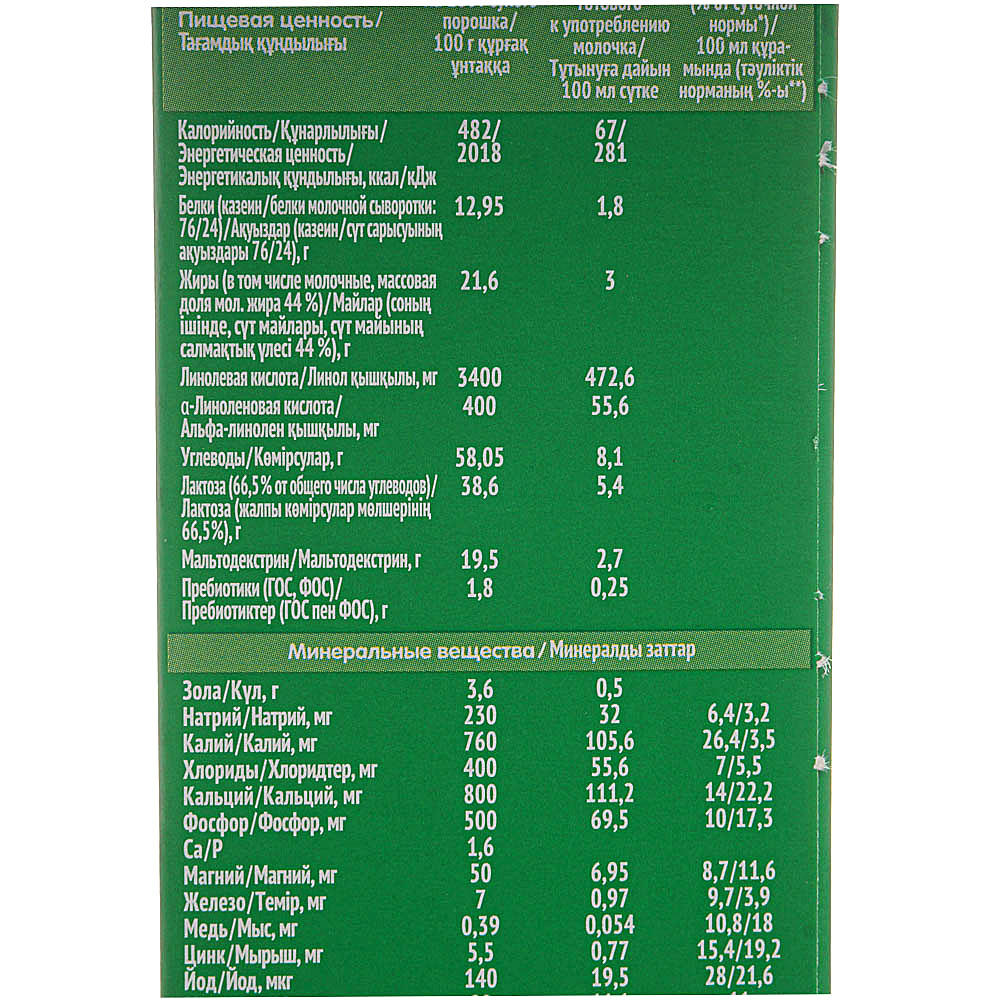
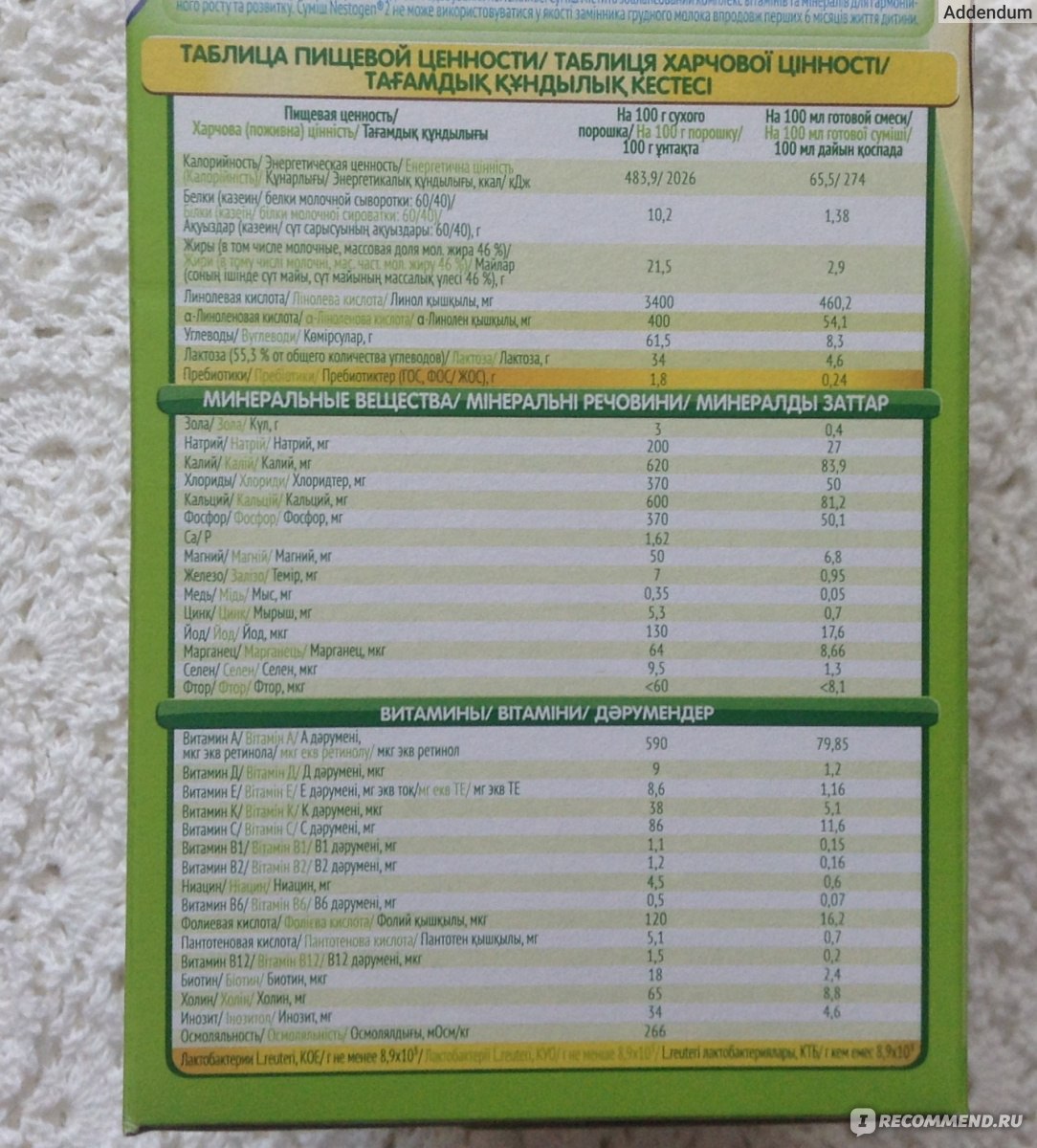
Теперь давайте посмотрим на состав Нестожен 1 более детально. Каждый компонент здесь не случаен, а тщательно подобран и протестирован. Вот краткая таблица состава на 100 мл готовой смеси:

- Белки: 1,3 г (60% сывороточных, 40% казеина)
- Жиры: 3,4 г (включая ДЦПНЖК)
- Углеводы: 7,4 г (в основном лактоза)
- Энергетическая ценность: 67 ккал
- Кальций: 41 мг
- Железо: 0,53 мг
- Витамин D: 1,2 мкг
- Нуклеотиды: 3,2 мг
Каждая цифра в этой таблице — результат многолетних исследований и клинических испытаний. Это не просто набор ингредиентов, а тщательно выверенная формула, максимально приближенная к составу грудного молока.
Аллергенность: минимизация рисков
Особое внимание при производстве Нестожен 1 уделяется снижению риска аллергических реакций. Как это достигается? Во-первых, используется частичный гидролиз белков. Это как предварительное пережевывание пищи — белки разбиваются на более мелкие фрагменты, которые реже вызывают аллергию.
Во-вторых, строго контролируется отсутствие перекрестного загрязнения аллергенами на производстве. Это как правило «чистых рук» в хирургии — ничто потенциально опасное не должно попасть в смесь.
Сроки годности: наука сохранения
Срок годности Нестожен 1 — это не просто дата на упаковке. Это результат сложных расчетов и тестов на стабильность. Каждый компонент смеси проверяется на устойчивость к различным условиям хранения. Представьте, что это как тест на выживание в экстремальных условиях — только те компоненты, которые проходят этот тест, попадают в конечный продукт.
Интересный факт: срок годности смеси может варьироваться в зависимости от упаковки. Например, в жестяной банке смесь хранится дольше, чем в картонной коробке. Это как разница между хранением продуктов в холодильнике и на открытом воздухе.
Экологическая безопасность: забота о будущем
Контроль качества Нестожен 1 включает в себя и заботу об окружающей среде. Это не просто модный тренд, а необходимость в современном мире. На производстве внедряются энергосберегающие технологии, минимизируются отходы, используется экологичная упаковка.
Например, знаете ли вы, что картонная упаковка Нестожен 1 производится из возобновляемых источников и может быть переработана? Это как посадить новое дерево взамен срубленного — забота о природе начинается с малого.
Обратная связь: диалог с потребителем
Контроль качества не заканчивается на этапе производства. Компания-производитель внимательно следит за отзывами потребителей, проводит регулярные опросы, анализирует обращения на горячую линию. Это как постоянный диалог между создателями смеси и родителями.
Каждое замечание или предложение тщательно изучается и, если необходимо, вносятся коррективы в производственный процесс. Это непрерывный процесс улучшения, направленный на то, чтобы сделать Нестожен 1 еще лучше и безопаснее.
Мифы и реальность: развенчиваем заблуждения
Вокруг детских смесей ходит много мифов. Давайте разберем некоторые из них:
Миф 1: «В составе смесей много химии». Реальность: Компоненты Нестожен 1 максимально приближены к составу грудного молока. Да, есть синтетические витамины и минералы, но они идентичны натуральным по своей структуре и функциям.
Миф 2: «Смеси производятся без строгого контроля». Реальность: Как мы уже убедились, контроль качества на производстве Нестожен 1 многоступенчатый и очень строгий.
Миф 3: «Все смеси одинаковы по составу». Реальность: Каждая смесь имеет свои особенности. Нестожен 1, например, отличается наличием частично гидролизованных белков и особым жировым составом.
Развенчивание этих мифов помогает родителям принимать более осознанные решения при выборе питания для своего малыша.
Отзывы экспертов: Почему педиатры рекомендуют Нестожен 1 для искусственного вскармливания
Выбор смеси для новорожденного — это настоящий квест для молодых родителей. Как не запутаться в море предложений и выбрать то, что действительно подойдет вашему малышу? Давайте разберемся, почему Нестожен 1 стал фаворитом среди педиатров и мам.
Начнем с самого главного — состава. Нестожен 1 состав смеси таблица состав впечатляет своей продуманностью. Что же там такого особенного? Во-первых, оптимальное соотношение белков, жиров и углеводов, максимально приближенное к грудному молоку. Это не просто красивые слова — за этим стоят годы исследований и разработок.

Но давайте копнем глубже. Белковый компонент Нестожен 1 представлен сывороточными белками и казеином в пропорции 60:40. Почему это важно? Такое соотношение обеспечивает легкое усвоение и снижает риск аллергических реакций. А ведь чувствительный животик новорожденного — это настоящая головная боль для родителей!
Жировой состав тоже не отстает. Здесь мы видим комбинацию растительных масел, которая обеспечивает оптимальный баланс омега-3 и омега-6 жирных кислот. Эти ребята играют ключевую роль в развитии мозга и зрения малыша. Кто бы мог подумать, что обычная смесь может быть настолько продвинутой?
А теперь о сладком. Углеводный компонент представлен лактозой — основным углеводом грудного молока. Это не только источник энергии, но и пища для полезных бактерий в кишечнике малыша. Вот вам и секрет здорового пищеварения!
Микронутриенты: мелочи, которые решают все
Нестожен 1 состав смеси таблица состав не ограничивается макронутриентами. Здесь целый комплекс витаминов и минералов, каждый из которых играет свою роль. Железо для профилактики анемии, кальций и витамин D для крепких костей, цинк для иммунитета… Список можно продолжать бесконечно!
Но есть в составе Нестожен 1 и настоящие звезды. Например, пребиотики GOS и FOS. Эти ребята не просто модное дополнение — они реально работают! Пребиотики стимулируют рост полезной микрофлоры в кишечнике, что особенно важно для малышей на искусственном вскармливании. Результат? Меньше колик, запоров и других неприятностей.
А что насчет нуклеотидов? Эти строительные блоки ДНК и РНК играют важнейшую роль в формировании иммунной системы. Добавление их в состав смеси — это не просто прихоть производителя, а результат серьезных научных исследований. Кто сказал, что наука не может быть вкусной?
Практический опыт: что говорят мамы?
Теория теорией, но что на практике? Опросы показывают, что многие мамы отмечают улучшение сна и общего состояния малышей после перехода на Нестожен 1. «Мой сын стал спать спокойнее, а животик беспокоит гораздо реже», — делится Анна, мама 3-месячного Миши. И таких отзывов немало!

Конечно, каждый ребенок индивидуален, и то, что подходит одному, может не подойти другому. Но статистика говорит сама за себя — Нестожен 1 становится выбором все большего числа родителей. Почему? Да потому что работает!
Экспертное мнение: слово педиатрам
А что думают специалисты? Доктор Елена Петрова, педиатр с 20-летним стажем, отмечает: «Нестожен 1 — это не просто еще одна смесь на рынке. Это продукт, созданный с учетом последних научных достижений в области детского питания. Особенно впечатляет сбалансированный состав и наличие пребиотиков».
Другой эксперт, неонатолог Михаил Сидоров, добавляет: «Важно понимать, что искусственное вскармливание — это не просто замена грудного молока. Это сложный процесс, требующий тщательного подбора смеси. И Нестожен 1 в этом плане — отличный вариант для старта».
Как правильно выбрать и использовать Нестожен 1?
Итак, вы решили попробовать Нестожен 1. С чего начать? Во-первых, всегда консультируйтесь с педиатром перед введением новой смеси. Во-вторых, внимательно читайте инструкцию по приготовлению — правильная концентрация критически важна для здоровья малыша.
Начинайте введение смеси постепенно, заменяя одно кормление за другим. Наблюдайте за реакцией ребенка — отсутствие высыпаний, колик и нарушений стула будет хорошим знаком. Помните, что адаптация может занять несколько дней.
И еще один важный момент — хранение. Открытую банку смеси нужно использовать в течение месяца и хранить в сухом прохладном месте. Готовую смесь нельзя хранить более двух часов при комнатной температуре. Эти простые правила помогут сохранить все полезные свойства продукта.
Нестожен 1 vs другие смеси: в чем разница?
Конечно, Нестожен 1 — не единственная смесь на рынке. Чем же она отличается от конкурентов? Во-первых, оптимизированным белковым профилем. Многие смеси содержат избыток белка, что может создать дополнительную нагрузку на незрелые почки младенца. Нестожен 1 решает эту проблему.
Во-вторых, наличием пребиотиков GOS и FOS в оптимальной концентрации. Не все производители уделяют должное внимание этому аспекту. А ведь здоровая микрофлора — это основа иммунитета и правильного пищеварения.

Наконец, Нестожен 1 отличается сбалансированным жировым составом. Комбинация растительных масел обеспечивает оптимальное усвоение жирорастворимых витаминов и поддерживает развитие нервной системы малыша.
Мифы и реальность: развенчиваем заблуждения
Вокруг искусственного вскармливания ходит множество мифов. Давайте разберем некоторые из них. Миф первый: «Смеси вызывают аллергию». На самом деле, современные смеси, в том числе Нестожен 1, созданы с учетом риска аллергических реакций и содержат гипоаллергенные компоненты.
Миф второй: «Дети на искусственном вскармливании чаще болеют». Это не совсем так. При правильном подборе смеси и соблюдении правил гигиены риск заболеваний не выше, чем у детей на грудном вскармливании. А наличие в составе Нестожен 1 иммуномодулирующих компонентов дополнительно поддерживает защитные силы организма.
И наконец, миф третий: «Все смеси одинаковые». Как мы уже убедились, это далеко не так. Каждая смесь имеет свои особенности, и Нестожен 1 выделяется своим научно обоснованным составом.
В заключение хочется сказать: выбор смеси для новорожденного — это не просто покупка продукта питания. Это инвестиция в здоровье и развитие вашего малыша. И Нестожен 1, судя по отзывам экспертов и родителей, является отличным выбором для старта искусственного вскармливания. Помните, что каждый ребенок уникален, и то, что идеально подходит одному, может не подойти другому. Поэтому всегда консультируйтесь с педиатром и внимательно следите за реакцией малыша. Здоровья вам и вашим детям!
Практические советы: Как правильно готовить и хранить смесь Нестожен 1 для максимальной пользы
Выбор смеси для новорожденного — это настоящий квест для молодых родителей. И вот, после долгих поисков и консультаций, вы остановились на Нестожен 1. Отличный выбор! Но теперь возникает новый вопрос: как правильно готовить и хранить эту смесь, чтобы сохранить все ее полезные свойства? Давайте разберемся в этом вопросе детально, ведь от правильного приготовления зависит не только вкус, но и польза для вашего малыша.

Начнем с самого важного — состава. Нестожен 1 состав смеси таблица состав впечатляет своей сбалансированностью. Здесь есть все необходимое для растущего организма: оптимальное соотношение белков, жиров и углеводов, витамины, минералы и даже пребиотики. Но чтобы все эти компоненты работали как надо, нужно соблюдать правила приготовления.
Шаг за шагом: готовим смесь как профи
Итак, как же приготовить идеальную бутылочку Нестожен 1? Первое правило — чистота. Вымойте руки, простерилизуйте бутылочку и соску. Это не паранойя, а забота о здоровье малыша. Бактерии — те еще пронырыпохитители, готовые испортить даже самую качественную смесь.
Теперь о воде. Используйте кипяченую воду, остывшую до 40-50°C. Почему не холодную? Дело в том, что некоторые компоненты смеси лучше растворяются в теплой воде. Это как с какао — попробуйте размешать его в ледяном молоке, и вы поймете, о чем я.
Следующий шаг — дозировка. Нестожен 1 состав смеси таблица состав предполагает определенное соотношение порошка и воды. Обычно это одна мерная ложка на 30 мл воды, но всегда проверяйте инструкцию — производитель может внести изменения. Точность здесь важна как в аптеке — перебор с порошком может привести к запорам, а недобор — к недоеданию.
Теперь самое интересное — смешивание. Не взбивайте смесь как коктейль в баре, но и не ленитесь перемешать как следует. Идеальный вариант — плавные круговые движения, пока все комочки не растворятся. Это как медитация — спокойно и методично, думая о том, как ваш малыш будет наслаждаться идеально приготовленной смесью.
Хранение: искусство сохранения пользы
Вы приготовили идеальную смесь, но ребенок не готов ее съесть прямо сейчас? Не паникуйте, у вас есть варианты. Готовую смесь можно хранить в холодильнике до 24 часов. Но помните — это максимальный срок, а не рекомендация. Чем свежее смесь, тем лучше.
А что насчет открытой банки с сухой смесью? Нестожен 1 состав смеси таблица состав предполагает использование в течение месяца после открытия. Храните банку в сухом прохладном месте, плотно закрывая крышку после каждого использования. Влага — главный враг сухой смеси, превращающий ее в неаппетитные комки.

Температурные фокусы: подогрев без потерь
Допустим, вы достали бутылочку из холодильника. Как подогреть ее, не уничтожив все полезные свойства? Забудьте о микроволновке — это табу для детского питания. Лучший способ — водяная баня или специальный подогреватель. Это как спа-процедура для вашей смеси — нежно и равномерно.
После подогрева обязательно проверьте температуру. Капните немного смеси на внутреннюю сторону запястья — она должна быть чуть теплой, но не горячей. Помните, что перегрев может разрушить некоторые полезные компоненты смеси.
Путешествия со смесью: мобильное питание
А как быть, если вы в дороге? Нестожен 1 состав смеси таблица состав позволяет приготовить смесь заранее и взять с собой в термосе. Но есть лайфхак получше — возьмите с собой стерильную бутылочку с отмеренным количеством сухой смеси и бутылку с кипяченой водой. Смешайте непосредственно перед кормлением — свежее и безопаснее не бывает!
Индивидуальный подход: слушаем малыша
Помните, что каждый ребенок уникален. Кто-то предпочитает смесь чуть теплее, кто-то — прохладнее. Наблюдайте за реакцией малыша и корректируйте свои действия. Это как настройка музыкального инструмента — тонкая работа, требующая внимания и чуткости.
Эксперименты на кухне: адаптируем смесь
Когда малыш подрастет, вы можете начать экспериментировать. Нестожен 1 состав смеси таблица состав позволяет добавлять смесь в детские каши или пюре для обогащения их состава. Но помните — любые эксперименты только после консультации с педиатром!
Мифы и реальность: развенчиваем заблуждения
Существует миф, что смесь можно разводить обычной водой из-под крана. Это опасное заблуждение! Водопроводная вода может содержать вредные бактерии и примеси. Всегда используйте кипяченую или специальную детскую воду.
Другое распространенное заблуждение — чем гуще смесь, тем сытнее малыш. На самом деле, нарушение пропорций может привести к проблемам с пищеварением. Придерживайтесь рекомендаций на упаковке — они разработаны с учетом потребностей ребенка.

Экономия без потерь: как рационально использовать смесь
Нестожен 1 — продукт не из дешевых, и это понятно, учитывая его состав. Но есть способы сэкономить без ущерба для качества. Например, не готовьте сразу большое количество смеси — делайте столько, сколько малыш съест за одно кормление. Так вы избежите лишних трат и всегда будете уверены в свежести питания.
Еще один совет — внимательно следите за сроком годности и правильно храните открытую банку. Испорченная смесь — это не только потраченные деньги, но и потенциальная опасность для здоровья малыша.
Технологические новинки: помощники в приготовлении
Современные родители могут облегчить себе жизнь с помощью технологий. Существуют специальные машины для приготовления детской смеси, которые автоматически отмеряют нужное количество порошка и воды, подогревают до нужной температуры. Это как личный бариста для вашего малыша — точность и удобство в одном устройстве.
Но помните, что даже самая умная машина не заменит вашего внимания и заботы. Технологии — это помощь, а не замена родительского участия.
Экологичный подход: минимизируем отходы
В наше время важно думать об экологии. Как же совместить заботу о малыше и планете? Начните с малого — выбирайте смесь в перерабатываемой упаковке. Нестожен 1 часто выпускается в жестяных банках, которые легко сдать на переработку.
Кроме того, не выбрасывайте пустые банки сразу — они могут пригодиться для хранения мелочей или даже стать материалом для детского творчества. Так вы не только сократите количество отходов, но и научите малыша важности повторного использования вещей.
В заключение хочется сказать: правильное приготовление и хранение смеси Нестожен 1 — это не просто набор правил, а настоящее искусство. Это забота о здоровье и комфорте вашего малыша, выраженная в простых, но важных действиях. Помните, что каждая ложка приготовленной вами смеси — это вклад в будущее вашего ребенка. Будьте внимательны, следуйте рекомендациям и не бойтесь экспериментировать (в разумных пределах, конечно). И пусть каждое кормление станет моментом близости и любви между вами и вашим малышом!

