Содержание
ЭМБРИОНАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ МЫШИ И ЧЕЛОВЕКА | Мензоров
1. Медведев С.П., Шевченко А.И., Сухих Г.Т., Закиян С.М. Индуцированные плюрипотентные стволовые клетки. Новосибирск: Изд-во СО РАН, 2011. 216 с.
2. Bock C., Kiskinis E., Verstappen G. et al. Reference maps of human ES and iPS cell variation enable high-throughput characterization of pluripotent cell lines // Cell. 2011. V. 144. No. 3. P. 439–452.
3. Bradley A., Evans M., Kaufman M.H., Robertson E. Formation of germ-line chimaeras from embryo-derived teratocarcinoma cell lines // Nature. 1984. V. 309(5965). P. 255–256.
4. Bryja V., Bonilla S., Cajanek L. et al. An effi cient method for the derivation of mouse embryonic stem cells // Stem Cells. 2006. V. 24. No. 4. P. 844–849.
5. Buehr M., Meek S., Blair K. et al. Capture of authentic embryonic stem cells from rat blastocysts // Cell. 2008. V. 135. No. 7. P. 1287–1298.
6. Chambers I., Colby D., Robertson M. et al. Functional expression cloning of Nanog, a pluripotency sustaining factor in embryonic stem cells // Cell. 2003. V. 113. No. 5. P. 643–655.
2003. V. 113. No. 5. P. 643–655.
7. Dean W., Bowden L., Aitchison A. et al. Altered imprinted gene methylation and expression in completely ES cell-derived mouse fetuses: association with aberrant phenotypes // Development. 1998. V. 125. No. 12. P. 2273–2282.
8. Evans M.J. The isolation and properties of a clonal tissue culture strain of pluripotent mouse teratocarcinoma cells // J. Embryol. Exp. Morphol. 1972. V. 28. P. 163–196.
9. Evans M. Discovering pluripotency: 30 years of mouse embryonic stem cells // Nat. Rev. Mol. Cell. Biol. 2011. V. 12. No. 10. P. 680–686.
10. Evans M.J., Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos // Nature. 1981. V. 292. P. 154–156.
11. Friel R., van der Sar S., Mee P.J. Embryonic stem cells: understanding their history, cell biology and signaling // Adv. Drug Deliv. Rev. 2005. V. 57. No. 13. P. 1894–1903.
12. Guo J., Jauch A., Heidi H.G. et al. Multicolor karyotype analyses of mouse embryonic stem cells // In Vitro Cell.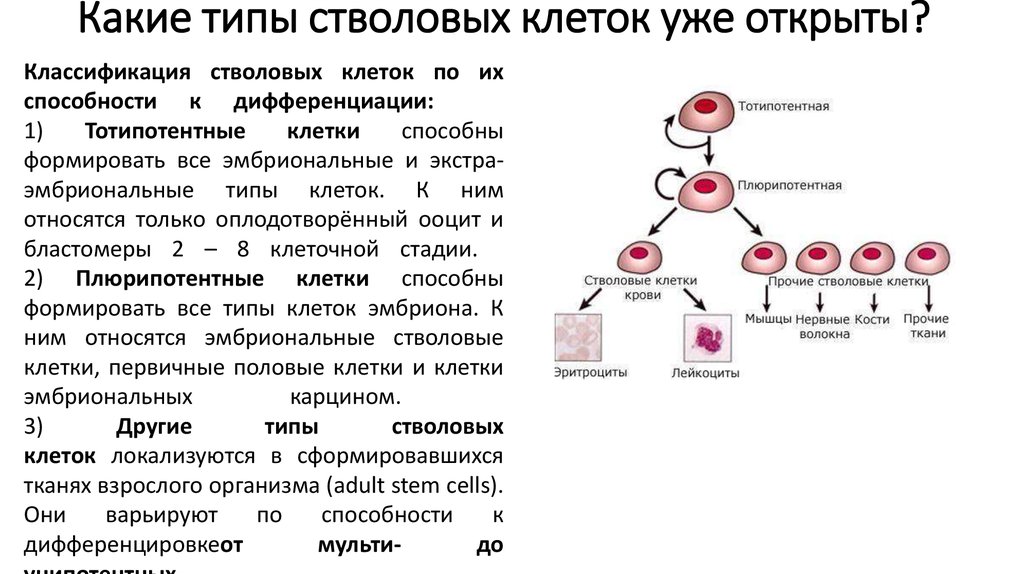 Dev. Biol. Anim. 2005. V. 41. No. 8/9. P. 278–283.
Dev. Biol. Anim. 2005. V. 41. No. 8/9. P. 278–283.
13. Hanna J., Cheng A.W., Saha K. et al. Human embryonic stem cells with biological and epigenetic characteristics similar to those of mouse ESCs // Proc. Natl Acad. Sci. USA. 2010a. V. 107. P. 9222–9227.
14. Hanna J.H., Saha K., Jaenisch R. Pluripotency and cellular reprogramming: facts, hypotheses, unresolved issues // Cell. 2010b. V. 143. No. 4. P. 508–525.
15. Hayashi K., Ohta H., Kurimoto K. et al. Reconstitution of the mouse germ cell specifi cation pathway in culture by pluripotent stem cells // Cell. 2011. V. 146. No. 4. P. 519–532.
16. Hayashi K., Ogushi S., Kurimoto K. et al. Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice // Science. 2012. [DOI:10.1126/science.1226889].
17. Holubcová Z., Matula P., Sedlačkova M. et al. Human embryonic stem cells suffer from centrosomal amplifi cation // Stem Cells. 2011. V. 29. No. 1. P. 46–56.
18. Laurent L.C., Ulitsky I. , Slavin I. et al. Dynamic changes in the copy number of pluripotency and cell proliferation genes in human ESCs and iPSCs during reprogramming and time in culture // Cell. Stem. Cell. 2011. V. 8. No. 1. P. 106–118.
, Slavin I. et al. Dynamic changes in the copy number of pluripotency and cell proliferation genes in human ESCs and iPSCs during reprogramming and time in culture // Cell. Stem. Cell. 2011. V. 8. No. 1. P. 106–118.
19. Li P., Tong C., Mehrian-Shai R. et al. Germline competent embryonic stem cells derived from rat blastocysts // Cell. 2008. V. 135. No. 7. P. 1299–1310.
20. Liang Q., Conte N., Skarnes W.C., Bradley A. Extensive genomic copy number variation in embryonic stem cells // Proc. Natl Acad. Sci. USA. 2008. V. 105. No. 45. P. 17453–17456.
21. Liu X., Wu H., Loring J. et al. Trisomy eight in ES cells is a common potential problem in gene targeting and interferes with germ line transmission // Dev. Dyn. 1997. V. 209. No. 1. P. 85–91.
22. Macfarlan T.S., Gifford W.D., Driscoll S. et al. Embryonic stem cell potency fl uctuates with endogenous retrovirus activity // Nature. 2012. V. 487. No. 7405. P. 57–63.
23. Mantel C., Guo Y., Lee M.R. et al. Checkpoint-apoptosis uncoupling in human and mouse embryonic stem cells: a source of karyotуpic instability // Blood. 2007. V. 109. No. 10. P. 4518–4527.
2007. V. 109. No. 10. P. 4518–4527.
24. Martin G.R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells // Proc. Natl Acad. Sci. USA. 1981. V. 78. P. 7634–7638.
25. Martin G.R., Evans M.J. Differentiation of clonal lines of teratocarcinoma cells: formation of embryoid bodies in vitro // Proc. Natl Acad. Sci. USA. 1975. V. 72. P. 1441–1445.
26. Mintz B., Illmensee K. Normal genetically mosaic mice produced from malignant teratocarcinoma cells // Proc. Natl Acad. Sci. USA. 1975. V. 72. P. 3585–3589.
27. Nagy A., Gocza E., Diaz E.M. et al. Embryonic stem cells alone are able to support fetal development in the mouse // Development. 1990. V. 110. No. 3. P. 815–821.
28. Nagy A., Rossant J., Nagy R. et al. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells // Proc. Natl Acad. Sci. USA. 1993. V. 90. No. 18. P. 8424–8428.
29. Nichols J., Evans E.P., Smith A. G. Establishment of germ-linecompetent embryonic stem (ES) cells using differentiation inhibiting activity // Development. 1990. V. 110. No. 4. P. 1341–1348.
G. Establishment of germ-linecompetent embryonic stem (ES) cells using differentiation inhibiting activity // Development. 1990. V. 110. No. 4. P. 1341–1348.
30. Nishikawa S., Jakt L.M., Era T. Embryonic stem-cell culture as a tool for developmental cell biology // Nat. Rev. Mol. Cell. Biol. 2007. V. 8. No. 6. P. 502–507.
31. Papaioannou V.E., McBurney M.W., Gardner R.L., Evans M.J. Fate of teratocarcinoma cells injected into early mouse embryos // Nature. 1975. V. 258. P. 70–73.
32. Rugg-Gunn P.J., Ferguson-Smith A.C., Pedersen R.A. Status of genomic imprinting in human embryonic stem cells as revealed by a large cohort of independently derived and maintained lines // Hum. Mol. Genet. 2007. V. 16. No. 2. P. 243–251.
33. Solter D., Knowles B.B. Monoclonal antibody defi ning a stagespecific mouse embryonic antigen (SSEA-1) // Proc. Natl Acad. Sci. USA. 1978. V. 75. P. 5565–5569.
34. Stevens L.C., Little C.C. Spontaneous testicular teratomas in an inbred strain of mice // Proc.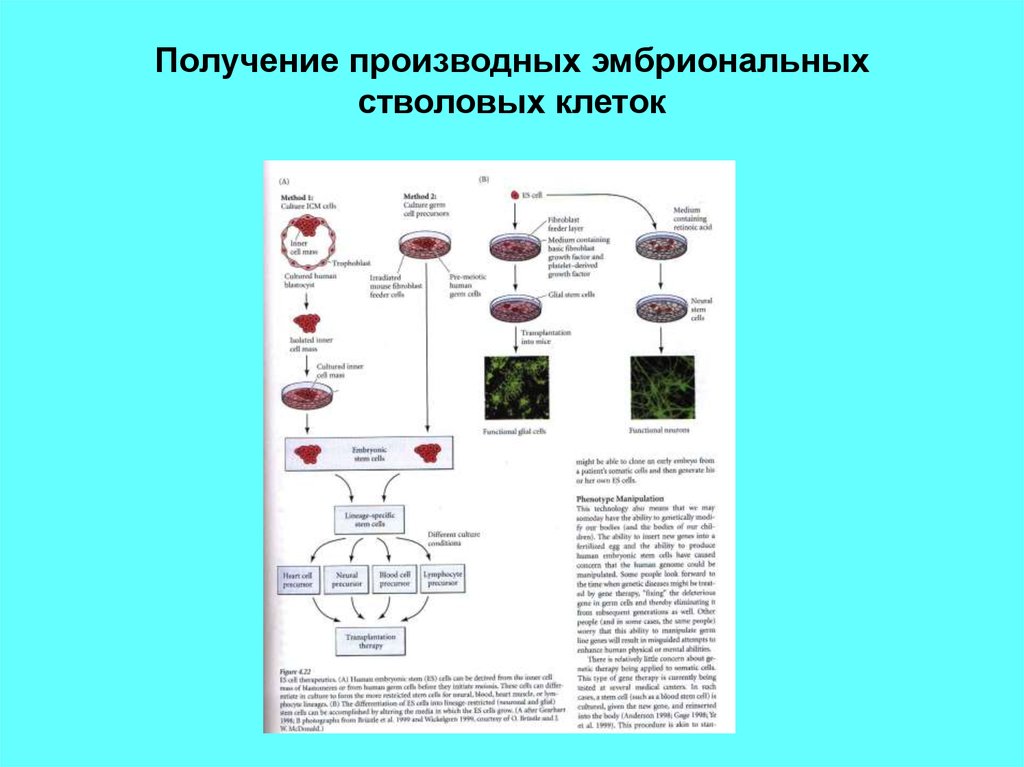 Natl Acad. Sci. USA. 1954. V. 40. P. 1080–1087.
Natl Acad. Sci. USA. 1954. V. 40. P. 1080–1087.
35. Sugawara A., Goto K., Sotomaru Y. et al. Current status of chromosomal abnormalities in mouse embryonic stem cell lines used in Japan // Comp. Med. 2006. V. 56. No. 1. P. 31–34.
36. Takahashi K., Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fi broblast cultures by defi ned factors // Cell. 2006. V. 126. No. 4. P. 663–676.
37. Tam P.P., Rossant J. Mouse embryonic chimeras: tools for studying mammalian development // Development. 2003. V. 130. No. 25. P. 6155–6163.
38. Thomson J.A., Itskovitz-Eldor J., Shapiro S.S. et al. Embryonic stem cell lines derived from human blastocysts // Science. 1998. V. 282. No. 5391. P. 1145–1147.
39. Thomson J.A., Kalishman J., Golos T.G. et al. Isolation of a primate embryonic stem cell line // Proc. Natl Acad. Sci. USA. 1995. V. 92. No. 17. P. 7844–7848.
40. Vierbuchen T., Ostermeier A., Pang Z.P. et al. Direct conversion of fi broblasts to functional neurons by defi ned factors // Nature. 2010. V. 463 No. 7284. P. 1035–1041.
2010. V. 463 No. 7284. P. 1035–1041.
41. Watanabe K., Ueno M., Kamiya D. et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells // Nat. Biotechnol. 2007. V. 25. No. 6. P. 681–686.
42. Wobus A.M., Boheler K.R. Embryonic stem cells: prospects for developmental biology and cell therapy // Physiol. Rev. 2005. V. 85. No. 2. P. 635–678.
43. Ying Q.L., Nichols J., Chambers I., Smith A. BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3 // Cell. 2003. V. 115. No. 3. P. 281–292.
Искусственные и эмбриональные стволовые клетки похожи друг на друга
При одинаковом генетическом наборе отличия между эмбриональными и индуцированными стволовыми клетками оказываются весьма невелики.
Всякий раз, когда заходит речь о стволовых клетках, приходится упоминать о том, что есть натуральные стволовые клетки и искусственные, и что насчёт последних у биологов до сих пор остаются некоторые сомнения.
Эмбриональные стволовые клетки. (Фото Stem MD / Flickr.com.)
Индуцированные стволовые клетки, полученные из клеток кои человека. (Фото Science 3.0 / www.flickr.com/photos/scientificrelevance/4206507558.)
‹
›
Открыть в полном размере
Под натуральными мы здесь имеем в виду эмбриональные плюрипотентные стволовые клетки – из них состоит эмбрион на самых ранних этапах развития и именно они дают начало всем прочим специализированным клеткам: мышечным, эпителиальным, нервным и т. д. (На самом деле, между эмбриональной и полностью специализированной клеткой есть ещё целый ряд «стволовых» стадий, но всю эту сложную картину мы сейчас описывать не будем.) Иными словами, из эмбриональных плюрипотентных клеток можно вырастить что угодно, и их перспективы в биологии и медицине были бы бескрайними, если бы не «исходный материал» – то есть человеческие эмбрионы, из которых такие клетки только и можно взять.
Поэтому можно представить энтузиазм медиков и биологов, когда 2006 году Синъя Яманака получил так называемые индуцированные плюрипотентные стволовые клетки (iPSC, или iPS): оказалось, что если в зрелой, специализированной клетке изменить активность всего четырёх генов, то она в буквальном смысле впадёт в детство, то есть превратится в эмбриональную стволовую клетку. И теперь с помощью разных регуляторных белков её можно направить по нужному пути развития.
И теперь с помощью разных регуляторных белков её можно направить по нужному пути развития.
Таким образом, мы можем, например, из клетки кожи через индуцированную стволовую стадию получить нейрон. Однако тут возникает вполне естественный вопрос: насколько искусственные стволовые клетки (и те, которые мы из них получаем) похожи на натуральные, эмбриональные стволовые клетки?
Поначалу казалось, что отличия существенны, что многие гены у индуцированных клеток работают не так, как у эмбриональных, и, если мы захотим использовать «ненатуральные» клетки в медицине, то их «ненатуральная» генетическая активность может привести к разным неблагоприятным последствиям.
Однако потом стали появляться данные, говорившие о том, что обе разновидности клеток на самом деле похожи друг на друга. Так, осенью прошлого года в Nature Biotechnology вышла статья, авторы которой говорили о том, что отличия между индуцированными и эмбриональными стволовыми клетками не так уж велики.
Те различия, которые наблюдали раньше, происходили, очевидно, от того, что клетки для сравнения брали из различных источников, то есть они были генетически отличны друг от друга (например, если мы сравниваем эмбриональные клетки, полученные от женского эмбриона, с индуцированными стволовыми клетками, полученными от мужчины, то молекулярно-генетическая разница между теми и другими может иметь место не потому, что одни – натуральные, а другие – искусственные, а потому, что гены в мужском и женском организме в принципе работают по-разному).
В новой статье, опубликованной в Cell Cycle исследователями из Института общей генетики им. Вавилова Российской академии наук, Института физико-химической медицины и Московского физико-технического института, говорится о том же: индуцированные стволовые клетки в главном неотличимы от своих эмбриональных «коллег».
В ходе эксперимента из эмбриональных стволовых клеток получали три вида специализированных – то были фибробласты, нервные клетки и пигментные эпителиальные клетки глазной сетчатки.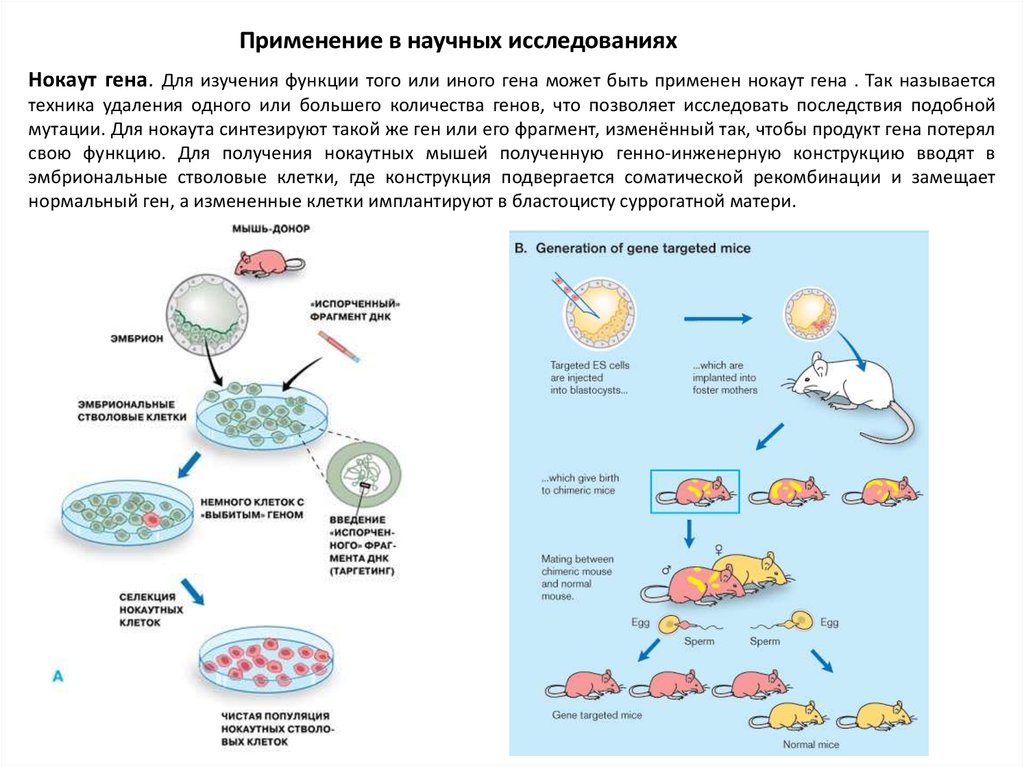 Потом их перепрограммировали обратно в стволовые и сравнивали их молекулярный портрет с портретом исходных эмбриональных. Генетически они все были идентичны, так что отличия могли проявиться только в активности генов, которую можно было оценить по транскриптому – совокупности РНК в клетке. (Грубо говоря, на ДНК активного гена синтезируется больше РНК, на ДНК малоактивного гена – меньше.)
Потом их перепрограммировали обратно в стволовые и сравнивали их молекулярный портрет с портретом исходных эмбриональных. Генетически они все были идентичны, так что отличия могли проявиться только в активности генов, которую можно было оценить по транскриптому – совокупности РНК в клетке. (Грубо говоря, на ДНК активного гена синтезируется больше РНК, на ДНК малоактивного гена – меньше.)
Кроме того, авторы работы оценивали характер метилирования ДНК. Мы знаем, что метильные группы влияют на генетическую активность, и в зависимости от характера метилирования одни гены будут работать, а другие – нет. Именно этот механизм играет большую роль в специализации клеток, когда, например, в нейроне нужно оставить в рабочем состоянии только «нервные» гены и выключить те, которые нужны всем прочим клеткам – мышечным, печёночным, кожным и т. д.
По словам исследователей, индуцированные стволовые клетки по существенным признакам не отличались от эмбриональных, и ни конкретный вид специализированной клетки (будь то фибробласт, нейрон или клетка сетчатки), ни сама процедура «возвращения в детство» тут никакой роли не играли. Те отличия, которые всё-таки имелись, были не слишком велики и возникли из-за случайных факторов. Конечно, число таких различий может варьировать раз от разу, однако, если у нас на руках будет пять клонов индуцированных стволовых клеток – полученных, например, из эпителия – то среди них обязательно будет один, на 95% похожий на эмбрионального «предка». То есть из пяти специализированных клеток одна даст почти идеальную индуцированную стволовую – если за идеал брать натуральную эмбриональную линию.
Те отличия, которые всё-таки имелись, были не слишком велики и возникли из-за случайных факторов. Конечно, число таких различий может варьировать раз от разу, однако, если у нас на руках будет пять клонов индуцированных стволовых клеток – полученных, например, из эпителия – то среди них обязательно будет один, на 95% похожий на эмбрионального «предка». То есть из пяти специализированных клеток одна даст почти идеальную индуцированную стволовую – если за идеал брать натуральную эмбриональную линию.
Словом, очевидно, что проблема несоответствия в генетической активности между естественными и искусственными стволовыми клетками в известной степени надуманна (хотя в некоторых обстоятельствах такие различия всё же могут иметь место).
Возможно, что подобные эксперименты помогут преодолеть недоверие к iPSC и поспобствуют тому, чтобы эти клетки стали рутинным медицинским инструментом. Кстати говоря, в качестве ещё одной оптимистичной статьи на ту же тему можно вспомнить недавнее сообщение в PLOS Genetics, в котором говорилось, что уровень мутаций в индуцированных стволовых клетках довольно мал – они накапливают мутации в 10 раз медленнее, чем зрелые, специализированные клетки, из которых их получали.
Эмбриональные стволовые клетки – стволовые клетки и будущее регенеративной медицины
E эмбриональные стволовые клетки (ЭСК) обнаруживаются во внутренней клеточной массе бластоцисты человека, ранней стадии развития эмбриона, начиная с 4 с по 7 день после оплодотворения. При нормальном эмбриональном развитии они исчезают после 7 дней и начинают формировать три слоя эмбриональной ткани. Однако ЭСК, выделенные из внутренней клеточной массы на стадии бластоцисты, можно культивировать в лаборатории, и при правильных условиях они будут размножаться бесконечно. ЭСК, растущие в этом недифференцированном состоянии, сохраняют способность дифференцироваться в клетки всех трех слоев эмбриональной ткани. Исследования с участием ЭСК человека находятся в центре этических дебатов об использовании и потенциале стволовых клеток в регенеративной медицине. Эмбрионы, из которых выделяют ЭСК, при этом разрушаются.
Несколько научных вопросов важны при рассмотрении потенциала стволовых клеток для использования в регенеративной медицине, а также возникающих политических и этических вопросов:
Какие свойства ЭСК перспективны для регенеративной медицины?
Какие прямые доказательства подтверждают эффективность использования ЭСК в регенеративной медицине?
Какие препятствия и риски связаны с использованием ЭСК в регенеративной медицине?
СВОЙСТВА ЭСК, ВАЖНЫЕ ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ
ЭСК человека впервые были успешно выращены в лаборатории в 1998 г. (Thompson et al., 1998). В соответствующих условиях культивирования ЭСК продемонстрировали замечательную способность к непрерывному самообновлению, т. е. к продукции большего количества мультипотентных клеток, подобных им самим. Как было указано на семинаре Томасом Окармой и Роном Маккеем, было продемонстрировано, что линии ЭСК, созданные из одиночных клеток, размножаются в течение 300-400 циклов удвоения популяции. ЭСК человека, которые размножались более 2 лет, также демонстрируют стабильный и нормальный набор хромосом, в отличие от нестабильного и аномального набора клеточных линий эмбрионального рака, которые использовались в прошлом для изучения ранних стадий эмбрионального развития. Тщательный мониторинг стареющих линий ЭСК будет необходим для оценки значимости генетических изменений, которые, как ожидается, произойдут с течением времени.
(Thompson et al., 1998). В соответствующих условиях культивирования ЭСК продемонстрировали замечательную способность к непрерывному самообновлению, т. е. к продукции большего количества мультипотентных клеток, подобных им самим. Как было указано на семинаре Томасом Окармой и Роном Маккеем, было продемонстрировано, что линии ЭСК, созданные из одиночных клеток, размножаются в течение 300-400 циклов удвоения популяции. ЭСК человека, которые размножались более 2 лет, также демонстрируют стабильный и нормальный набор хромосом, в отличие от нестабильного и аномального набора клеточных линий эмбрионального рака, которые использовались в прошлом для изучения ранних стадий эмбрионального развития. Тщательный мониторинг стареющих линий ЭСК будет необходим для оценки значимости генетических изменений, которые, как ожидается, произойдут с течением времени.
Поскольку ЭСК человека только недавно стали доступны для исследований, большая часть того, что известно об ЭСК, получено в результате исследований на мышах, которые, как отмечалось в главе 2, нельзя считать окончательными доказательствами возможностей клеток человека.
Тем не менее, ЭСК, полученные из мышиных бластоцист, изучались в течение 2 десятилетий и обеспечили критическую основу знаний о биологии и культивировании этих клеток (Torres, 1998; Wobus and Boheler, 1999). Активно исследуются факторы, которые позволяют мышиным ESC продолжать репликацию в лаборатории без дифференцировки, и методы запуска дифференцировки в различные типы клеток, которые проявляют нормальную функцию. К типам клеток, полученных из культивируемых ЭСК мыши, относятся жировые клетки, различные клетки головного мозга и нервной системы, инсулинпродуцирующие клетки поджелудочной железы, костные клетки, гемопоэтические клетки, клетки желточного мешка, эндотелиальные клетки, примитивные энтодермальные клетки, клетки гладкой и поперечно-полосатой мускулатуры. клетки, в том числе кардиомиоциты – клетки сердечной мышцы (Odorico et al., 2001).
Опыт работы с ЭСК мыши дал ключ к разгадке методов культивирования ЭСК человека и их дифференцировки. ЭСК мыши будут пролиферировать в недифференцированном состоянии в присутствии биохимического вещества, называемого ингибирующим лейкемию фактором (LIF), но условия культивирования, необходимые для предотвращения дифференцировки ЭСК человека, включают их выращивание в чашках Петри на слое мышиных эмбриональных фибробластов (называемых «фидерные клетки») в среде, содержащей сыворотку крови коров. Питающие клетки инактивированы, поэтому они не делятся и не расширяются, но продуцируют факторы роста, поддерживающие ЭСК. Механизм того, как фидерные клетки поддерживают пролиферацию недифференцированных ЭСК, неизвестен. Такое культивирование in vitro представляет определенные теоретические опасности для использования стволовых клеток в регенеративной медицине, такие как распространение вирусов и других инфекционных агентов, обычно не встречающихся у людей. При извлечении из фидерных клеток и выращивании в суспензии (в жидкости) ЭСК человека образуют агрегированные шарики клеток, называемые «эмбриональными тельцами», которые, как сообщается, дают множество типов клеток, представляющих все три уровня развития эмбриональной ткани (Ицковиц). -Элдор и др., 2000; Рубинофф и др., 2000; Шульдинер и др., 2000). Доказательства дифференцировки в культуре включают обнаружение продуктов генов, связанных с разными типами клеток, а в некоторых случаях и по характерным формам, свойственным разным типам клеток.
Питающие клетки инактивированы, поэтому они не делятся и не расширяются, но продуцируют факторы роста, поддерживающие ЭСК. Механизм того, как фидерные клетки поддерживают пролиферацию недифференцированных ЭСК, неизвестен. Такое культивирование in vitro представляет определенные теоретические опасности для использования стволовых клеток в регенеративной медицине, такие как распространение вирусов и других инфекционных агентов, обычно не встречающихся у людей. При извлечении из фидерных клеток и выращивании в суспензии (в жидкости) ЭСК человека образуют агрегированные шарики клеток, называемые «эмбриональными тельцами», которые, как сообщается, дают множество типов клеток, представляющих все три уровня развития эмбриональной ткани (Ицковиц). -Элдор и др., 2000; Рубинофф и др., 2000; Шульдинер и др., 2000). Доказательства дифференцировки в культуре включают обнаружение продуктов генов, связанных с разными типами клеток, а в некоторых случаях и по характерным формам, свойственным разным типам клеток. Клетки, полученные из эмбриональных тел человека, включают «ритмически сокращающиеся кардиомиоциты, пигментированные и непигментированные эпителиальные клетки и нервные клетки, демонстрирующие обильный рост аксонов и дендритов» (Odorico et al., 2001). В других экспериментах сообщалось, что клетки, происходящие из ЭСК человека, экспрессируют гены, связанные с функцией печени и поджелудочной железы (Schuldiner et al., 2000). Сообщалось, что ЭСК человека, выращенные в сокультуре со стромальными клетками костного мозга мыши, продуцируют колонии гемопоэтических предшественников человека и, в конечном счете, клетки крови (Kaufman et al., 19).99).
Клетки, полученные из эмбриональных тел человека, включают «ритмически сокращающиеся кардиомиоциты, пигментированные и непигментированные эпителиальные клетки и нервные клетки, демонстрирующие обильный рост аксонов и дендритов» (Odorico et al., 2001). В других экспериментах сообщалось, что клетки, происходящие из ЭСК человека, экспрессируют гены, связанные с функцией печени и поджелудочной железы (Schuldiner et al., 2000). Сообщалось, что ЭСК человека, выращенные в сокультуре со стромальными клетками костного мозга мыши, продуцируют колонии гемопоэтических предшественников человека и, в конечном счете, клетки крови (Kaufman et al., 19).99).
Дополнительные доказательства мультипотентной способности ЭСК человека основаны на исследованиях в условиях in vivo. ЭСК человека, введенные мышам, образуют тип доброкачественной опухоли, называемой тератомой, которая состоит из тканей всех трех эмбриональных слоев. Ткани, которые возникают в опухоли, часто развиты, организованы и сложны и включают зубы, кишечник, волосяные фолликулы, кожу, эпителий, мышцы, кости, хрящи, легочную ткань и нервные клетки (Thompson et al. , 1998). Эксперименты показали способность ЭСК производить различные ткани, но результаты также подчеркивают сложность биологической «программы» развития тканей, которая может разворачиваться в различных биологических средах. Эти результаты также подчеркивают аномальный, потенциально неопластический потенциал ЭСК при помещении в неестественную среду.
, 1998). Эксперименты показали способность ЭСК производить различные ткани, но результаты также подчеркивают сложность биологической «программы» развития тканей, которая может разворачиваться в различных биологических средах. Эти результаты также подчеркивают аномальный, потенциально неопластический потенциал ЭСК при помещении в неестественную среду.
Остаются открытыми основные вопросы о генетических факторах или факторах окружающей среды в организме, которые контролируют судьбу ЭСК, и о важности различных факторов на различных стадиях клеточной дифференцировки. Однако даже на основании ограниченных данных возможность выращивать ЭСК человека in vitro и дифференцировать их в лаборатории делает их важным и уникальным инструментом для проведения фундаментальных исследований, имеющих решающее значение для основы будущих регенеративных технологий. терапии. Например, удалось создать линию мышиных ЭСК, которые генерируют предшественники нервных клеток (Li et al., 19).98). Исследования включения и выключения генов по мере того, как клетки начинают дифференцироваться, которые уже проводятся с ЭСК, позволят лучше понять генетический контроль, важный для дифференцировки тканей (Duncan et al. , 1998). Исследования ЭСК in vitro также дают возможность изучить роль биохимических веществ, продуцируемых в нормальной клеточной среде, которые индуцируют дифференцировку стволовых клеток, миграцию в места, требующие репарации, и ассимиляцию в тканях (Schuldiner et al., 2000).
, 1998). Исследования ЭСК in vitro также дают возможность изучить роль биохимических веществ, продуцируемых в нормальной клеточной среде, которые индуцируют дифференцировку стволовых клеток, миграцию в места, требующие репарации, и ассимиляцию в тканях (Schuldiner et al., 2000).
ДОКАЗАТЕЛЬСТВА, ПОДТВЕРЖДАЮЩИЕ ПОТЕНЦИАЛ ЭСКС ДЛЯ ИСПОЛЬЗОВАНИЯ В РЕГЕНЕРАТИВНОЙ МЕДИЦИНЕ
На семинаре Джеймс Томсон и Томас Окарма предположили, что когда-нибудь человеческие ЭСК станут потенциально неограниченным источником клеток, дифференцированных in vitro , для трансплантационной терапии, затрагивающей печень , нервной системы и поджелудочной железы. Ирвинг Вайсман упомянул о возможном использовании ЭСК для повышения эффективности трансплантации целых органов. Если бы ГСК, полученные из ЭСК человека, можно было бы успешно трансплантировать в систему крови реципиента трансплантата (с помощью иммунодепрессантов), любая дополнительная ткань имплантата (скажем, почка или поджелудочная железа), полученная с использованием тех же ЭСК, теоретически не была бы отторгнута организмом. реципиента, потому что иммунные клетки, продуцируемые в крови реципиента ГСК, будут воспринимать ткань имплантата как «свою».
реципиента, потому что иммунные клетки, продуцируемые в крови реципиента ГСК, будут воспринимать ткань имплантата как «свою».
Но до этого еще далеко, как заметил Маркус Громпе, поскольку еще никто не продемонстрировал восстановление функции органа in vivo ни у людей, ни у экспериментальных животных клетками, полученными из ЭСК человека. Более того, ЭСК в тканевой культуре дают смесь всех типов клеток одновременно, и биохимические, тканевые и молекулярно-биологические методы контроля и ограничения дифференцировки требуют дальнейшего изучения.
Поскольку ЭСК человека стали доступны для исследований только недавно, а государственное финансирование таких исследований было ограниченным, исследования того, насколько хорошо ЭСК или их дифференцированные ткани выполняют физиологические функции, в основном проводились на моделях мышей. Рон Маккей описал прогресс, достигнутый в стимуляции дифференцировки ЭСК человека in vitro в клетки, продуцирующие инсулин, которые могут быть полезны при лечении диабета, но он также отметил, что уже были проведены исследования с аналогичными клетками мыши, трансплантированными мышам, страдающим диабетом, и что частичное наблюдалось восстановление регуляции инсулина (Lumelsky et al. , 2001). Другие исследования показали, что ЭСК мыши можно успешно трансплантировать грызунам с симптомами болезни Паркинсона и частично облегчить эти симптомы (Studer et al., 19).98). Сходным образом исследования предполагают, что ЭСК мышей можно трансплантировать животным с повреждениями спинного мозга и частично восстановить нервную функцию (McDonald et al., 1999).
, 2001). Другие исследования показали, что ЭСК мыши можно успешно трансплантировать грызунам с симптомами болезни Паркинсона и частично облегчить эти симптомы (Studer et al., 19).98). Сходным образом исследования предполагают, что ЭСК мышей можно трансплантировать животным с повреждениями спинного мозга и частично восстановить нервную функцию (McDonald et al., 1999).
Эти исследования обещают, но не являются окончательными доказательствами того, что аналогичные методы лечения могут быть эффективными для людей. Человеческие ЭСК необходимо будет протестировать на моделях приматов, таких как модели болезни Паркинсона и сахарного диабета у макак-резусов. Необходимо разработать методы трансплантации ЭСК, а также способы установления того, правильно ли развиваются и функционируют клетки после трансплантации. В некоторых случаях будет важно убедиться, что трансплантированные клетки или ткани включены и правильно расположены относительно существующих тканей, например, в сердце и нервной ткани; трехмерные межклеточные взаимодействия будут играть важную роль в функционировании органа. Другие клетки, такие как островковые клетки поджелудочной железы или гемопоэтические клетки, потребуют менее сложного включения.
Другие клетки, такие как островковые клетки поджелудочной железы или гемопоэтические клетки, потребуют менее сложного включения.
Кроме того, крупномасштабное размножение ЭСК человека в культуре потребует, чтобы их можно было выращивать без фидерных клеток (Odorico et al., 2001). Необходимы исследования, чтобы выяснить механизмы подавления дифференцировки фидерными клетками и найти им альтернативы, в то же время исключив возможность переноса вируса животных из фидерных клеток в ЭСК.
Наконец, ранее было отмечено, что хромосомы ЭСК человека оказались стабильными в культуре тканей. Однако это не означает, что линии ЭСК не будут подвержены случайным мутациям, которые затрагивают все клеточные линии по мере их старения. В клетках человека и других животных при каждом делении клетки происходит примерно одна мутация. Таким образом, можно ожидать, что клетка, которая делилась 200 раз в культуре, содержит около 200 различных мутаций (Kunkel and Bebeneck, 2000). До сих пор не было опубликовано исследований об изменениях, которые могли произойти в существующих линиях стволовых клеток. Тщательный мониторинг целостности существующих клеточных линий необходим для понимания влияния долгосрочного культивирования, и в будущем может потребоваться разработка новых линий стволовых клеток.
Тщательный мониторинг целостности существующих клеточных линий необходим для понимания влияния долгосрочного культивирования, и в будущем может потребоваться разработка новых линий стволовых клеток.
Препятствия и риски, связанные с использованием ЭСК
В дополнение к демонстрации функциональной эффективности трансплантатов ЭСК необходимо выявить и свести к минимуму или устранить риски, которые могут представлять ЭСК. Двумя идентифицируемыми рисками являются образование опухоли и иммунное отторжение. Как отмечалось ранее, ЭСК человека, введенные мышам, могут вызывать доброкачественную опухоль, состоящую из различных тканей; считается, что этот ответ связан с мультипотентностью недифференцированных клеток в среде in vivo. Однако, в небольшом количестве краткосрочных исследований на мышах, ЭСК человека, которым позволили начать процесс дифференцировки перед трансплантацией, не привели к значительному образованию опухоли (Odorico et al., 2001). Очевидно, что это критическая проблема для понимания и контроля.
Поэтому пока рано говорить о целесообразности использования человеческих ЭСК непосредственно в регенеративной медицине. Очевидно, необходимо выяснить, как организм контролирует дифференцировку стволовых клеток, и это еще предстоит достоверно воспроизвести in vitro. Кроме того, недостаточно изучено поведение ЭСК, имплантированных в конкретный орган. Когда-нибудь можно будет добавить факторы роста к трансплантату, чтобы стимулировать производство определенного типа клеток или нескольких типов клеток. «Ткани-индукторы», которые взаимодействуют со стволовыми клетками, могут быть котрансплантированы с ЭСК для достижения аналогичного результата. Эти возможности все еще находятся в стадии экспериментального исследования.
С другой стороны, возможные проблемы, связанные с трансплантацией ЭСК, являются общими для всех трансплантаций, например, риск инфицирования и риск отторжения ткани. Как обсуждалось в главе 2, отторжение является серьезным препятствием для успешной трансплантации стволовых клеток и полученных из них тканей. Было высказано предположение, что ЭСК вызывают меньшую иммунную реакцию, чем трансплантация целого органа, но неясно, будет ли это верно для регенерированных тканей, полученных из ЭСК. Некоторые типы клеток (такие как дендритные клетки, клетки иммунной системы и эндотелиальные клетки сосудов) несут больше антигенов гистосовместимости, вызывающих иммунные реакции, чем другие клетки. Эти типы присутствуют в тканях целых органов; они соединяют орган с кровотоком и нервной системой. Однако ткань, полученная in vitro из ЭСК, такая как ткань печени, не будет содержать таких клеток и, следовательно, теоретически вызовет более мягкий иммунный ответ; это предполагает, что будут доступны методы контроля дифференцировки ЭСК. Кроме того, клетки печени, вероятно, не будут лишены всех поверхностных антигенов, и, таким образом, при отсутствии других методов снижения отторжения трансплантата все равно придется использовать иммунодепрессанты с сопутствующими рисками инфекции и токсичности.
Было высказано предположение, что ЭСК вызывают меньшую иммунную реакцию, чем трансплантация целого органа, но неясно, будет ли это верно для регенерированных тканей, полученных из ЭСК. Некоторые типы клеток (такие как дендритные клетки, клетки иммунной системы и эндотелиальные клетки сосудов) несут больше антигенов гистосовместимости, вызывающих иммунные реакции, чем другие клетки. Эти типы присутствуют в тканях целых органов; они соединяют орган с кровотоком и нервной системой. Однако ткань, полученная in vitro из ЭСК, такая как ткань печени, не будет содержать таких клеток и, следовательно, теоретически вызовет более мягкий иммунный ответ; это предполагает, что будут доступны методы контроля дифференцировки ЭСК. Кроме того, клетки печени, вероятно, не будут лишены всех поверхностных антигенов, и, таким образом, при отсутствии других методов снижения отторжения трансплантата все равно придется использовать иммунодепрессанты с сопутствующими рисками инфекции и токсичности.
Хотя это трудно себе представить, создание очень большого количества линий ЭСК может быть одним из способов получения разнообразия клеток, что теоретически может увеличить шансы на совпадение антигенов гистосовместимости реципиента трансплантата. Также было высказано предположение, что ЭСК можно сделать менее реактивными, используя генную инженерию для устранения или введения на них присутствия поверхностных антигенов (Odorico, 2001). Точное генетическое совпадение между реципиентом трансплантата и тканью, полученной из ЭСК, также теоретически может быть достигнуто с помощью переноса ядер соматических клеток для создания гистосовместимых ЭСК (14). Клетки, созданные с помощью этой техники, преодолеют проблему иммунного отторжения. Однако трансплантировать такие клетки человеку с генетически обусловленным заболеванием может быть нецелесообразно, поскольку клетки будут нести одинаковую генетическую информацию. В любом случае, понимание того, как предотвратить отторжение трансплантированных клеток, имеет основополагающее значение для того, чтобы они стали полезными для регенеративной медицины, и представляет собой одну из самых больших проблем для исследований в этой области.
Также было высказано предположение, что ЭСК можно сделать менее реактивными, используя генную инженерию для устранения или введения на них присутствия поверхностных антигенов (Odorico, 2001). Точное генетическое совпадение между реципиентом трансплантата и тканью, полученной из ЭСК, также теоретически может быть достигнуто с помощью переноса ядер соматических клеток для создания гистосовместимых ЭСК (14). Клетки, созданные с помощью этой техники, преодолеют проблему иммунного отторжения. Однако трансплантировать такие клетки человеку с генетически обусловленным заболеванием может быть нецелесообразно, поскольку клетки будут нести одинаковую генетическую информацию. В любом случае, понимание того, как предотвратить отторжение трансплантированных клеток, имеет основополагающее значение для того, чтобы они стали полезными для регенеративной медицины, и представляет собой одну из самых больших проблем для исследований в этой области.
РИСУНОК 4
Перенос ядер соматических клеток (SCNT)
Что такое эмбриональные стволовые клетки и как они могут нам помочь? · Frontiers for Young Minds
Abstract
Все живые существа, включая человека, состоят из клеток. Каждая ткань и орган тела содержат клетки, которые специализируются на выполнении определенных функций: печень содержит клетки печени, мозг содержит нейроны, глаза содержат светочувствительные клетки и так далее. Но вся человеческая жизнь начинается со встречи двух клеток: сперматозоида отца и яйцеклетки матери. Оплодотворение происходит, когда сперматозоид встречается с яйцеклеткой. Оплодотворенная яйцеклетка делится на две клетки. Затем каждая клетка делится на две дополнительные клетки и так далее, пока через несколько дней клеточного деления не разовьется крошечный эмбрион. На ранних стадиях микроскопический эмбрион состоит из клеток, которые могут развиться во все типы клеток. Ученым удалось вырастить эти эмбриональные клетки в лаборатории и назвать их эмбриональными стволовыми клетками (ЭСК). В то время как ЭСК предлагают многообещающие и захватывающие возможности, такие как возможность выращивания органов в лаборатории, производство ЭСК требует человеческих эмбрионов, что связано со многими техническими и этическими проблемами.
Каждая ткань и орган тела содержат клетки, которые специализируются на выполнении определенных функций: печень содержит клетки печени, мозг содержит нейроны, глаза содержат светочувствительные клетки и так далее. Но вся человеческая жизнь начинается со встречи двух клеток: сперматозоида отца и яйцеклетки матери. Оплодотворение происходит, когда сперматозоид встречается с яйцеклеткой. Оплодотворенная яйцеклетка делится на две клетки. Затем каждая клетка делится на две дополнительные клетки и так далее, пока через несколько дней клеточного деления не разовьется крошечный эмбрион. На ранних стадиях микроскопический эмбрион состоит из клеток, которые могут развиться во все типы клеток. Ученым удалось вырастить эти эмбриональные клетки в лаборатории и назвать их эмбриональными стволовыми клетками (ЭСК). В то время как ЭСК предлагают многообещающие и захватывающие возможности, такие как возможность выращивания органов в лаборатории, производство ЭСК требует человеческих эмбрионов, что связано со многими техническими и этическими проблемами.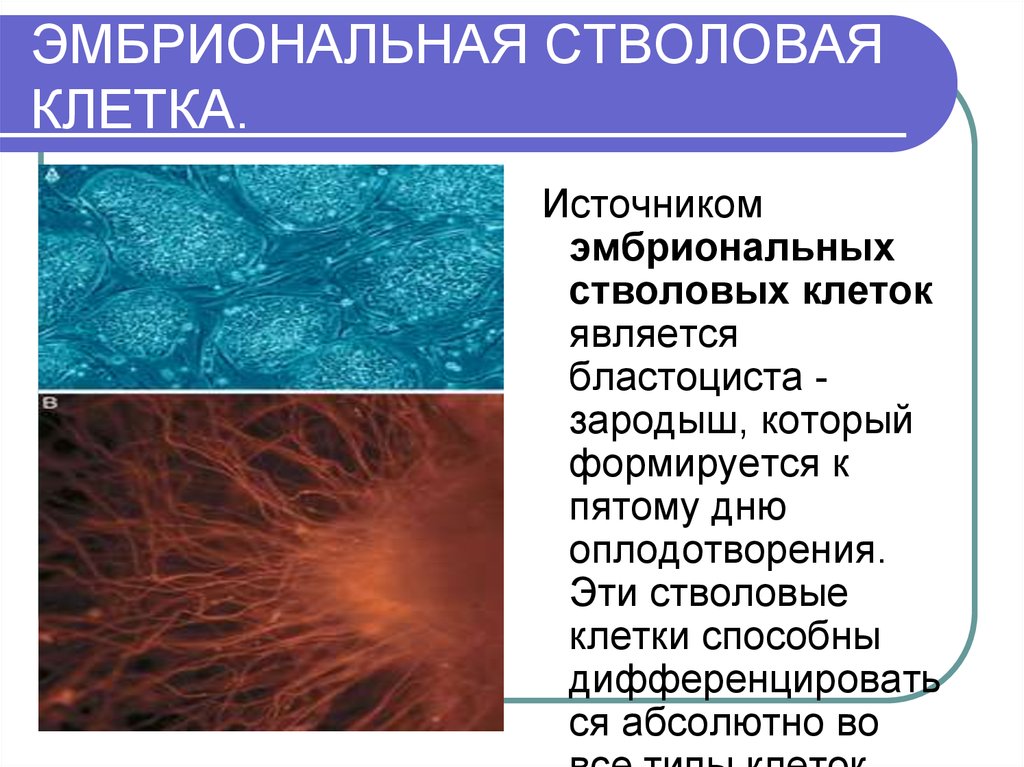 В 2007 году исследователи нашли способ производить человеческие клетки со способностями ЭСК путем перепрограммирования обычных клеток, чтобы они стали стволовыми клетками. Сегодня ученые могут превратить почти любой тип клеток практически в любой другой тип клеток!
В 2007 году исследователи нашли способ производить человеческие клетки со способностями ЭСК путем перепрограммирования обычных клеток, чтобы они стали стволовыми клетками. Сегодня ученые могут превратить почти любой тип клеток практически в любой другой тип клеток!
Все начинается с оплодотворения, когда сперматозоид встречается с яйцеклеткой
Эмбриональное развитие начинается с момента  Примерно через неделю после оплодотворения развивающийся эмбрион выглядит как полый шар клеток, который позже станет плацентой, и внутреннее скопление клеток, которое станет самим эмбрионом (рис. 1). Поскольку это небольшое количество клеток станет полноценным ребенком, эти ранние клетки должны обладать способностью становиться каждой клеткой тела, например, клетками кожи, мышечными клетками, клетками печени или клетками мозга. Из-за этой способности эти клетки называются плюрипотентный («плюри» = много; «потенциальный» = способность). Примерно через неделю после оплодотворения эмбриональные клетки постепенно теряют свою плюрипотентность и постепенно превращаются в различные ткани и органы. Итак, существует относительно узкое окно, в течение которого у эмбриона существуют плюрипотентные ЭСК.
Примерно через неделю после оплодотворения развивающийся эмбрион выглядит как полый шар клеток, который позже станет плацентой, и внутреннее скопление клеток, которое станет самим эмбрионом (рис. 1). Поскольку это небольшое количество клеток станет полноценным ребенком, эти ранние клетки должны обладать способностью становиться каждой клеткой тела, например, клетками кожи, мышечными клетками, клетками печени или клетками мозга. Из-за этой способности эти клетки называются плюрипотентный («плюри» = много; «потенциальный» = способность). Примерно через неделю после оплодотворения эмбриональные клетки постепенно теряют свою плюрипотентность и постепенно превращаются в различные ткани и органы. Итак, существует относительно узкое окно, в течение которого у эмбриона существуют плюрипотентные ЭСК.
- Рисунок 1 – Раннее эмбриональное развитие и плюрипотентные клетки.
- Слева вы видите яйцеклетку и сперматозоид до оплодотворения. Как только они встречаются, яйцеклетка оплодотворяется и начинает развиваться.
 Примерно через 1 неделю после оплодотворения в результате деления клеток был создан крошечный эмбрион, содержащий внешние клетки, которые станут плацентой (серо-голубые), и внутренние клетки, которые станут эмбрионом (желтые). Если оплодотворение происходит вне тела (
Примерно через 1 неделю после оплодотворения в результате деления клеток был создан крошечный эмбрион, содержащий внешние клетки, которые станут плацентой (серо-голубые), и внутренние клетки, которые станут эмбрионом (желтые). Если оплодотворение происходит вне тела (
В 1998 году ученым из США и Израиля впервые удалось вырастить плюрипотентные клетки из человеческих эмбрионов в лаборатории. Они работали с эмбрионами, которые были созданы путем экстракорпорального оплодотворения (ЭКО) , который позволяет парам, испытывающим трудности с зачатием, иметь детей. В конце процесса ЭКО у врачей обычно остается много недельных эмбрионов, которые больше не нужны. Эти крошечные эмбрионы можно использовать для исследований, и ученые использовали их, чтобы выяснить, как выращивать плюрипотентные клетки в лаборатории (рис.
- Рис. 2. Микроскопическое изображение ЭСК человека.
- ЭСК растут в виде скопления клеток, что видно в середине рисунка. Вокруг этого скопления находятся более темные клетки, поддерживающие рост ЭСК, которые называются опорными клетками.
В отличие от клеток самого эмбриона, ЭСК, выращенные в лаборатории, могут оставаться в своем плюрипотентном состоянии, если присутствуют правильные условия роста. Эти клетки делятся примерно раз в день, поэтому со временем ученые могут вырастить миллионы или миллиарды ЭСК. Если условия роста ЭСК изменены соответствующим образом, ученые могут стимулировать ЭСК к прохождению процесса, называемого 9.0083 дифференцировка , при которой ЭСК могут развиваться в любой из различных типов клеток, присутствующих в организме! Ученые работали над этим удивительным проектом более 20 лет!
Производство ЭСК из эмбрионов человека технически сложно и этически сложно. Поэтому было предпринято много усилий для получения плюрипотентных стволовых клеток из других клеток, чтобы избежать использования реальных эмбрионов. Идея состоит в том, чтобы перепрограммировать зрелые клетки, чтобы превратить их обратно в стволовые клетки.
Поэтому было предпринято много усилий для получения плюрипотентных стволовых клеток из других клеток, чтобы избежать использования реальных эмбрионов. Идея состоит в том, чтобы перепрограммировать зрелые клетки, чтобы превратить их обратно в стволовые клетки.
Клонирование
Первые попытки превратить зрелые клетки обратно в плюрипотентные стволовые клетки включали процесс, называемый клонированием . В процессе клонирования яйцеклетка оплодотворяется в лаборатории, и сразу после оплодотворения из нее удаляется ДНК. Затем в пустую яйцеклетку вводят ДНК из другой зрелой клетки, например клетки кожи или крови. Несмотря на то, что ДНК взята из зрелой клетки, окружающая среда яйца в основном перепрограммирует генетический материал из зрелой клетки, чтобы она могла создать эмбрион. Если яйцеклетка продолжит развиваться, она превратится в клон человека или животного, из которого была взята зрелая клетка. Клонирование человека запрещено, но в начале 1960-х английские исследователи успешно клонировали лягушек.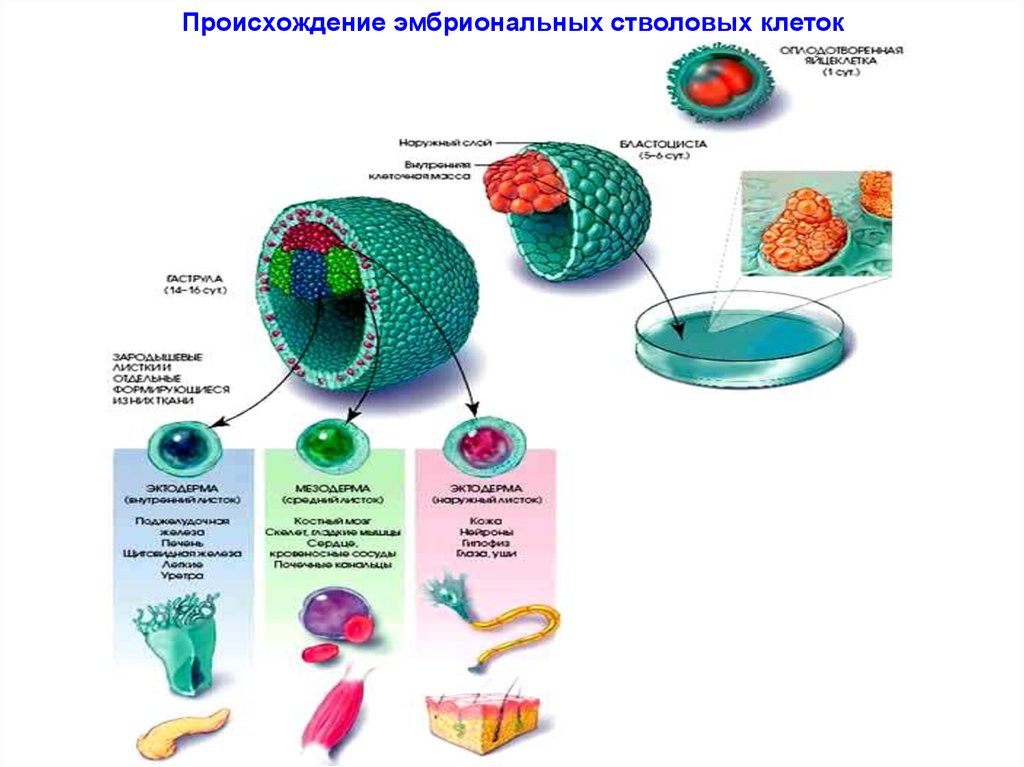 У лягушек относительно очень большие яйца, поэтому с ними легко работать. Исследователи взяли оплодотворенную яйцеклетку лягушки, удалили ДНК и ввели в яйцеклетку генетический материал из кишечной клетки другой лягушки. Примерно через 40 дней яйцо созрело и превратилось в головастика. Головастик был генетически идентичен лягушке, у которой была взята кишечная клетка. Вскоре некоторые лаборатории начали проводить этот процесс на млекопитающих, но первые попытки этого процесса потерпели неудачу. После 30 лет неудачных попыток в 1996, исследователи из Шотландии успешно клонировали овцу по кличке Долли (рис. 3А), доказав, что клонирование возможно и у млекопитающих. С конца 1990-х годов были успешно клонированы самые разные животные, в том числе мыши, кролики, коровы, свиньи, лошади, ослы, верблюды и даже исчезающие виды волков. Знаменитая певица Барбара Стрейзанд, которая очень огорчилась, когда ее собака умерла, заплатила исследователям большую сумму денег за клонирование двух щенков, идентичных оригинальной собаке! В 2018 г.
У лягушек относительно очень большие яйца, поэтому с ними легко работать. Исследователи взяли оплодотворенную яйцеклетку лягушки, удалили ДНК и ввели в яйцеклетку генетический материал из кишечной клетки другой лягушки. Примерно через 40 дней яйцо созрело и превратилось в головастика. Головастик был генетически идентичен лягушке, у которой была взята кишечная клетка. Вскоре некоторые лаборатории начали проводить этот процесс на млекопитающих, но первые попытки этого процесса потерпели неудачу. После 30 лет неудачных попыток в 1996, исследователи из Шотландии успешно клонировали овцу по кличке Долли (рис. 3А), доказав, что клонирование возможно и у млекопитающих. С конца 1990-х годов были успешно клонированы самые разные животные, в том числе мыши, кролики, коровы, свиньи, лошади, ослы, верблюды и даже исчезающие виды волков. Знаменитая певица Барбара Стрейзанд, которая очень огорчилась, когда ее собака умерла, заплатила исследователям большую сумму денег за клонирование двух щенков, идентичных оригинальной собаке! В 2018 г. впервые были успешно клонированы макаки (рис. 3B), а в 2019 г., китайская полиция объявила о клонировании полицейской собаки, которая с тех пор начала проходить курс дрессировки.
впервые были успешно клонированы макаки (рис. 3B), а в 2019 г., китайская полиция объявила о клонировании полицейской собаки, которая с тех пор начала проходить курс дрессировки.
- Рисунок 3 — (A) Успешное клонирование млекопитающих.
- Овечка Долли, первое успешно клонированное млекопитающее, была клонирована в Шотландии в 1996 году. Долли показана со своим первым потомством, Бонни (слева). (B) Первые клонированные обезьяны Хуа Хуа и Чжун Чжун были успешно клонированы в Китае в 2018 году.
Терапевтическое клонирование
Как мы уже упоминали, клонирование человека является незаконным, но разрешена процедура, называемая терапевтическим клонированием, то есть клонирование в медицинских целях. Та же самая процедура, описанная выше для лягушек, выполняется с оплодотворенными человеческими яйцами, которые опорожняют и вводят генетический материал из другой клетки, обычно клетки кожи или крови. Примерно через неделю плюрипотентные клетки удаляют и используют для выращивания ЭСК. Эти ЭСК содержат ДНК человека, у которого были взяты клетки кожи или крови. Таким образом, можно изготовить ЭСК из любого живого человека! Это означает, что в будущем, когда мы узнаем, как производить ткани, такие как ткань печени, из ЭСК, можно будет выращивать новые органы для трансплантации. Большим преимуществом использования генетически идентичных клеток для трансплантации является то, что иммунная система не воспринимает пересаженный орган как чужеродный и, следовательно, не будет атаковать его так же, как она атаковала бы орган генетически другого человека. Это предотвращает многие проблемы и осложнения.
Эти ЭСК содержат ДНК человека, у которого были взяты клетки кожи или крови. Таким образом, можно изготовить ЭСК из любого живого человека! Это означает, что в будущем, когда мы узнаем, как производить ткани, такие как ткань печени, из ЭСК, можно будет выращивать новые органы для трансплантации. Большим преимуществом использования генетически идентичных клеток для трансплантации является то, что иммунная система не воспринимает пересаженный орган как чужеродный и, следовательно, не будет атаковать его так же, как она атаковала бы орган генетически другого человека. Это предотвращает многие проблемы и осложнения.
Перепрограммирование
Терапевтическое клонирование может показаться замечательным, но эта процедура очень проблематична и сложна. Кроме того, для этого нужно использовать яйца, которые очень трудно достать. Но в 2007 году японские исследователи нашли удивительный способ трансформировать зрелые клетки, такие как клетки кожи или крови, непосредственно в стволовые клетки без использования яйцеклеток! Они обнаружили комбинацию белков, которые при введении в зрелые клетки постепенно перепрограммировали зрелые клетки в стволовые.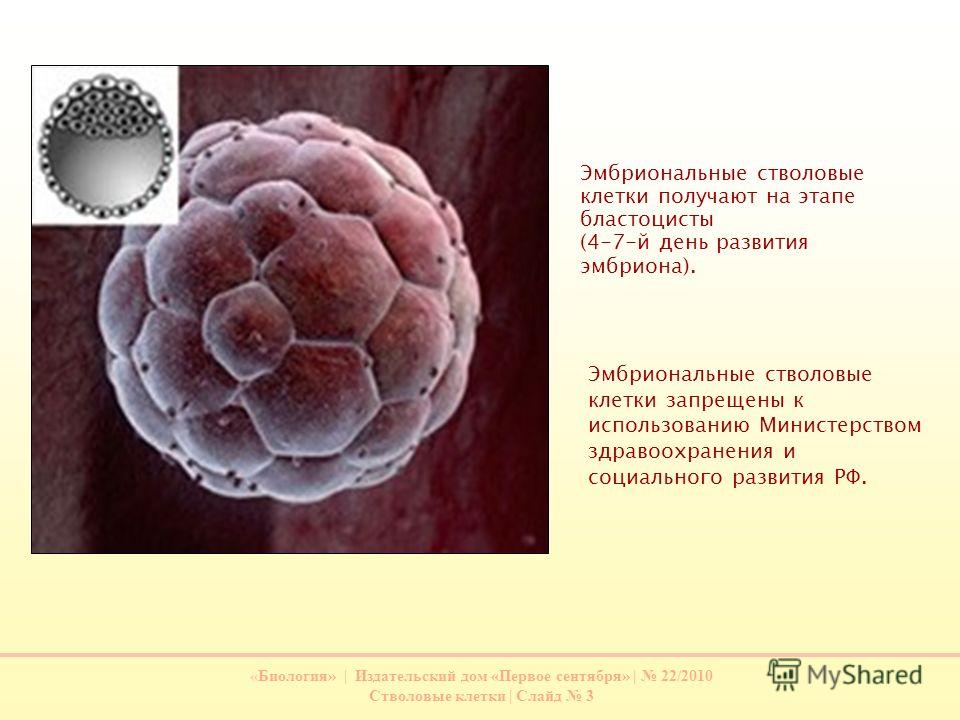 Эта процедура намного проще, чем клонирование, и любая лаборатория может довольно легко производить стволовые клетки практически из любого типа клеток. Этот процесс называется перепрограммируют , и полученные клетки называются индуцированными плюрипотентными стволовыми клетками (ИПСК).
Эта процедура намного проще, чем клонирование, и любая лаборатория может довольно легко производить стволовые клетки практически из любого типа клеток. Этот процесс называется перепрограммируют , и полученные клетки называются индуцированными плюрипотентными стволовыми клетками (ИПСК).
Терапия?
Надежда состоит в том, чтобы иметь возможность использовать оба типа стволовых клеток, как эмбриональные, так и индуцированные, для лечения заболеваний, вызванных гибелью клеток в организме. Например, при диабете 1 типа бета-клетки поджелудочной железы погибают. Бета-клетки отвечают за выработку гормона инсулина, который помогает тканям поглощать сахар из крови, чтобы обеспечить организм энергией. Дети, рожденные с диабетом 1 типа, в конечном итоге теряют все свои бета-клетки и перестают вырабатывать инсулин. Так как без инсулина жить невозможно, эти дети должны получать инъекции инсулина каждый день. Несколько исследовательских групп пытаются превратить ЭСК в бета-клетки, которые можно трансплантировать больным диабетом, чтобы пациенты снова могли вырабатывать инсулин. Это большая мечта, потому что на сегодняшний день не существует успешного лечения, основанного на пересадке клеток, выращенных из стволовых клеток, хотя в настоящее время проводятся эксперименты на людях. В одном из таких экспериментов нейроны, полученные из ЭСК, пересаживают в мозг пациентов с болезнью Паркинсона, при которой гибнут определенные клетки мозга. Во втором эксперименте клетки сетчатки пересаживают пациентам, страдающим слепотой, вызванной заболеванием, которое приводит к потере клеток глаза.
Это большая мечта, потому что на сегодняшний день не существует успешного лечения, основанного на пересадке клеток, выращенных из стволовых клеток, хотя в настоящее время проводятся эксперименты на людях. В одном из таких экспериментов нейроны, полученные из ЭСК, пересаживают в мозг пациентов с болезнью Паркинсона, при которой гибнут определенные клетки мозга. Во втором эксперименте клетки сетчатки пересаживают пациентам, страдающим слепотой, вызванной заболеванием, которое приводит к потере клеток глаза.
Будем надеяться, что в ближайшие годы исследователи будут успешно производить все больше и больше типов клеток и даже органов из эмбриональных или индуцированных плюрипотентных стволовых клеток. Это приведет ко все более и более успешным испытаниям на людях, так что можно будет лечить и даже излечивать большое количество болезней, при которых погибают клетки тела или которые требуют замены органов.
Глоссарий
Оплодотворение : ↑ Встреча между сперматозоидом и яйцеклеткой. С момента оплодотворения начинается эмбриональное развитие. Яйцеклетка без сперматозоидов является неоплодотворенной яйцеклеткой.
С момента оплодотворения начинается эмбриональное развитие. Яйцеклетка без сперматозоидов является неоплодотворенной яйцеклеткой.
ДНК : ↑ Генетический материал, отвечающий за характеристики организмов. Например, определенный участок в ДНК отвечает за цвет глаз, другой — за цвет кожи и т. д.
Плюрипотентность : ↑ Особенность эмбриональных стволовых клеток, заключающаяся в способности каждый тип клеток. «Много» означает «много», а «мощный» означает «способность», поэтому плюрипотентный означает «очень способный».
In Vitro Оплодотворение (ЭКО) : ↑ Когда яйцеклетка встречается со сперматозоидом в лаборатории, вне тела.
Эмбриональные стволовые клетки (ЭСК) : ↑ Клетки, взятые у однонедельного эмбриона. Эти клетки имеют две особенности: они могут неограниченно делиться при определенных условиях и могут становиться клетками всех типов.
