Содержание
Респираторный дистресс-синдром как причина ранней неонатальной смерти (по данным Росстата за 2013-2017 гг.)
Резюме
Приведены результаты анализа данных Росстата за 2013-2017 гг. о ранней неонатальной смерти вследствие респираторного дистресс-синдрома (РДС). По данным Росстата, доля РДС среди всех случаев ранней неонатальной смерти составила 18,4%. Частота развития летальных исходов при РДС у новорожденных отличалась в различных федеральных округах Российской Федерации. Наиболее высокие значения удельной доли РДС в структуре причин ранней неонатальной смерти зарегистрированы в Дальневосточном и Уральском федеральных округах (27,1 и 24,5% соответственно). Доля РДС в структуре причин ранней неонатальной смерти у новорожденных сельской местности превышала аналогичный показатель в городской местности. Среди состояний, обусловивших гибель новорожденных от РДС, чаще других фигурировали гипертензивные заболевания беременной, а также преждевременное излитие околоплодных вод, преждевременная отслойка плаценты и плацентарная недостаточность. Основными путями снижения летальных исходов от РДС считаются его антенатальная профилактика и своевременная интенсивная респираторная терапия новорожденного.
Основными путями снижения летальных исходов от РДС считаются его антенатальная профилактика и своевременная интенсивная респираторная терапия новорожденного.
Ключевые слова:респираторный дистресс-синдром, болезнь гиалиновых мембран, ранняя неонатальная смертность, региональные особенности
Для цитирования: Туманова У.Н., Щеголев А.И., Шувалова М.П., Дегтярев Д.Н. Респираторный дистресс-синдром как причина ранней неонатальной смерти (по данным Росстата за 2013-2017 гг.) // Неонатология: новости, мнения, обучение. 2019. Т. 7. № 3. С. 20-26. doi: 10.24411/2308-2402-2019-13003
Респираторный дистресс-синдром (РДС) новорожденного характеризуется наличием клинических признаков дыхательной недостаточности, развивающихся, как правило, в первые 4-6 ч после рождения. Ведущими симптомами РДС новорожденного считаются тахипноэ, раздувание крыльев носа, «хрюкающее» дыхание и признаки втяжения между ребрами или нижней трети грудины. Основным морфологическим проявлением РДС является наличие гиалиновых мембран в альвеолах при микроскопическом изучении гистологических препаратов ткани легких. В этой связи РДС новорожденного обозначают также как болезнь гиалиновых мембран (БГМ) [1].
В этой связи РДС новорожденного обозначают также как болезнь гиалиновых мембран (БГМ) [1].
Согласно данным литературы [2, 3], дыхательные нарушения являются основной причиной заболеваемости и смертности новорожденных. По данным A. Mehrabadi и соавт. [4], в США частота РДС составила 6,4 на 1000 живых новорожденных в 2005-2006 гг.
Цель работы — анализ частоты РДС как причины ранней неонатальной смерти в Российской Федерации в 20132017 гг.
Материал и методыВ основу работы положен анализ статистических форм А-05 Росстата за 2013-2017 гг., составленных на основании записей в медицинских свидетельствах о перинатальной смерти и относящихся к случаям ранней неонатальной смерти. Согласно приказу Минздравсоцразвития России от 27.12.2011 № 1687н «О медицинских критериях рождения, форме документа о рождении и порядке его выдачи», к ранней неонатальной смерти относят наблюдения смерти детей, умерших в первые 168 ч жизни после рождения. При этом все случаи ранней неонатальной смерти подлежат обязательному патологоанатомическому вскрытию, регистрации и последующему статистическому учету.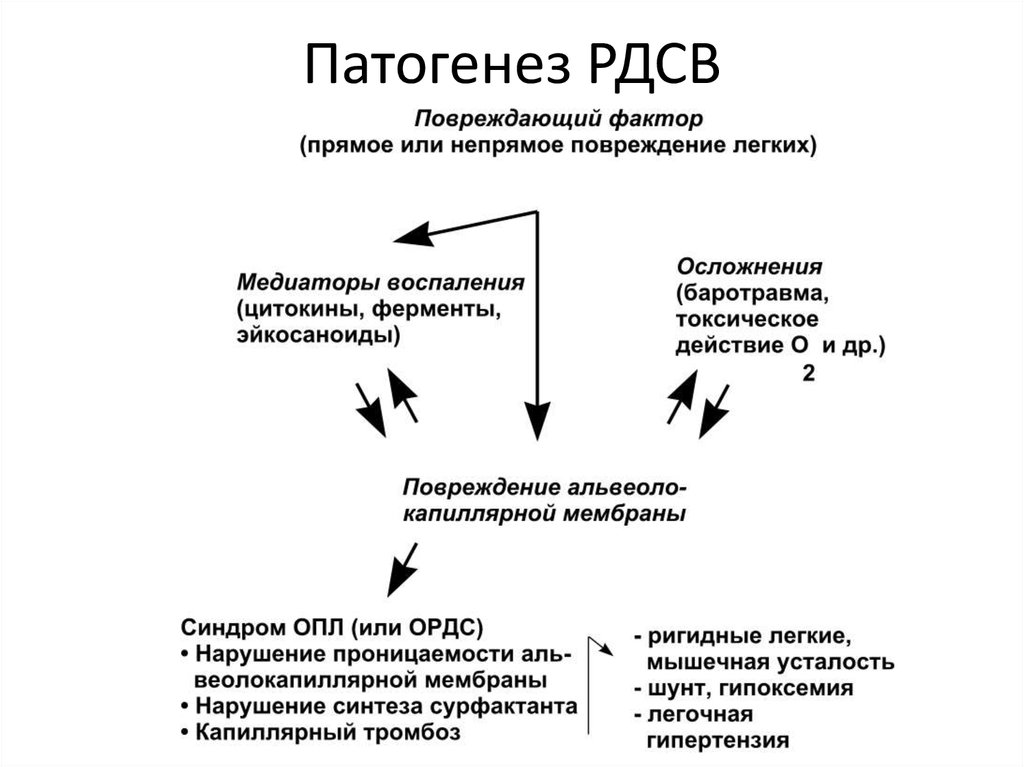
Статистические формы А-05 Росстата содержат сведения о количестве умерших в раннем неонатальном периоде преимущественно в сгруппированном виде в зависимости от основного заболевания (первоначальной причины смерти), а также заболеваний и состояний, способствовавших (или обусловивших) наступление смерти. Предметом настоящего исследования стал РДС (болезнь гиалиновых мембран) новорожденного (код по МКБ-10: Р22). Заболевания и состояния, способствовавшие наступлению смерти, объединены нами в 5 групп:
1. Поражения новорожденного, не связанные с настоящей беременностью.
2. Поражения новорожденного, обусловленные осложнениями беременности у матери.
3. Поражения новорожденного, обусловленные осложнениями со стороны плаценты, пуповины и плодных оболочек.
4. Поражения новорожденного, обусловленные осложнениями родов.
5. Поражения при неустановленных состояниях матери и плаценты, способствовавших смерти.
На основании данных о количестве умерших рассчитывали значения ранней неонатальной смертности от РДС как отношение количества новорожденных, умерших в первые 168 ч жизни от РДС, к общему числу живых новорожденных, умноженное на 1000. Показатели заболеваемости новорожденных РДС рассчитывали как отношение количества новорожденных с диагностированным РДС к общему числу новорожденных, умноженное на 1000. Полученные количественные данные оценивали при помощи критерия χ2.
Показатели заболеваемости новорожденных РДС рассчитывали как отношение количества новорожденных с диагностированным РДС к общему числу новорожденных, умноженное на 1000. Полученные количественные данные оценивали при помощи критерия χ2.
Согласно данным статистических форм А-05 Росстата за 2013-2017 гг., в целом по Российской Федерации в первые 168 ч жизни умер 23 671 новорожденный. Соответственно этому среднее значение показателя ранней неонатальной смертности за 5 лет составило 2,53V. Примечательно, что с 2013 по 2017 г. отмечалось как снижение абсолютного количества новорожденных, умерших в раннем неонатальном периоде, на 46,9% (с 6169 до 3273), так и показателя ранней неонатальной смертности — на 22,5% (с 3,25 до 1,94V).
Общее количество новорожденных, умерших от РДС в первые 168 ч после рождения в Российской Федерации за 5 изученных лет, составило 4076 (17,2% всех наблюдений ранней неонатальной смерти) (табл. 1). При этом с 2013 по 2017 г. зарегистрировано снижение абсолютного количества новорожденных, умерших от РДС, на 57,9% (с 1216 до 512) и показателя ранней неонатальной смертности — на 53,1% (с 0,64 до 0,30V). В свою очередь, доля таких наблюдений от общего количества случаев ранней неонатальной смерти сократилась с 19,7 до 15,6% (р<0,01).
зарегистрировано снижение абсолютного количества новорожденных, умерших от РДС, на 57,9% (с 1216 до 512) и показателя ранней неонатальной смертности — на 53,1% (с 0,64 до 0,30V). В свою очередь, доля таких наблюдений от общего количества случаев ранней неонатальной смерти сократилась с 19,7 до 15,6% (р<0,01).
Примечательно, что в 2013-2017 гг. в целом по Российской Федерации, согласно Сведениям о медицинской помощи беременным, роженицам и родильницам (форма № 32), отмечались волнообразные изменения количества новорожденных, у которых был диагностирован РДС (табл. 2). Минимальное количество (49 608) заболевших отмечалось в 2014 г., максимальное (51 319) — в 2015 г. При этом показатель заболеваемости (количество заболевших на 1000 рожденных живыми) имел минимальное значение (26,0V) в 2014 г., а максимальное (29,9V) — в 2017 г. Среднее значение показателя заболеваемости за 5 анализируемых лет в Российской Федерации составило 27,2V (см. табл. 2).
Возвращаясь к анализу ранней неонатальной смертности, следует отметить, что в 2010 г. , когда новорожденными считались родившиеся на сроке беременности >28 нед с массой тела >1000 г, было зарегистрировано 1052 случая ранней неонатальной смерти от РДС, что составило 21,7% всех наблюдений смерти новорожденных в первые 168 ч жизни [5]. Следовательно, внедрение новых правил регистрации рождения детей в соответствии с критериями Всемирной организации здравоохранения сопровождалось увеличением абсолютного количества случаев ранней неонатальной смерти от РДС в 2013 г. и снижением их количества с 2014 г. При этом доля РДС среди причин ранней неонатальной смерти в 2013-2017 гг. прогрессивно снижалась по сравнению с показателями 2010 г.
, когда новорожденными считались родившиеся на сроке беременности >28 нед с массой тела >1000 г, было зарегистрировано 1052 случая ранней неонатальной смерти от РДС, что составило 21,7% всех наблюдений смерти новорожденных в первые 168 ч жизни [5]. Следовательно, внедрение новых правил регистрации рождения детей в соответствии с критериями Всемирной организации здравоохранения сопровождалось увеличением абсолютного количества случаев ранней неонатальной смерти от РДС в 2013 г. и снижением их количества с 2014 г. При этом доля РДС среди причин ранней неонатальной смерти в 2013-2017 гг. прогрессивно снижалась по сравнению с показателями 2010 г.
В основе подобных изменений лежат, на наш взгляд, особенности развития БГМ. Действительно, развитие БГМ обусловлено отсутствием или недостаточной продукцией сурфактанта и связанным с этим недоразвитием легких [6, 7]. Отсутствие или недостаточное количество сурфактанта закономерно приводит к распространенному коллапсу альвеол и, соответственно, острому повреждению легких с развитием дыхательной недостаточности как непосредственной причины смерти [8]. Морфологически это проявляется наличием так называемых гиалиновых мембран, представляющих собой некротизированные альвеолоциты, пропитанные фибрином и выстилающие внутреннюю поверхность альвеол и терминальных бронхиол. Подобные мембраны определяются через 2-3 ч после начала развития РДС и окончательно формируются через 8-12 ч [9]. В то же время, согласно данным Росстата по Российской Федерации, РДС был зарегистрирован в качестве первоначальной причины смерти в 31 наблюдении мертворождения в 2010 г. [10] и в 23 наблюдениях в 2012 г. [11].
Морфологически это проявляется наличием так называемых гиалиновых мембран, представляющих собой некротизированные альвеолоциты, пропитанные фибрином и выстилающие внутреннюю поверхность альвеол и терминальных бронхиол. Подобные мембраны определяются через 2-3 ч после начала развития РДС и окончательно формируются через 8-12 ч [9]. В то же время, согласно данным Росстата по Российской Федерации, РДС был зарегистрирован в качестве первоначальной причины смерти в 31 наблюдении мертворождения в 2010 г. [10] и в 23 наблюдениях в 2012 г. [11].
Из данных, представленных в табл. 1, видно, что среди умерших новорожденных преобладали мальчики: в 20132017 гг. они составили 58,2%. При этом доля новорожденных, погибших от РДС, среди всех случаев ранней неонатальной смерти была одинаковой среди мальчиков и девочек (в 2013-2017 гг. — 17,2%), а среднее значение показателя ранней неонатальной смерти мальчиков от РДС (0,49V) превышало аналогичное значение для девочек (0,37V). Степень снижения количества умерших была большей также среди новорожденных мальчиков (на 59,9%) по сравнению с девочками (на 55,0%).
Большее количество случаев ранней неонатальной смерти было зарегистрировано в городской местности по сравнению с сельской: за 5 лет их количество составило 66,7%. Однако доля РДС в структуре причин смерти была несколько большей в сельской местности: 18,4% по сравнению с 16,7%, показатель ранней неонатальной смерти от РДС в сельской местности (0,55V) превышал аналогичный показатель в городской местности (0,39V). Степень снижения количества умерших с 2013 по 2017 г. также была более выраженной в сельской местности по сравнению с городской: 60,8 против 56,4%.
Частота случаев РДС с летальным исходом отличалась и в различных федеральных округах (табл. 3). Больше всего (811) случаев ранней неонатальной смерти за 5 лет было зарегистрировано в Приволжском федеральном округе, минимальное количество наблюдений (324) — в СевероЗападном. Однако максимальные значения показателя ранней неонатальной смертности от РДС отмечались в Дальневосточном федеральном округе (0,82V), а минимальные — в Центральном. В этой связи значение показателя ранней неонатальной смерти от РДС 0,20V может рассматриваться в качестве реально достижимого показателя для всей Российской Федерации.
В этой связи значение показателя ранней неонатальной смерти от РДС 0,20V может рассматриваться в качестве реально достижимого показателя для всей Российской Федерации.
Доля новорожденных, умерших от РДС в раннем неонатальном периоде, от общего количества случаев ранней неонатальной смерти, также отличалась в различных федеральных округах. Так, в Дальневосточном и Уральском федеральных округах ее значения весьма превышали общероссийские показатели (27,1 и 24,5% по сравнению с 17,2%, р<0,05). При этом самые высокие значения удельной доли новорожденных, умерших от РДС, были также зарегистрированы в Дальневосточном федеральном округе в 2013 г. (30,2%) и в 2015 г. (в 31,0%). Наиболее низкие значения удельной доли случаев ранней неонатальной смерти от РДС за 5 изученных лет отмечались в Центральном федеральном округе (9,0%). Однако следует отметить, что если в большинстве федеральных округов доля летальных исходов от РДС снижалась с 2013 по 2017 г., то в Центральном федеральном округе, наоборот, увеличивалась (с 7,5% в 2013 г. до 11,4% в 2017 г.). Вместе с тем показатели ранней неонатальной смертности снижались во всех федеральных округах, включая и Центральный. Наиболее выраженное (на 67,4%) снижение показателя ранней неонатальной смертности от РДС отмечалось в Дальневосточном федеральном округе (с 1,35V в 2013 г. до 0,44V в 2017 г.).
до 11,4% в 2017 г.). Вместе с тем показатели ранней неонатальной смертности снижались во всех федеральных округах, включая и Центральный. Наиболее выраженное (на 67,4%) снижение показателя ранней неонатальной смертности от РДС отмечалось в Дальневосточном федеральном округе (с 1,35V в 2013 г. до 0,44V в 2017 г.).
Важный момент анализа летальных исходов — выяснение заболеваний и состояний, способствовавших наступлению смерти. Подобные сведения, представленные в табл. 4, несомненно, важны для изучения звеньев патогенеза и танатогенеза.
К сожалению, чаще всего в медицинских свидетельствах о перинатальной смерти в случаях РДС фигурировала запись, что заболевания, способствовавшие наступлению смерти, не установлены. В целом по Российской Федерации за 5 лет такие наблюдения составили 25,8% всех случаев смерти новорожденных в раннем неонатальном периоде от РДС.
В 24,5% наблюдений смерти от РДС в качестве заболеваний, способствовавших смерти, были зарегистрированы поражения новорожденного, обусловленные осложнениями беременности у матери (2-я группа). В данной группе преобладали отеки, протеинурия и гипертензивные расстройства, обусловленные беременностью, составившие 10,4% всех случаев смерти от РДС. Другим состоянием, входящим во 2-ю группу стало преждевременное излитие околоплодных вод (преждевременный разрыв плодных оболочек) — в 5,1% наблюдений.
В данной группе преобладали отеки, протеинурия и гипертензивные расстройства, обусловленные беременностью, составившие 10,4% всех случаев смерти от РДС. Другим состоянием, входящим во 2-ю группу стало преждевременное излитие околоплодных вод (преждевременный разрыв плодных оболочек) — в 5,1% наблюдений.
Несколько реже по сравнению со 2-й группой в качестве заболеваний, способствовавших наступлению ранней неонатальной смерти от РДС, фигурировали поражения новорожденного, не связанные с настоящей беременностью (1-я группа), и поражения новорожденного, обусловленные осложнениями со стороны плаценты, пуповины и плодных оболочек (3-я группа): в 20,6 и 20,3% соответственно. В 1-й группе преобладали поражения плода и новорожденного, обусловленные расстройствами питания, травмой или хирургическим вмешательством у матери (коды по МКБ-10: Р00.4-Р00.9) составившие 16,2%. В 3-й группе преобладали преждевременная отслойка плаценты (Р02.1) (в 10,2% случаев), а также плацентарная недостаточность и последствия синдрома плацентарной трансфузии (коды по МКБ-10: Р02. 2-Р02.3)(в 10,1% случаев).
2-Р02.3)(в 10,1% случаев).
Согласно данным литературы, риск развития РДС новорожденного повышен у беременных с сахарным диабетом [12], преэклампсией [13], а также при хориоамнионите [14] и родоразрешении путем кесарева сечения [15]. Действительно, гиперинсулинемия плода у беременных, страдающих сахарным диабетом, способствует снижению синтеза сурфактанта вследствие нарушения созревания альвеолоци-тов II типа и развитию РДС новорожденного [12]. При этом M. Hallman и соавт. [16] установили, что происходит снижение синтеза кислого фосфатидилглицерола, а не лецитина — основного компонента сурфактанта.
Развитие преэклампсии, особенно тяжелой ее формы, является показанием для досрочного родоразрешения, в результате чего рождаются недоношенные новорожденные. Видимо, поэтому на основании проведенного нами анализа данных Росстата гипертензивные расстройства у беременной значимо чаще фигурировали в случаях ранней неонатальной смерти от РДС.
Согласно изученным данным Росстата за 2013-2017 гг. , хориоамнионит был расценен в качестве заболевания, обусловившего развитие ранней неонатальной смерти от РДС, лишь в 2% наблюдений в целом по Российской Федерации, что не позволяет считать его выраженным фактором риска развития РДС. Однако следует учитывать, что данные Росстата формируются на основании записей в медицинских свидетельствах о перинатальной смерти, и статистическому учету подлежит лишь одно заболевание, способствовавшее наступлению смерти. А поскольку хориоамнионит считается основной причиной преждевременного разрыва плодных оболочек, то, видимо, последнее состояние и указывалось для регистрации [17], которое, как уже говорилось, отмечалось в 5,1% наблюдений ранней неонатальной смерти от РДС.
, хориоамнионит был расценен в качестве заболевания, обусловившего развитие ранней неонатальной смерти от РДС, лишь в 2% наблюдений в целом по Российской Федерации, что не позволяет считать его выраженным фактором риска развития РДС. Однако следует учитывать, что данные Росстата формируются на основании записей в медицинских свидетельствах о перинатальной смерти, и статистическому учету подлежит лишь одно заболевание, способствовавшее наступлению смерти. А поскольку хориоамнионит считается основной причиной преждевременного разрыва плодных оболочек, то, видимо, последнее состояние и указывалось для регистрации [17], которое, как уже говорилось, отмечалось в 5,1% наблюдений ранней неонатальной смерти от РДС.
К важным моментам следует отнести и данные, полученные K.A. Gerten и соавт. [18] на основании анализа 4778 наблюдений РДС новорожденных. Авторы установили, что кесарево сечение является независимым фактором риска его развития (отношение шансов 3,5, 95% доверительный интервал 3,2-3,8). Данный вывод свидетельствует о необходимости своевременной профилактики РДС при планировании сроков родоразрешения путем кесарева сечения при отсутствии родовой деятельности.
Данный вывод свидетельствует о необходимости своевременной профилактики РДС при планировании сроков родоразрешения путем кесарева сечения при отсутствии родовой деятельности.
Иными словами, действительно, любые состояния, приводящие к развитию преждевременных родов и рождению недоношенного ребенка с той или иной степенью незрелости легких, могут стать причиной развития БГМ. Именно поэтому для пренатальной профилактики развития РДС у новорожденного всем беременным со сроком гестации 24-34 нед при угрозе преждевременных родов назначают глюкокортикоиды [19]. Данные препараты стимулируют процессы дифференцировки клеток, в том числе альвеолоцитов II типа, способствуя более быстрому развитию легких и увеличению образования сурфактанта [20, 21].
Лечение РДС новорожденного рекомендуется начинать как можно раньше [22]. Современное лечение РДС заключается во введении сурфактанта в трахею ребенка в первые минуты жизни и использовании респираторной поддержки в режиме СРАР (постоянного положительного давления в дыхательных путях) [23]. Подобная процедура способствует синтезу эндогенного сурфактанта, снижению резистентности дыхательных путей и увеличению функциональной остаточной емкости легких [24]. Доказано, что антенатальная профилактика и комплексная терапия РДС позволяют снизить летальность и уменьшить частоту осложнений при этом заболевании [25, 26].
Подобная процедура способствует синтезу эндогенного сурфактанта, снижению резистентности дыхательных путей и увеличению функциональной остаточной емкости легких [24]. Доказано, что антенатальная профилактика и комплексная терапия РДС позволяют снизить летальность и уменьшить частоту осложнений при этом заболевании [25, 26].
Тем не менее следует отметить, что при морфологическом изучении аутопсийных препаратов легких новорожденных, получавших и не получавших сурфактант, не выявлено существенных отличий [27]. Хотя, по мнению S.J. Gould [28], после применения сурфактанта гиалиновые мембраны более тонкие и фрагментарные.
ЗаключениеРДС является одним из заболеваний, характеризующихся наиболее высокой частотой летальных исходов. По данным Росстата за 2013-2017 гг., доля РДС среди всех случаев ранней неонатальной смерти составила 18,4%. Частота развития летальных форм РДС отличается в различных федеральных округах РФ. Наиболее высокая удельная доля РДС при ранней неонатальной смерти зарегистрирована в Дальневосточном и Уральском федеральных округах (27,1 и 24,5% соответственно). Доля РДС в структуре причин ранней неонатальной смерти у новорожденных сельской местности превышала аналогичный показатель в городской местности. Среди состояний, обусловивших гибель новорожденных от РДС, чаще других, по данным Росстата, фигурировали гипертензивные заболевания беременной, а также преждевременное излитие околоплодных вод, преждевременная отслойка плаценты и плацентарная недостаточность. Основным путем снижения летальных исходов от РДС считается его антенатальная профилактика и своевременная терапия новорожденного.
Доля РДС в структуре причин ранней неонатальной смерти у новорожденных сельской местности превышала аналогичный показатель в городской местности. Среди состояний, обусловивших гибель новорожденных от РДС, чаще других, по данным Росстата, фигурировали гипертензивные заболевания беременной, а также преждевременное излитие околоплодных вод, преждевременная отслойка плаценты и плацентарная недостаточность. Основным путем снижения летальных исходов от РДС считается его антенатальная профилактика и своевременная терапия новорожденного.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература1. Pickerd N., Kotecha S. The pathophysiology of respiratory distress syndrome // Paediatr. Child. Health. 2009. Vol. 19, N 4. P. 153-157.
2. Patel R.M. Short- and long-term outcomes for extremely preterm infants // Am. J. Perinatol. 2016. Vol. 33, N 3. P. 318-328.
3. Xu J., Murphy S.L., Kochanek K.D., Bastian B. et al. Deaths: final data for 2016 // Natl Vital Stat. Rep. 2018. Vol. 67, N 5. P. 1-76.
Rep. 2018. Vol. 67, N 5. P. 1-76.
4. Mehrabadi A., Lisonkova S., Joseph K.S. Heterogeneity of respiratory distress syndrome: risk factors and morbidity associated with early and late gestation disease // BMC Pregnancy Childb. 2016. Vol. 16, N 1. P 281.
5. Щеголев А.И., Павлов К.А., Дубова Е.А., Фролова О.Г. Ранняя неонатальная смертность в Российской Федерации в 2010 г. // Арх. пат. 2013. № 4. С. 15-19.
6. Sweet D.G., Carnielli V., Greisen G., Hallman M. et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants — 2010 update // Neonatology. 2010. Vol. 97, N 4. P 402-417.
7. Bahadue F.L., Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome // Cochrane Database Syst. Rev. 2012. Vol. 11. CD001456.
8. Голубев А.М., Перепелица С.А., Смердова Е.Ф., Мороз В.В. Клиникоморфологические особенности дыхательных расстройств у недоношенных новорожденных // Общ. реаниматология 2008. № 3. С. 49-55.
№ 3. С. 49-55.
9. Gilbert-Barness E., Spicer D.E., Steffensen T.S. Handbook of Pediatric Autopsy Pathology. 2nd ed. New York, etc : Springer, 2014. P 338339.
10. Щеголев А.И., Павлов К.А., Дубова Е.А., Фролова О.Г. Мертво-рождаемость в субъектах Российской Федерации в 2010 году // Арх. пат, 2013. № 2. С. 20-24.
11. Щеголев А.И., Туманова У.Н., Шувалова М.П., Фролова О.Г. Сравнительный анализ мертворождаемости в Российской Федерации в 2010 и 2012 годах // Рос. вестн. перинатол. и педиатр. 2015. № 3. С. 58-62.
12. Schwartz R., Teramo K.A. Effects of diabetic pregnancy on the fetus and newborn // Semin. Perinatol. 2000. Vol. 24, N 2. P 120-135.
13. Jelin A.C., Cheng Y.W., Shaffer B.L., Kaimal A.J. et al. Early-onset preeclampsia and neonatal outcomes // J. Matern. Fetal Neonatal Med. 2010. Vol. 23, N 5. P 389-392.
14. Lee Y., Kim H.J., Choi S.J., Oh S.Y. et al. Is there a stepwise increase in neonatal morbidities according to histological stage (or grade) of acute chorioamnionitis and funisitis?: effect of gestational age at delivery // J. Perinat. Med. 2015. Vol. 43, N 2. P 259-267.
Perinat. Med. 2015. Vol. 43, N 2. P 259-267.
15. Hansen A.K., Wisborg K., Uldbjerg N., Henriksen T.B. Risk of respiratory morbidity in term infants delivered by elective caesarean section: cohort study // BMJ. 2008. Vol. 336, N 7635. P 85-87.
16. Hallman M., Teramo K. Amniotic fluid phospholipid profile as a predictor of fetal maturity in diabetic pregnancies // Obstet. Gynecol. 1979. Vol. 54, N 6. P 703-707.
17. Туманова У.Н., Шувалова М.П., Щеголев А.И. Преждевременный разрыв плодных оболочек и перинатальная смертность // Неонатология: новости, мнения, обучение. 2017. Т 5, № 1. С. 86-92.
18. Gerten K.A., Coonrod D.V., Bay R.C., Chambliss L.R. Cesarean delivery and respiratory distress syndrome: does labor make a difference? // Am. J. Obstet. Gynecol. 2005. Vol. 193, N 3. Pt 2. P 1061-1064.
19. Байбарина Е.Н., Верещинский А.М., Горелик К.Д и др. Принципы ведения новорожденных с респираторным дистресс-синдромом. проект практических рекомендаций (сокращенный вариант) // Вопр. практ. педиатрии. 2007. Т 2, № 3. С. 46-61.
практ. педиатрии. 2007. Т 2, № 3. С. 46-61.
20. Павлович С.В. Антенатальная профилактика респираторного дистресс-синдрома новорожденных // Акуш. и гин. 2011. № 3. С. 8185.
21. Zhang H., Liu J., Liu T, Wang Y. et al. Antenatal maternal medication administration in preventing respiratory distress syndrome of premature infants: a network meta-analysis // Clin. Respir. J. 2018. Vol. 12, N 10. P. 2480-2490.
22. Панкратов Л.Г., Шабалов Н.П., Любименко В.А. Сурфактанты в лечении респираторного дистресс-синдрома у новорожденных // Вопр. практ. педиатрии 2006. № 6 (1). С. 34-43.
23. Sardesai S., Biniwale M., Wertheimer F., Garingo A. et al. Evolution of surfactant therapy for respiratory distress syndrome: past, present, and future // Pediatr. Res. 2017. Vol. 81, N 1-2. P 240-248.
24. Степанова О.А. Респираторный дистресс-синдром недоно-шенныхноворожденных: современнаятактикатерапии ипрофилактики// Практ. мед. 2010. № 6 (45). С. 84-87.
25. Horbar J.D., Wright E. C., Onstad L. Decreasing mortality associated with the introduction of surfactant therapy: an observational study of neonates weighing 601 to 1300 grams at birth. The Members of the National Institute of Child Health and Human Development Neonatal Research Network // Pediatrics. 1993. Vol. 92, N 2. P. 191-196.
C., Onstad L. Decreasing mortality associated with the introduction of surfactant therapy: an observational study of neonates weighing 601 to 1300 grams at birth. The Members of the National Institute of Child Health and Human Development Neonatal Research Network // Pediatrics. 1993. Vol. 92, N 2. P. 191-196.
26. Roberts D., Brown J., Medley N., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth // Cochrane Database Syst. Rev. 2017. Vol. 3. CD004454.
27. Thornton C.M., Halliday H.L., O’Hara M.D. Surfactant replacement therapy in preterm neonates: a comparison of postmortem pulmonary histology in treated and untreated infants // Pediatr. Pathol. 1994. Vol. 14, N 6. P. 945-953.
28. Gould S.J. The respiratory system // Fetal and Neonatal Pathology. 4th ed. / eds J.W. Keeling, T.Y. Khong. London : Springer, 2007. P. 531-570.
References1. Pickerd N., Kotecha S. The pathophysiology of respiratory distress syndrome. Paediatr Child. Health. 2009; 19 (4): 153-7.
Paediatr Child. Health. 2009; 19 (4): 153-7.
2. Patel R.M. Short- and long-term outcomes for extremely preterm infants. Am J Perinatol. 2016; 33 (3): 318-28.
3. Xu J., Murphy S.L., Kochanek K.D., Bastian B., et al. Deaths: final data for 2016. Natl Vital Stat. Rep. 2018; 67 (5): 1-76.
4. Mehrabadi A., Lisonkova S., Joseph K.S. Heterogeneity of respiratory distress syndrome: risk factors and morbidity associated with early and late gestation disease. BMC Pregnancy Childb. 2016; 16 (1): 281.
5. Shchegolev A.I., Pavlov K.A., Dubova E.A., Frolova O.G. Early neonatal mortality in the Russian Federation in 2010. Arkhiv patologii [Archive of Pathology]. 2013; (4): 15-9. (in Russian)
6. Sweet D.G., Carnielli V., Greisen G., Hallman M., et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants — 2010 update. Neonatology. 2010; 97 (4): 402-17.
7. Bahadue F.L., Soll R. Early versus delayed selective surfactant treatment for neonatal respiratory distress syndrome. Cochrane Database Syst Rev. 2012; 11: CD001456.
Cochrane Database Syst Rev. 2012; 11: CD001456.
8. Golubev A.M., Perepelitsa S.A., Smerdova Ye.F., Moroz V.V. Clinical and morphological features of respiratory disorders in preterm neonates. Obshchaya reanimatologiya [General Resuscitation]. 2008; (3): 49-55. (in Russian)
9. Gilbert-Barness E., Spicer D.E., Steffensen T.S. Handbook of pediatric autopsy pathology. 2nd ed. New York, etc: Springer, 2014: 338-9.
10. Shchegolev A.I., Pavlov K.A., Dubova E.A., Frolova O.G. Stillbirth rate in the subjects of the Russian Federation in 2010. Arkhiv patologii [Archive of Pathology]. 2013; (2): 20-4. (in Russian)
11. Shchegolev A.I., Tumanova U.N., Shuvalova M.P., Frolova O.G. Comparative analysis of stillbirths in the Russian Federation in 2010 and 2012. Rossiyskiy vestnik perinatologii i pediatrii [Russian Bulletin of Perinatology and Pediatrics]. 2015; (3): 58-62. (in Russian)
12. Schwartz R., Teramo K.A. Effects of diabetic pregnancy on the fetus and newborn. Semin Perinatol. 2000; 24 (2): 120-35.
Semin Perinatol. 2000; 24 (2): 120-35.
13. Jelin A.C., Cheng Y.W., Shaffer B.L., Kaimal A.J., et al. Early-onset preeclampsia and neonatal outcomes. J Matern Fetal Neonatal Med. 2010; 23 (5): 389-92.
14. Lee Y., Kim H.J., Choi S.J., Oh S.Y., et al. Is there a stepwise increase in neonatal morbidities according to histological stage (or grade) of acute chorioamnionitis and funisitis? Effect of gestational age at delivery. J Perinat Med. 2015; 43 (2): 259-67.
15. Hansen A.K., Wisborg K., Uldbjerg N., Henriksen T.B. Risk of respiratory morbidity in term infants delivered by elective caesarean section: cohort study. BMJ. 2008; 336 (7635): 85-7.
16. Hallman M., Teramo K. Amniotic fluid phospholipid profile as a predictor of fetal maturity in diabetic pregnancies. Obstet Gynecol. 1979; 54 (6): 703-7.
17. Tumanova U.N., Shuvalova M.P., Shchegolev A.I. Premature rupture of membranes and perinatal death. Neonatologiya: novosti, mneniya, obuchenie [Neonatology: News, Opinions, Training]. 2017; 5 (1): 86-92. (in Russian)
2017; 5 (1): 86-92. (in Russian)
18. Gerten K.A., Coonrod D.V., Bay R.C., Chambliss L.R. Cesarean delivery and respiratory distress syndrome: does labor make a difference? Am J Obstet. Gynecol. 2005; 193 (3 Pt 2): 1061-4.
19. Baibarina E.N., Vereshchinskiy A.M., Gorelik K.D., et al. Principles of management of the neonate with respiratory distress syndrome. Vo-prosy prakticheskoy pediatrii [Problems of Practical Pediatrics]. 2007; (3): 46-61. (in Russian)
20. Pavlovich S.V. Antenatal prevention of neonatal respiratory distress syndrome. Akusherstvo i ginekologiya [Obstetrics and Gynecology]. 2011; (3): 81-5 (in Russian)
21. Zhang H., Liu J., Liu T., Wang Y., et al. Antenatal maternal medication administration in preventing respiratory distress syndrome of premature infants: a network meta-analysis. Clin Respir J. 2018; 12 (10): 2480-90.
22. Pankratov L.G., Shabalov N.P., Liubimenko V.A. Sufractants in treatment of respiratory distress syndrome in neonates. Voprosy prakticheskoy pediatrii [Problems of Practical Pediatrics]. 2006; 1 (6): 34-43. (in Russian)
Voprosy prakticheskoy pediatrii [Problems of Practical Pediatrics]. 2006; 1 (6): 34-43. (in Russian)
23. Sardesai S., Biniwale M., Wertheimer F., Garingo A., et al. Evolution of surfactant therapy for respiratory distress syndrome: past, present, and future. Pediatr Res. 2017; 81 (1-2): 240-8.
24. Stepanova O.A. Respiratory distress syndrome premature infants: modern tactics therapy and prevention. Prakticheskaya meditsina [Practical Medicine]. 2010; (6): 84-7. (in Russian)
25. Horbar J.D., Wright E.C., Onstad L. Decreasing mortality associated with the introduction of surfactant therapy: an observational study of neonates weighing 601 to 1300 grams at birth. The Members of the National Institute of Child Health and Human Development Neonatal Research Network. Pediatrics. 1993; 92 (2): 191-6.
26. Roberts D., Brown J., Medley N., Dalziel S.R. Antenatal corticosteroids for accelerating fetal lung maturation for women at risk of preterm birth. Cochrane Database Syst Rev. 2017; 3: CD004454.
2017; 3: CD004454.
27. Thornton C.M., Halliday H.L., O’Hara M.D. Surfactant replacement therapy in preterm neonates: a comparison of postmortem pulmonary histology in treated and untreated infants. Pediatr Pathol. 1994; 14 (6): 945-53.
28. Gould S.J. The respiratory system. In: J.W. Keeling, T.J. Khong (eds.) Fetal and Neonatal Pathology. 4th ed. London: Springer, 2007: 531-70.
Респираторный дистресс-синдром новорожденных: ранняя диагностика, профилактика и лечение | Перепелица
1. Dementyeva G.M. Low birth weight. Fetal and neonatal hypoxia. Lecture for the physician. Moscow: Moscow Research Institute of Pediatrics and Pediatric Surgery, Ministry of Health of the Russian Federation; 2003. [In Russ.].
2. Baibarina E.N., Antonov A.G., Lenyushkina A.A. Clinical care guidelines for extremely low birth weight neonatal infants. Voprosy Prakt. Pediatrii. 2006; 4 (1): 96—97. [In Russ.].
3. Sidelnikova V.M., Antonov A.G. Premature birth. Premature baby. Moscow: GEOTAR — Media; 2006. [In Russ.].
Moscow: GEOTAR — Media; 2006. [In Russ.].
4. Pestrikova T.Yu., Yurasova E.A., Butko T.M. Perinatal losses. Reduction reserves. Moscow: Littera; 2008. [In Russ.].
5. Callaghan W. M., MacDorman M. F., Rasmussen S. A., Qin C., Lackritz E. M. The contribution of preterm birth to infant mortality rates in the United States. Pediatrics. 2006; 118 (4): 1566—1573.
6. Shapiro-Mendoza C. K., Tomashek K. M., Kotelchuck M., Barfield W., Nannini A., Weiss J., Declercq E. Effect of latepreterm birth and maternal medical conditions on newborn morbidity risk. Pediatrics. 2008; 121 (2): e223—e232.
7. Sukhanova L.P. Causes of perinatal mortality in Russia. Proceedings of the 5th Congress of the Russian Association of Perinatal Medicine Specialists on Current Approaches to Detection, Treatment, and Prevention of Perinatal Pathology. Moscow. 2005. 194—196. [In Russ.].
8. Chumakova O.V., Baibarina E.N., Tsymlyakova L.M., Antonov A.G., Frolova O.G., Sorokina Z.Kh. Nursing of extremely low birth weight infants: Organizational aspects. Ross. Vestn. Perinatol. i Pediatrii. 2008; 53 (5): 49. [In Russ.].
Ross. Vestn. Perinatol. i Pediatrii. 2008; 53 (5): 49. [In Russ.].
9. Geppe N.A., Volkov I.K. Pediatric Pulmonology in Russia: Developmental prospects and problems. Pulmonologiya. 2007; 4: 6. [In Russ.].
10. Bramley D.W., Blackman L.R. Critical conditions in infants. Moscow: Meditsina Publishers; 1980. [In Russ.].
11. Sotnikova K.A. The state of the art of neonatal respiratory distress syndrome. Neonatal respiratory distress syndrome. Moscow: Meditsina Publishers; 1980. [In Russ.].
12. Emmanouilidis G.K., Baylen B.G. Neonatal cardiopulmonary distress. Moscow: Meditsina Publishers, 1994. [In Russ.].
13. Grebennikov V.A., Milenin O.B., Ryumina I.I. Results of clinical trials of Exosurf Neonatal, a synthetic surfactant, in Russia. Pediatriya. 1995; 3: 65—68. [In Russ.].
14. Golubev A.M., Perepelitsa S.A., Smerdova E.F., Moroz V.V. Clinical and morphological features of respiratory disorders in premature neonates. Obshchaya Reanimatologiya. 2008; 4 (3): 49—55. [In Russ.].
[In Russ.].
15. Perepelitsa S.A., Golubev A.M., Moroz V.V. Choice of ventilation mode for preterm neonatal infants with respiratory distress syndrome. Obshchaya Reanimatologiya. 2010; 6 (3): 67—70. [In Russ.].
16. Avery M. E., Mead J. Surface properties in relation to atelectasis and hyaline membrane disease. AMA J. Dis. Child. 1959; 97 (5 Part 1): 517—523.
17. Gitlin D., Craig J. M. The nature of hyaline membrane in asphyxia of the newborn. Pediatrics. 1956; 17 (1): 64—71.
18. Golubev A. M., Perepelitsa C. A., Moroz V. V. Morphological characteristics of newborns` lungs with hyaline membranes disease in surfactants use. Novinky v anesteziologii a intenzivnej medicine. Zbornik vycha ́dza pri prilezitosti 16. medzina ́rodne ́ho kongresu Slovenskej spolocnosti aneste ́ziolo ́gie a intenzivnej mediciny konanom v Piešt’anoch 20—22 ma ́ja 2009. Piešt`any. 26—27.
19. Obladen M. Neugeborenenintensivpflege. Berlin — Heidelberg: Springer-Verlag; 2002.
20. Wauer R. R. Respiratory Distress Syndrome. In: Wauer R. R. (ed.). Surfactant therapy: basic principles, diagnosis, therapy. Stuttgart — New York: Thieme; 1998.
R. Respiratory Distress Syndrome. In: Wauer R. R. (ed.). Surfactant therapy: basic principles, diagnosis, therapy. Stuttgart — New York: Thieme; 1998.
21. Greenough A., Dimitriou G., Prendergast M., Milner A. D. Synchronized mechanical ventilation for respiratory support in newborn infants. Cochrane Database Syst. Rev. 2008; 1: CD000456.
22. Soll R. F., Morley C. J. Prophylactic versus selective use of surfactant in preventing morbidity and mortality in preterm infants. Cochrane Database Syst. Rev. 2000; 2: CD000510.
23. Rozenberg O.A., Seiliyev A.A. Natural lung surfactants for the treatment of respiratory distress syndrome in the newborns and adults. Proceedings of the 2nd International Congress on Topical Problems in the Design of New Natural Drugs. Saint Petersburg; 1998. 81—85. [In Russ.].
24. Rozenberg O.A., Osovskikh V.V., Granov D.A. Surfactant therapy for respiratory failure in critical conditions and other diseases of the lung. Saint Petersburg; 2002. [In Russ. ].
].
25. Hall R.T. Indications for surfactant therapy — the aAPO2 coming of age. Pediatrics. 1999; 103 (2): E25. [In Russ.].
26. Jobe A.H. Mechanisms to explain surfactant response. Biol. Neonate. 2006; 89 (4): 298—302. [In Russ.].
27. Perepelitsa S.A., Golubev A.M., Moroz V.V. Effect of exogenous surfactants on blood gas composition parameters in neonatal infants with respiratory distress syndrome. Obshchaya Reanimatologiya. 2007; 3 (3): 59—64. [In Russ.].
28. Perepelitsa S.A., Golubev A.M., Moroz V.V. The specific features of artificial ventilation in premature neonates with respiratory distress syndrome. Obshchaya Reanimatologiya. 2010; 6 (1): 11—16. [In Russ.].
29. Peretyatko L.P., Kulida L.V., Protsenko E.V. Morphology of fetuses and extremely low birth weight neonates. Ivanovo; 2005. [In Russ.].
30. Burri P. H. Morphology and respiratory function of the alveolar unit. Int. Arch. Allergy Appl. Immunol. 1985; 76 (Suppl 1): 2—12.
Респираторный дистресс-синдром у младенцев (болезнь гиалиновых мембран)
Болезнь гиалиновых мембран (БГМ), также называемая респираторным дистресс-синдромом (РДС), представляет собой состояние, при котором детям требуется дополнительный кислород и помощь при дыхании.
- HMD — одна из наиболее частых проблем у недоношенных детей.
- Чем более недоношенный ребенок, тем выше риск и тяжелее HMD.
- HMD обычно ухудшается в течение первых 48–72 часов, а затем улучшается при лечении.
- Более 90 процентов детей с HMD выживают.
В Бостонской детской больнице мы ухаживаем за новорожденными, нуждающимися в интенсивной медицинской помощи, в специальном отделении больницы, называемом отделением интенсивной терапии новорожденных (NICU). Отделение интенсивной терапии сочетает в себе передовые технологии и квалифицированных специалистов для оказания специализированной помощи самым маленьким пациентам.
Респираторный дистресс-синдром у младенцев (болезнь гиалиновых мембран) | Симптомы и причины
Каковы симптомы HMD?
Хотя симптомы у каждого ребенка могут быть разными, некоторые из наиболее распространенных симптомов HMD включают:
- затрудненное дыхание при рождении, которое постепенно ухудшается
- цианоз (синяя окраска)
- раздувание ноздрей
- тахипноэ (учащенное дыхание)
- хрюкающих звуков при дыхании
- ретракции грудной клетки (втягивание ребер и грудины во время)
Симптомы HMD обычно достигают пика на третий день и могут быстро исчезнуть, когда у вашего ребенка начинается диурез (выделение избытка воды с мочой) и ему требуется меньше кислорода и механическая помощь для дыхания.
Что вызывает HMD?
ГМД возникает, когда в легких недостаточно вещества, называемого сурфактантом. Сурфактант вырабатывается клетками дыхательных путей и состоит из фосфолипидов и белка. Он начинает вырабатываться у плода примерно на 24–28 неделе беременности и обнаруживается в амниотической жидкости между 28 и 32 неделями. Примерно к 35 неделе беременности у большинства детей вырабатывается достаточное количество сурфактанта.
Респираторный дистресс-синдром у младенцев (болезнь гиалиновых мембран) | Диагностика и лечение
Как диагностируется БГМ?
HMD обычно диагностируется с помощью комбинации оценок, включая:
- внешний вид, цвет кожи и дыхательные усилия (эти признаки указывают на потребность вашего ребенка в кислороде)
- рентген легких : рентгеновские лучи — это электромагнитная энергия, используемая для получения изображений костей и внутренних органов на пленке.

- газы крови (тесты на кислород, углекислый газ и кислоту в артериальной крови): часто показывают пониженное количество кислорода и повышенное содержание углекислого газа.
- эхокардиография (ЭКГ) : может использоваться для исключения проблем с сердцем, которые могут вызывать симптомы, сходные с БГМ. Электрокардиограмма — это тест, который регистрирует электрическую активность сердца, показывает аритмии (аномальные ритмы) и обнаруживает повреждение сердечной мышцы.
Какие существуют методы лечения HMD?
Лечение HMD может включать:
- размещение эндотрахеальной трубки (дыхательная трубка, также называемая ЭТ) в трахею вашего ребенка
- механический дыхательный аппарат (для выполнения работы по дыханию вашего ребенка)
- дополнительный кислород (дополнительное количество кислорода)
- постоянное положительное давление в дыхательных путях (CPAP): механический дыхательный аппарат, который направляет непрерывный поток воздуха или кислорода в дыхательные пути, помогая держать крошечные дыхательные пути в легких открытыми
- замена сурфактанта искусственным сурфактантом : было показано, что это лечение уменьшает тяжесть HMD и является наиболее эффективным, если его начать в первые шесть часов после рождения.
 Его можно назначать в качестве профилактического лечения детей с очень высоким риском развития БГМ или использовать в качестве метода «спасения». Препарат выпускается в виде порошка, который смешивают со стерильной водой и вводят через эндотрахеальную трубку. Это лечение обычно вводят в несколько доз.
Его можно назначать в качестве профилактического лечения детей с очень высоким риском развития БГМ или использовать в качестве метода «спасения». Препарат выпускается в виде порошка, который смешивают со стерильной водой и вводят через эндотрахеальную трубку. Это лечение обычно вводят в несколько доз. - лекарства
Респираторный дистресс-синдром у младенцев (болезнь гиалиновых мембран) | Часто задаваемые вопросы
Что делает поверхностно-активное вещество?
В здоровых легких сурфактант высвобождается в ткани легких, где он помогает снизить поверхностное натяжение в дыхательных путях, что помогает держать альвеолы легких (воздушные мешочки) открытыми. Когда сурфактанта не хватает, крошечные альвеолы схлопываются при каждом вдохе. Когда альвеолы спадаются, поврежденные клетки накапливаются в дыхательных путях, что еще больше затрудняет дыхание.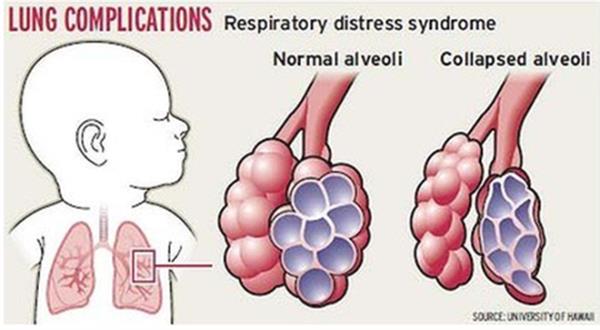 Эти клетки называются гиалиновыми мембранами. Ваш ребенок все больше и больше работает над дыханием, пытаясь надуть свернувшиеся дыхательные пути.
Эти клетки называются гиалиновыми мембранами. Ваш ребенок все больше и больше работает над дыханием, пытаясь надуть свернувшиеся дыхательные пути.
По мере того, как функция легких вашего ребенка ухудшается, он получает меньше кислорода и в крови накапливается больше углекислого газа. Это может привести к ацидозу (повышенному содержанию кислоты в крови), состоянию, которое может повлиять на другие органы тела. Без лечения ваш ребенок истощается, пытаясь дышать, и в конце концов сдается. Вместо этого работу по дыханию должен выполнять аппарат искусственной вентиляции легких (дыхательный аппарат).
Какие факторы определяют прогрессирование БГМ?
Течение болезни с HMD зависит от размера и гестационного возраста вашего ребенка, тяжести заболевания, наличия инфекции, наличия или отсутствия у вашего ребенка открытого артериального протока (заболевания сердца) и наличия ей нужна механическая помощь, чтобы дышать.
На кого влияет HMD?
ГМД встречается примерно у 60–80 % детей, рожденных до 28 недель беременности, и только у 15–30 % детей, рожденных между 32 и 36 неделями.
Хотя большинство детей с БГМ рождаются недоношенными, на вероятность развития заболевания могут влиять и другие факторы. К ним относятся следующие:
- дети европеоидной расы или мальчики
- предыдущее рождение ребенка с HMD
- Кесарево сечение
- перинатальная асфиксия (недостаток воздуха непосредственно перед, во время или после рождения)
- холодовой стресс (состояние, подавляющее выработку сурфактанта)
- перинатальная инфекция
- многоплодные роды (многоплодные дети часто бывают недоношенными)
- младенцев от матерей с диабетом (слишком большое количество инсулина в организме ребенка из-за диабета матери может задерживать выработку сурфактанта)
- младенцев с открытым артериальным протоком
Какие осложнения связаны с HMD?
У вашего ребенка могут развиться осложнения болезни или проблемы как побочные эффекты лечения. Как и при любом заболевании, более тяжелые случаи часто имеют больший риск осложнений. Некоторые осложнения, связанные с HMD, включают следующее:
Как и при любом заболевании, более тяжелые случаи часто имеют больший риск осложнений. Некоторые осложнения, связанные с HMD, включают следующее:
- утечки воздуха из тканей легких, такие как:
- пневмомедиастинум: утечка воздуха в средостение (пространство между двумя плевральными мешками, содержащими легкие).
- пневмоторакс: утечка воздуха в пространство между грудной стенкой и наружными тканями легких
- пневмоперикард: утечка воздуха в сумку, окружающую сердце
- интерстициальная эмфизема легких (ПИЭ): воздух просачивается и попадает в ловушку между альвеолами, крошечными воздушными мешочками легких
- хроническое заболевание легких, иногда называемое бронхолегочной дисплазией
Можно ли предотвратить HMD?
Лучший способ предотвратить HMD — предотвратить преждевременные роды. Когда преждевременные роды нельзя предотвратить, было показано, что введение матери лекарств, называемых кортикостероидами, до родов значительно снижает риск и тяжесть HMD у ребенка. Эти стероиды часто назначают женщинам между 24 и 34 неделями беременности, у которых есть риск преждевременных родов.
Эти стероиды часто назначают женщинам между 24 и 34 неделями беременности, у которых есть риск преждевременных родов.
Респираторный дистресс-синдром у младенцев (болезнь гиалиновых мембран) | Программы и услуги
Отделы
Программы
Респираторный дистресс у новорожденных
КРИСТИАН Л. ХЕРМАНСЕН, MD, И КЕВИН Н. ЛОРА, MD Наиболее распространенной этиологией неонатальной дыхательной недостаточности является транзиторное тахипноэ новорожденных; это вызвано избытком жидкости в легких, и симптомы обычно исчезают спонтанно. Респираторный дистресс-синдром может возникать у недоношенных детей в результате дефицита сурфактанта и недоразвитой анатомии легких. Часто необходимо вмешательство с оксигенацией, вентиляцией и заменой сурфактанта. Пренатальное введение кортикостероидов между 24 и 34 неделями гестации снижает риск респираторного дистресс-синдрома у новорожденных, когда высок риск преждевременных родов. Считается, что синдром аспирации мекония возникает внутриутробно в результате дистресса плода из-за гипоксии. Заболеваемость не снижается ни за счет амниоинфузии перед родами, ни за счет аспирации новорожденного во время родов. Варианты лечения включают реанимацию, оксигенацию, заместительную терапию сурфактантом и вентиляцию легких. Другие этиологии дыхательной недостаточности включают пневмонию, сепсис, пневмоторакс, персистирующую легочную гипертензию и врожденные пороки развития; лечение зависит от конкретного заболевания. Начальная оценка стойкого или тяжелого респираторного дистресс-синдрома может включать общий анализ крови с дифференциалом, рентгенографию органов грудной клетки и пульсоксиметрию.
Респираторный дистресс-синдром может возникать у недоношенных детей в результате дефицита сурфактанта и недоразвитой анатомии легких. Часто необходимо вмешательство с оксигенацией, вентиляцией и заменой сурфактанта. Пренатальное введение кортикостероидов между 24 и 34 неделями гестации снижает риск респираторного дистресс-синдрома у новорожденных, когда высок риск преждевременных родов. Считается, что синдром аспирации мекония возникает внутриутробно в результате дистресса плода из-за гипоксии. Заболеваемость не снижается ни за счет амниоинфузии перед родами, ни за счет аспирации новорожденного во время родов. Варианты лечения включают реанимацию, оксигенацию, заместительную терапию сурфактантом и вентиляцию легких. Другие этиологии дыхательной недостаточности включают пневмонию, сепсис, пневмоторакс, персистирующую легочную гипертензию и врожденные пороки развития; лечение зависит от конкретного заболевания. Начальная оценка стойкого или тяжелого респираторного дистресс-синдрома может включать общий анализ крови с дифференциалом, рентгенографию органов грудной клетки и пульсоксиметрию.
Клинические проявления дыхательной недостаточности у новорожденных включают апноэ, цианоз, кряхтение, инспираторный стридор, раздувание носа, плохой аппетит и тахипноэ (более 60 вдохов в минуту). Также могут быть ретракции в межреберных, субреберных или надреберных промежутках. Респираторный дистресс встречается примерно у 7 процентов младенцев, 1 и подготовка имеют решающее значение для врачей, оказывающих помощь новорожденным. Большинство случаев вызваны транзиторным тахипноэ новорожденных, респираторным дистресс-синдромом или синдромом аспирации мекония, но возможны и другие причины 90–175 (таблица 1) 90–176 .
| Clinical recommendation | Evidence rating | References |
|---|---|---|
Prenatal administration of corticosteroids between 24 and 34 weeks’ gestation reduces the risk of respiratory distress syndrome of the newborn when the risk of преждевременные роды высоки. | A | 20 |
| Ороназофарингеальная аспирация перед родами через плечо не предотвращает синдром аспирации мекония. | B | 23 |
| Использование селективных ингибиторов обратного захвата серотонина на поздних сроках беременности может вызвать стойкую легочную гипертензию у новорожденного. | С | 16 |
| Most common causes * |
| Transient tachypnea of the newborn |
| Respiratory distress syndrome (hyaline membrane disease) |
| Meconium aspiration syndrome |
| Less common but significant causes |
| Отсроченный переход |
| Инфекция (например, пневмония, сепсис) |
| Нелегочные причины (например, анемия, врожденный порок сердца, врожденный порок развития, лекарственные препараты, неврологическая или метаболическая обструкция верхних дыхательных путей, полицитемия)0199 |
| Персистирующая легочная гипертензия новорожденных |
| Пневмоторакс |
Транзиторное тахипноэ новорожденных
Транзиторное тахипноэ новорожденных является наиболее частой причиной неонатальной дыхательной недостаточности, составляя более 40 процентов случаев. 1 Доброкачественное состояние, возникающее, когда остаточная легочная жидкость остается в легочной ткани плода после родов. Простагландины, высвобождаемые после родов, расширяют лимфатические сосуды для удаления легочной жидкости, так как легочная циркуляция увеличивается с первым вдохом. Когда жидкость сохраняется, несмотря на эти механизмы, может возникнуть транзиторное тахипноэ новорожденного. Факторы риска включают материнскую астму, 2 мужской пол, макросомия, диабет матери, 3 и кесарево сечение. 4
1 Доброкачественное состояние, возникающее, когда остаточная легочная жидкость остается в легочной ткани плода после родов. Простагландины, высвобождаемые после родов, расширяют лимфатические сосуды для удаления легочной жидкости, так как легочная циркуляция увеличивается с первым вдохом. Когда жидкость сохраняется, несмотря на эти механизмы, может возникнуть транзиторное тахипноэ новорожденного. Факторы риска включают материнскую астму, 2 мужской пол, макросомия, диабет матери, 3 и кесарево сечение. 4
Клиническая картина включает тахипноэ сразу после рождения или в течение двух часов с другими предсказуемыми признаками дыхательной недостаточности. Симптомы могут длиться от нескольких часов до двух дней. Рентгенография грудной клетки показывает диффузные паренхиматозные инфильтраты, «влажный силуэт» вокруг сердца или внутридолевое скопление жидкости 5 (рис. 1) .
Правообладатель не предоставил права на воспроизведение данного объекта на электронных носителях. Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Респираторный дистресс-синдром
Респираторный дистресс-синдром новорожденных, также называемый болезнью гиалиновых мембран, является наиболее частой причиной респираторного дистресса у недоношенных детей, связанного со структурной и функциональной незрелостью легких. Это происходит у 24 000 младенцев, рожденных в Соединенных Штатах ежегодно. 6 Это наиболее часто встречается у детей, рожденных на сроке менее 28 недель, и поражает одну треть детей, рожденных на сроке от 28 до 34 недель, но встречается менее чем у 5 процентов детей, родившихся после 34 недель беременности. 6 Заболевание чаще встречается у мальчиков, 7 , и заболеваемость примерно в шесть раз выше у младенцев, матери которых страдают диабетом, из-за замедления созревания легких, несмотря на макросомию. 8
Патофизиология сложна. Незрелые альвеолярные клетки II типа продуцируют меньше сурфактанта, вызывая увеличение альвеолярного поверхностного натяжения и снижение податливости. Возникающий в результате ателектаз вызывает сужение легочных сосудов, гипоперфузию и ишемию легочной ткани. Гиалиновые мембраны формируются за счет комбинации отслоившегося эпителия, белка и отека. Стойкий респираторный дистресс-синдром приводит к бронхолегочной дисплазии, характеризующейся типичными рентгенологическими данными грудной клетки и хронической кислородной зависимостью. Синдром связан с рецидивирующими хрипами у детей и более высоким риском госпитализации по поводу астмы. 9
Возникающий в результате ателектаз вызывает сужение легочных сосудов, гипоперфузию и ишемию легочной ткани. Гиалиновые мембраны формируются за счет комбинации отслоившегося эпителия, белка и отека. Стойкий респираторный дистресс-синдром приводит к бронхолегочной дисплазии, характеризующейся типичными рентгенологическими данными грудной клетки и хронической кислородной зависимостью. Синдром связан с рецидивирующими хрипами у детей и более высоким риском госпитализации по поводу астмы. 9
Диагноз респираторного дистресс-синдрома следует заподозрить, если у недоношенного ребенка сразу после рождения возникают хрюканье, ретракция или другие типичные симптомы дистресса. Часто возникают гипоксия и цианоз. Рентгенография грудной клетки показывает гомогенные непрозрачные инфильтраты и воздушные бронхограммы, указывающие на контраст безвоздушной ткани легкого по сравнению с заполненными воздухом бронхами 5 (рис. 2) ; также могут быть обнаружены уменьшенные объемы легких.
Правообладатель не предоставил права на воспроизведение данного объекта на электронных носителях. Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Синдром аспирации мекония
Окрашенные меконием амниотические жидкости встречаются примерно в 15 процентах родов, вызывая синдром аспирации мекония у младенцев в 10–15 процентах таких случаев, как правило, у доношенных и переношенных детей. 10 Меконий состоит из слущенных клеток, секрета, лануго, воды, желчных пигментов, панкреатических ферментов и амниотической жидкости. Несмотря на стерильность, меконий оказывает местно-раздражающее, обструктивное действие и является средой для культивирования бактерий. Отхождение мекония может свидетельствовать о гипоксии или дистрессе плода внутриутробно. Аналогичные симптомы могут возникать после аспирации крови или неокрашенных околоплодных вод.
Синдром аспирации мекония вызывает значительный респираторный дистресс сразу после родов. Гипоксия возникает из-за того, что аспирация происходит внутриутробно. Рентгенография грудной клетки показывает очаговый ателектаз или консолидацию 5 (рис. 3) .
Гипоксия возникает из-за того, что аспирация происходит внутриутробно. Рентгенография грудной клетки показывает очаговый ателектаз или консолидацию 5 (рис. 3) .
Правообладатель не предоставил права на воспроизведение данного объекта на электронных носителях. Отсутствующий элемент см. в оригинальной печатной версии этой публикации.
Инфекция
Бактериальная инфекция является еще одной возможной причиной респираторного дистресс-синдрома у новорожденных. Общие патогены включают стрептококки группы B (GBS), Staphylococcus aureus, Streptococcus pneumoniae и грамотрицательные кишечные палочки. Пневмония и сепсис имеют различные проявления, в том числе типичные признаки дистресса, а также нестабильность температуры. В отличие от транзиторного тахипноэ, респираторного дистресс-синдрома и синдрома аспирации мекония, для развития бактериальной инфекции требуется время, а респираторные последствия проявляются через несколько часов или дней после рождения.
Факторы риска пневмонии включают длительное излитие плодных оболочек, недоношенность и лихорадку матери. Профилактика инфекции GBS посредством всеобщего скрининга и дородового лечения снижает частоту ранних заболеваний, включая пневмонию и сепсис, на 80 процентов. 11 Текущий протокол США предписывает проводить скрининг на СГБ у всех беременных на поздних сроках беременности и лечить тех, у кого положительный результат, интранатальным введением антибиотиков не менее чем за четыре часа до родов. 12
Рентгенография грудной клетки помогает в диагностике двусторонних инфильтратов, предполагающих инфекцию внутриутробно. Плевральные выпоты присутствуют в двух третях случаев. 13 Можно получить серийный посев крови для последующей идентификации инфекционного организма.
Менее распространенные причины
Пневмоторакс, определяемый как наличие воздуха в плевральной полости, может быть причиной респираторного дистресс-синдрома у новорожденных, когда давление в легочной полости превышает экстраплевральное давление. Может возникать спонтанно или в результате инфекции, аспирации мекония, деформации легких или вентиляционной баротравмы. Частота спонтанного пневмоторакса у доношенных новорожденных составляет 1–2% [9].0173 14 , но при преждевременных родах этот показатель увеличивается примерно до 6 процентов. 15
Может возникать спонтанно или в результате инфекции, аспирации мекония, деформации легких или вентиляционной баротравмы. Частота спонтанного пневмоторакса у доношенных новорожденных составляет 1–2% [9].0173 14 , но при преждевременных родах этот показатель увеличивается примерно до 6 процентов. 15
Стойкая легочная гипертензия у новорожденных возникает, когда сопротивление легочных сосудов не снижается вскоре после рождения, как при нормальном переходе. Этиология может быть идиопатической или вторичной по отношению к синдрому аспирации мекония, пневмонии или сепсису, респираторному дистресс-синдрому или транзиторному тахипноэ новорожденных. Использование матерью селективных ингибиторов обратного захвата серотонина в третьем триместре также имеет значение. 16
Некоторые врожденные пороки развития могут привести к дыхательной недостаточности; к ним относятся гипоплазия легких, врожденная эмфизема, атрезия пищевода и диафрагмальная грыжа. Обструкция верхних дыхательных путей из-за атрезии хоан или сосудистых колец может привести к аналогичным результатам. Обструктивные поражения включают атрезию хоан, макроглоссию, синдром Пьера Робина, лимфангиому, тератому, массы средостения, кисты, подскладочный стеноз и ларинготрахеомаляцию. Также может быть замешан врожденный порок сердца. Цианотическая болезнь сердца включает транспозицию магистральных артерий и тетраду Фалло. Нецианотические поражения сердца могут вызвать состояние легочного переполнения, ведущее к застойной сердечной недостаточности. Эти поражения включают большие дефекты перегородки, открытый артериальный проток и коарктацию аорты. Пороки развития иногда можно обнаружить на дородовой визуализации.
Обструктивные поражения включают атрезию хоан, макроглоссию, синдром Пьера Робина, лимфангиому, тератому, массы средостения, кисты, подскладочный стеноз и ларинготрахеомаляцию. Также может быть замешан врожденный порок сердца. Цианотическая болезнь сердца включает транспозицию магистральных артерий и тетраду Фалло. Нецианотические поражения сердца могут вызвать состояние легочного переполнения, ведущее к застойной сердечной недостаточности. Эти поражения включают большие дефекты перегородки, открытый артериальный проток и коарктацию аорты. Пороки развития иногда можно обнаружить на дородовой визуализации.
Неврологические расстройства, такие как гидроцефалия и внутричерепное кровоизлияние, могут вызывать дыхательную недостаточность. Центральное угнетение дыхания может возникнуть после воздействия на мать лекарств, в том числе обезболивающих родов и запрещенных наркотиков.
Метаболические и гематологические нарушения (например, гипогликемия, гипокальциемия, полицитемия, анемия) также могут вызывать респираторные симптомы.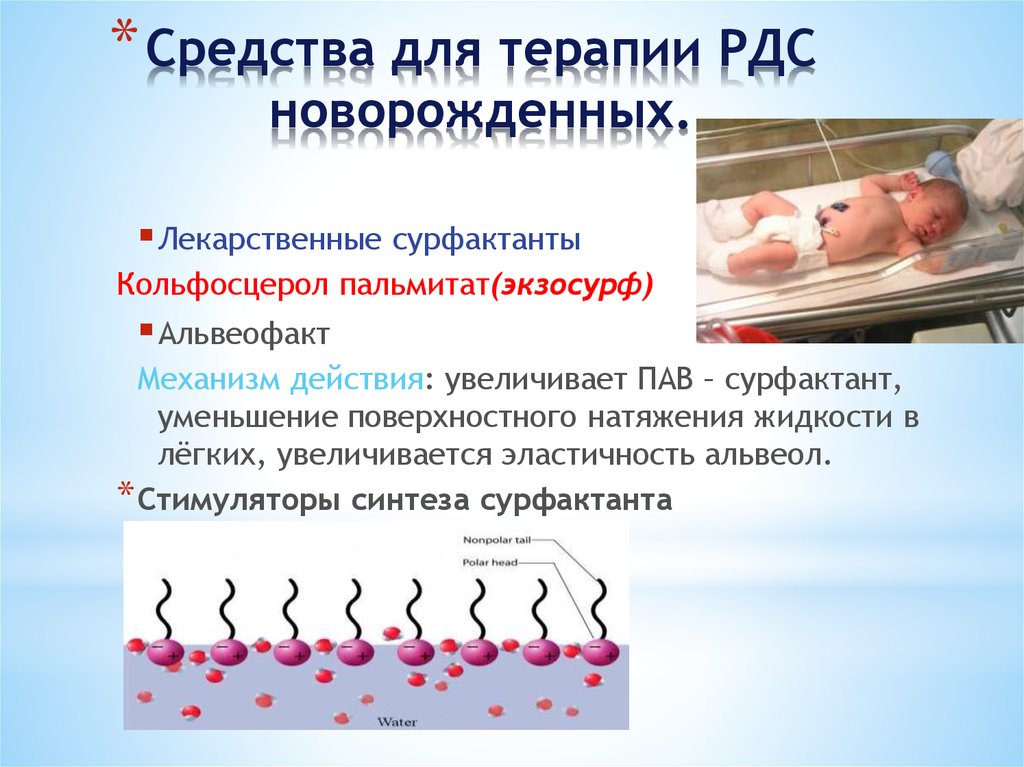 Следует также учитывать врожденные нарушения метаболизма.
Следует также учитывать врожденные нарушения метаболизма.
Наконец, небольшое, но значительное число младенцев не соответствует ранее описанным закономерностям. Отсроченный переход диагностируется ретроспективно, когда симптомы исчезают в течение первых нескольких часов жизни, а не прогрессируют в виде респираторного дистресс-синдрома, транзиторного тахипноэ новорожденных или синдрома аспирации мекония. Этиология, скорее всего, представляет собой сочетание задержки жидкости и неполного расширения альвеол. Лечение поддерживающее до тех пор, пока дистресс не исчезнет в течение нескольких часов после завершения перехода.
Лечение
Лечение респираторного дистресса новорожденных может быть как генерализованным, так и специфичным для заболевания. Врачи должны быть осведомлены о текущих протоколах реанимации новорожденных. Оксигенацию можно усилить продувкой кислородом, носовой канюлей или механической вентиляцией легких в тяжелых случаях. Может потребоваться введение сурфактанта. Антибиотики часто назначают при подозрении на бактериальную инфекцию клинически или из-за лейкоцитоза, нейтропении или гипоксемии. Ампициллин и гентамицин часто используются вместе из-за их эффективности и синергизма. 12 Экстракорпоральная мембранная оксигенация, аналогичная искусственному внешнему легкому, используется в качестве крайней меры в критических обстоятельствах. Оральное кормление часто прекращают, если частота дыхания превышает 80 вдохов в минуту.
Антибиотики часто назначают при подозрении на бактериальную инфекцию клинически или из-за лейкоцитоза, нейтропении или гипоксемии. Ампициллин и гентамицин часто используются вместе из-за их эффективности и синергизма. 12 Экстракорпоральная мембранная оксигенация, аналогичная искусственному внешнему легкому, используется в качестве крайней меры в критических обстоятельствах. Оральное кормление часто прекращают, если частота дыхания превышает 80 вдохов в минуту.
При возникновении пневмоторакса может потребоваться декомпрессия иглой или дренирование плевральной полости. Небольшой пневмоторакс у доношенных детей можно лечить без инвазивного лечения путем вымывания азотом. Введение 100% кислорода может ускорить разрешение пневмоторакса, поскольку легко поглощаемый кислород замещает азот во внелегочном пространстве. Этот метод может сократить продолжительность пневмоторакса с двух дней до восьми часов. 17
Поскольку данные о специфическом лечении респираторного дистресс-синдрома у новорожденных продолжают развиваться, семейным врачам следует работать совместно с неонатологами-реаниматологами. Если услуги, необходимые для новорожденного, недоступны в учреждении семейного врача, помощь следует перевести в больницу с более высоким уровнем неотложной помощи.
Если услуги, необходимые для новорожденного, недоступны в учреждении семейного врача, помощь следует перевести в больницу с более высоким уровнем неотложной помощи.
ТРЕНИРУЮЩЕЕ ТАХИПНОЭ НОВОРОЖДЕННЫХ
Лечение транзиторного тахипноэ новорожденных является поддерживающим, поскольку это состояние обычно самокупируется. Не было показано, что пероральный фуросемид (лазикс) значительно улучшает состояние, и его не следует назначать. 18 Данные свидетельствуют о том, что пренатальное введение кортикостероидов за 48 часов до планового кесарева сечения на сроке беременности от 37 до 39 недель снижает частоту транзиторного тахипноэ у новорожденных; однако это не стало обычной практикой. 19
РЕСПИРАТОРНЫЙ ДИСТРЕСС-СИНДРОМ
Лечение респираторного дистресс-синдрома часто требует некоторых из упомянутых общих вмешательств. Кроме того, пренатальное введение кортикостероидов между 24 и 34 неделями гестации снижает риск респираторного дистресс-синдрома при высоком риске преждевременных родов с отношением шансов 0,53. 20 Послеродовое введение кортикостероидов при респираторном дистресс-синдроме может снизить риск смертности, но может увеличить риск церебрального паралича. 21 Вдыхание оксида азота может облегчить сопутствующую персистирующую легочную гипертензию у новорожденных, но его использование у недоношенных детей является экспериментальным. 22
20 Послеродовое введение кортикостероидов при респираторном дистресс-синдроме может снизить риск смертности, но может увеличить риск церебрального паралича. 21 Вдыхание оксида азота может облегчить сопутствующую персистирующую легочную гипертензию у новорожденных, но его использование у недоношенных детей является экспериментальным. 22
СИНДРОМ АСПИРАЦИИ МЕКОНИЯ
При синдроме аспирации мекония часто используются общие методы лечения. Стандартная профилактика и лечение синдрома аспирации мекония ранее включала отсасывание изо рта и ноздрей при родах головы перед родами тела. Однако последние данные свидетельствуют о том, что аспирация происходит внутриутробно, а не при родах; поэтому аспирация не должна препятствовать родоразрешению. 23 После полных родов новорожденного следует передать в неонатальную бригаду для обследования и лечения. Хотя младенцам ранее проводилась интубация и отсасывание из дыхательных путей, текущие данные свидетельствуют в пользу выжидательной тактики, за исключением случаев, когда отсутствуют определенные критерии (т. 24
24
Метаанализы показали, что амниоинфузия снижает аспирацию густого мекония. 25,26 Недавнее хорошо спланированное рандомизированное многоцентровое исследование с участием 1998 женщин показало, что амниоинфузия мекония (даже густого мекония) не снижает частоту синдрома аспирации мекония или перинатальной смерти. 27 Недостаточно доказательств, чтобы рекомендовать назначение стероидов. 28
Оценка
Подробная история имеет решающее значение для правильной оценки. Дифференциальный диагноз меняется в зависимости от гестационного возраста: респираторный дистресс-синдром обычно поражает недоношенных детей, тогда как синдром аспирации мекония поражает доношенных или переношенных новорожденных. Статус инфекции до родов важен, особенно в отношении статуса инфекции GBS и профилактики. Информация о продолжительности разрыва, цвете амниотической жидкости, температуре тела матери, тахикардии матери и статусе кардиограммы плода имеет жизненно важное значение для выявления аспирации мекония и хориоамнионита. Семейный анамнез помогает выявить наследственные врожденные дефекты. Начало и продолжительность респираторных симптомов также дают подсказки. Транзиторное тахипноэ новорожденных начинается рано и со временем проходит. И наоборот, сепсис и пневмония могут не иметь ранних признаков, но могут развиться через несколько часов или дней. Респираторный дистресс-синдром начинается рано у недоношенных детей без признаков спонтанного улучшения.
Семейный анамнез помогает выявить наследственные врожденные дефекты. Начало и продолжительность респираторных симптомов также дают подсказки. Транзиторное тахипноэ новорожденных начинается рано и со временем проходит. И наоборот, сепсис и пневмония могут не иметь ранних признаков, но могут развиться через несколько часов или дней. Респираторный дистресс-синдром начинается рано у недоношенных детей без признаков спонтанного улучшения.
Медицинский осмотр также полезен. При общей оценке врачи должны искать апноэ, тахипноэ или цианоз. При аускультации сердца выявляются шумы, указывающие на врожденные пороки сердца. Аускультация легких может выявить асимметричное движение грудной клетки при пневмотораксе или хрипы при пневмонии или быть полностью чистым при транзиторном тахипноэ или стойкой легочной гипертензии у новорожденных.
Тяжесть дистресса следует оценивать при первоначальной оценке. Легкий дистресс может потребовать наблюдения и пульсоксиметрии. Тяжелый дистресс, особенно при осложненном анамнезе, требует немедленных реанимационных мероприятий, рентгенографии грудной клетки и лабораторных исследований.
