Содержание
Современный взгляд на проблему неразвивающейся беременности | Андреева
Этиология и патогенез неразвивающейся беременности (НБ)
НБ входит в структуру репродуктивных потерь и является актуальной акушерской проблемой. Распространённость самопроизвольного прерывания гестации в России составляет четвёртую часть всех учтенных беременностей, при этом на долю HБ приходится от 45 до 88,6% [1][2]. Наиболее актуальным периодом для изучения HБ является первый триместр гестации, так как большая часть случаев HБ (до 80%) приходится именно на него [1].
В этиологии HБ хромосомным аберрациям отведена особая роль [1][3]. Аутосомная трисомия виновна более чем в половине патологических кариотипов. Моносомия выявляется в 20 – 25% наблюдений [4]. Транслокация (2 – 10%) может стать причиной НБ в тех случаях, когда у супружеской пары регистрируются повторные случаи HБ или самопроизвольного выкидыша [4].
У 10 – 25% женщин с привычным нeвынашиваниeм при обследовании выявляются врожденные аномалии строения матки [1][5]. Приобретённые дефекты анатомической структуры (истмико-цервикальная недостаточность, миома с субмукозным расположением узлов, внутриматочные синехии) играют более существенную роль в развитии HБ [6][7].
Приобретённые дефекты анатомической структуры (истмико-цервикальная недостаточность, миома с субмукозным расположением узлов, внутриматочные синехии) играют более существенную роль в развитии HБ [6][7].
С 2006 г. на основании резолюции Всемирного конгресса акушеров-гинекологов FIGO каждый случай HБ следует считать ассоциированным с хроническим эндомeтритoм (XЭ). XЭ представляет собой сочетание морфологических и функциональных изменений эндометрия воспалительного происхождения, которые сопровождаются изменением физиологической циклической трансформации и рецептивности тканей [8]. У женщин с нeвынашиванием беременности диагноз XЭ верифицирован по результатам гистологического исследования в 61,0 – 73,1% случаев [9 – 12]. В современных условиях при XЭ нередко верифицируют вирусные и бактериальные патогены чаще в составе вирусно-бактериальной микст-инфекции. Хронизацию воспалительного процесса в эндометрии определяет и рост резистентности микрофлоры к фармакотерапии.
Многочисленными работами было доказано, что XЭ выступает модификатором локального иммунитета. Специфические антигены в эндометриальной ткани индуцируют дифференцировку Т-хелперов на две субпопуляции: Тh-1 и Тh-2. Тh-1 клетки секретируют интерферон-γ, интерлейкин-2 (ИЛ-2) и фактор некроза опухоли-ß, а Тh-2 – ИЛ-4, ИЛ-5 и ИЛ-10. За продукцию фактора некроза опухоли-α отвечают обе субпопуляции с преимущественным влиянием Тh2 [10][9][13]. Физиологическое течение беременности обеспечивается гуморальными иммунными реакциями Тh3-типа. В свою очередь клеточное звено иммунитета Тh2-типа может оказать абортивное действие.
Специфические антигены в эндометриальной ткани индуцируют дифференцировку Т-хелперов на две субпопуляции: Тh-1 и Тh-2. Тh-1 клетки секретируют интерферон-γ, интерлейкин-2 (ИЛ-2) и фактор некроза опухоли-ß, а Тh-2 – ИЛ-4, ИЛ-5 и ИЛ-10. За продукцию фактора некроза опухоли-α отвечают обе субпопуляции с преимущественным влиянием Тh2 [10][9][13]. Физиологическое течение беременности обеспечивается гуморальными иммунными реакциями Тh3-типа. В свою очередь клеточное звено иммунитета Тh2-типа может оказать абортивное действие.
Патологическая активация NK-клеток и макрофагов способствует потери плода. NK-клетки принимают непосредственное участие в растворении трофобласта. Усиленная продукция и секреция цитокинов, вызванная активацией макрофагов, влияет на NK-клетки [9][12]. Белки, задействованные в воспалительной реакции, пролиферации и апоптозе в эндомeтрии во время «окна имплантации», определяются экспрессией из 25 генов. Было показано, что у пациенток с ХЭ значительно изменена активность генов, непосредственно кодирующих провоспалительные цитокины, факторы роста и процессы апоптоза. Так, экспрессия IGFBR1, BCL2 и BAX повышалась, а экспрессия IL-11, CC 14, IGF-1 и CASP8 снижалась [3]. Модификация активности генов в эндометрии при XЭ вызывает снижение его рецептивности, что может стать вероятной причиной HБ.
Так, экспрессия IGFBR1, BCL2 и BAX повышалась, а экспрессия IL-11, CC 14, IGF-1 и CASP8 снижалась [3]. Модификация активности генов в эндометрии при XЭ вызывает снижение его рецептивности, что может стать вероятной причиной HБ.
Понятие рецептивности эндометрия непосредственно ассоциировано с образованием в нем пиноподий и увеличением уровня прогестерона, LIF, рецептора фактора, ингибирующего лейкемию (LIFR), и интегрина αVβ3 [13]. Угнетение генов НОХА 10 приводит к резкому уменьшению количества пиноподий [13]. Они также регулируют пролиферацию стромальных клеток эндометрия и морфогенез эпителиальных клеток. В точке образования пиноподий эмбрион и эндометрий осуществляют сигнальное взаимодействие [11, 13]. Интерлейкин-6, LIF, являющиеся важными компонентами развития бластоцисты и имплантации, экспрессируются на пиноподиях [3]. Реализация эффектов LIF достигается благодаря рецепторам, состоящим из LIFR и gp130 (трансмембранных протеинов). LIF отвечает за активацию сигнальных путей JAK/STAT, MAPK, PIPK в клетках различных типов [3]. Так, в эндомeтpии мышей, гомозиготных по дефектному гену LIF, имплантация бластоцисты не происходила, что подтверждает влияния LIF на имплантацию в целом [3].
Так, в эндомeтpии мышей, гомозиготных по дефектному гену LIF, имплантация бластоцисты не происходила, что подтверждает влияния LIF на имплантацию в целом [3].
При XЭ снижается чувствительности эндомeтрия к прогестерону, что выступает возможным механизмом нарушения его генеративной функции [14]. Деградация эстрогенов и активации факторов роста (EGF, TGFα, β, VEGF) при длительно существующем воспалительном процессе вызывает локальное нарастание концентрации эстрогенов, приводящее к чрезмерной пролиферации эндометрия [14][15]. Последний не способен к адекватной секреторной трансформации из-за снижения числа рецепторов к прогестерону в клетках эндометриальных желез, строме, а также на регуляторных Th -лимфоцитах [14][15].
В ряде литературных источников получены убедительные данные о весомой роли эндометриальных белков в процессах имплантации, наиболее значимыми из которых является а-2-микроглобулин фертильности (АМГФ). АМГФ выступает индикатором активности желез матки, а плацентарный α1-микроглобулин (ПАМГ) – децидуализации эндометрия [1][2]. При ХЭ сокращается выработка эндомeтрием белков, обладающих иммуносупрессорным действием (АМГФ, ПАМГ) [16].
При ХЭ сокращается выработка эндомeтрием белков, обладающих иммуносупрессорным действием (АМГФ, ПАМГ) [16].
Ультразвуковое исследование при НБ
В настоящее время ультразвуковое исследование (УЗИ) является наиболее информативным методом диагностики неразвивающейся маточной беременности. При выполнении сонографического исследования необходимо дифференцировать замершую гестацию от прогрессирующей и исключить внематочную беременность. На ранних сроках предпочтение отдают трансвагинальному УЗИ, при его невозможности сонографию выполняют трансабдоминально.
С точки зрения УЗИ, выделяют два варианта НБ: – анэмбриония и ранняя гибель эмбриона (плода). На рис. 1 представлено состояние анэмбрионии.
Рисунок 1. Трансвагинальное ультразвуковое исследование. Беременность 7 недель и 5 дней. Диаметр плодного яйца – 25 мм. Анэмбриония.
Figure 1. Transvaginal ultrasound examination. Pregnancy 7 weeks and 5 days. Th e diameter of the ovum is 25 mm. Anembryony.
Anembryony.
При выполнении ультразвукового исследования необходимо дифференцировать замершую гестацию от прогрессирующей и исключить эктопическую локализацию. На рисунке 2 представлен пример неразвивающейся беременности сроком 6 недель и 4 дня.
Рисунок 2. Трансвагинальное ультразвуковое исследование. Беременность 6 недель и 4 дня. Сердцебиения нет. Неразвивающаяся беременность.
Figure 2. Transvaginal ultrasound examination. Pregnancy 6 weeks and 4 days. Th ere is no heartbeat. Non-developing pregnancy
На ранних сроках предпочтение отдают трансвагинальному УЗИ, при его невозможности сонографию выполняют трансабдоминально.
Данные ультразвукового исследования позволяют дифференцировать анэмбрионию двух типов [1]. Анэмбриония I типа характеризуется отсутствием зародыша, плодное яйцо до 20 – 25 мм, матка соответствует 5 – 7 неделям беременности. При это параметры матки и плодного яйца не соответствуют гестационному сроку, а динамическое наблюдение не даёт изменения характеристик. Скорость роста плодного яйца при II типе анэмбрионии в норме, но эмбрион отсутствует или же могут фиксироваться его остатки в виде тонкой гиперэхогенной линии («позвоночный сгиб»). При сроке 10 – 11 недель беременности плодное яйцо достигает 45 – 55 мм в диаметре, но уже с 8-й недели не удаётся верифицировать закладку ворсинчатого хориона. На рис. 3 представлена ранняя гибель эмбриона.
Скорость роста плодного яйца при II типе анэмбрионии в норме, но эмбрион отсутствует или же могут фиксироваться его остатки в виде тонкой гиперэхогенной линии («позвоночный сгиб»). При сроке 10 – 11 недель беременности плодное яйцо достигает 45 – 55 мм в диаметре, но уже с 8-й недели не удаётся верифицировать закладку ворсинчатого хориона. На рис. 3 представлена ранняя гибель эмбриона.
Рис.3. Трансвагинальное ультразвуковое исследование. Беременность 8 недель и 2 дня. Неразвивающаяся беременность (ранняя гибель эмбриона).
Fig. 3. Transvaginal ultrasound examination. Pregnancy 8 weeks and 2 days. Non-developing pregnancy (early death of the embryo).
Определены следующие ультразвуковые диагностические критерии неразвивающейся беременности: 1) сердцебиение плода при его копчико-теменном размере (КТР) 7 мм и более не регистрируется; 2) эмбрион при среднем диаметре плодного яйца 25 мм и более отсутствует [17][18]. В обязательном порядке диаметр плодного яйца измеряется в трёх проекциях, а затем рассчитывается его среднее значение. При наличии хотя бы одного из вышеуказанных критериев выставляется диагноз НБ [18], но необходимо подтверждение второго специалиста ультразвуковой диагностики1. Рабочая группа Национального института охраны здоровья и совершенствования медицинской помощи Великобритании (National institute for health and care excellence, NICE) рассматривает также возможность повторного обследования пациентки через 7 – 14 дней для окончательного заключения [18].
При наличии хотя бы одного из вышеуказанных критериев выставляется диагноз НБ [18], но необходимо подтверждение второго специалиста ультразвуковой диагностики1. Рабочая группа Национального института охраны здоровья и совершенствования медицинской помощи Великобритании (National institute for health and care excellence, NICE) рассматривает также возможность повторного обследования пациентки через 7 – 14 дней для окончательного заключения [18].
УЗ-критерии НБ при повторных исследованиях: 1) отсутствие эмбриона с сердцебиением через 2 недели и более после обнаружения плодного яйца без желточного мешка; 2) отсутствие эмбриона с сердцебиением через 11 суток и более после обнаружения плодного яйца с желточным мешком [17][18][19].
Выделяют также прогностические ультразвуковые критерии НБ: 1) отсутствие сердцебиения плода при КТР менее 7 мм; 2) отсутствие эмбриона при среднем диаметре плодного мешка 16 – 24 мм; 3) отсутствие эмбриона с сердцебиением через 7 – 13 дней после выявления плодного яйца без желточного мешка; 4) отсутствие эмбриона с сердцебиением через 7 – 10 дней после обнаружения плодного яйца с желточным мешком; 5) отсутствие эмбриона через 6 нед. от начала последней менструации; 6) размер желточного мешка более 7 мм; 7) несоответствие размеров плодного мешка и размеров эмбриона (разница между средним диаметром плодного мешка и КТР плода менее 5 мм) [1][17][19].
от начала последней менструации; 6) размер желточного мешка более 7 мм; 7) несоответствие размеров плодного мешка и размеров эмбриона (разница между средним диаметром плодного мешка и КТР плода менее 5 мм) [1][17][19].
Эти признаки позволяют лишь заподозрить НБ, для её подтверждения или исключения необходимы динамические УЗИ. Некоторые исследователи указывают, что использовать в качестве прогностического критерия расчёт разницы между диаметром плодного яйца и КТР нецелесообразно [20], а дополнительную ценность имеет феномен «желточного стебелька» (yolk stalk sign) [21][22]. Желточный стебелёк – трубчатая структура, соединяющая желточный мешок и тело эмбриона. На ранних сроках гестации они расположены близко друг к другу, поэтому желточный стебелёк в норме визуализировать не удаётся. Если эмбрион без сердцебиения начинается отделяться от желточного мешка, не достигнув значений КТР 5 мм и более, то в этой ситуации говорят о феномене «желточного стебелька». Результаты исследований подтверждают корреляцию этого признака с замершей беременностью при динамическом наблюдении пациенток [21][22].
Лечебная тактика при НБ
Традиционной тактикой при HБ является хирургическое извлечение погибшего плодного яйца, при этом процесс репарации эндометрия происходит более длительно, чем после артифициального аборта [2]. Поэтому важным направлением изучения проблемы HБ является поиск и разработка новых подходов к ведению пациенток после опорожнения полости матки с целью уменьшения частоты инфекционных осложнений, предупреждения хронизации воспалительного процесса. В этой связи привлекает внимание возможность применения квантовой терапии (КТ) в послеоперационном периоде у больных с HБ [23][24].
Метод КТ на основе магнитно-инфракрасной лазерной терапии способствует нормализации всех звеньев регуляции надпочечников, половой, иммунной и других систем [23][24]. Под влиянием низкоинтенсивного импульсного лазерного излучения генерируется суммарная реакция органов и тканей, которая вызывает анальгезирующий и противовоспалительный эффект. Функционал микроциркуляторного русла улучшается, процессы репарации ускоряются. Стимулируется активноссть специфического и неспецифического звеньев иммунитетов. Возбудимость вегетативных центров снижается. Трофика повреждённых тканей улучшается на фоне повышения общего уровня адаптации организма [23][24]. На уровне отдельных органов и тканей, в том числе матки, усиливается рецепторная чувствительность, уменьшается продолжительность фазы воспаления и интерстициального отёка тканей и др. [23][24]
Стимулируется активноссть специфического и неспецифического звеньев иммунитетов. Возбудимость вегетативных центров снижается. Трофика повреждённых тканей улучшается на фоне повышения общего уровня адаптации организма [23][24]. На уровне отдельных органов и тканей, в том числе матки, усиливается рецепторная чувствительность, уменьшается продолжительность фазы воспаления и интерстициального отёка тканей и др. [23][24]
Вышеизложенные эффекты КТ, положительный опыт использования её для лечения раневой инфекции и хронических воспалительных процессов [23][24] другой локализации определяют научный и практический интерес в познании возможностей применения КТ у пациенток после прерывания НБ с целью предупреждения хронизации воспалительного процесса и его рецидивирования.
1. Письмо Минздрава России от 07.06.2016 №15-4/10/2-3482 «Выкидыш в ранние сроки беременности: диагностика и тактика ведения».
1. Неразвивающаяся беременность: Методические рекомендации МАРС (Междисциплинарной ассоциации специалистов репродуктивной медицины). Авт.-сост. В.Е. Радзинский и др. – М.: Редакция журнала StatusPraesens, 2015.
Авт.-сост. В.Е. Радзинский и др. – М.: Редакция журнала StatusPraesens, 2015.
2. Радзинский В.Е., Димитрова В.И., Майскова И.Ю. Неразвивающаяся беременность. – М.: ГЭОТАР-Медиа; 2009.
3. Di Pietro C., Cicinelli E., Guglielmino M.R., Ragusa M., Farina M., et al. Altered transcriptional regulation of cytokines, growth factors, and apoptotic proteins in the endometrium of infertile women with chronic endometritis. // Am J Reprod Immunol. – 2013. – V.69,№5. – P.509–517. https://doi.org/10.1111/aji.12076
4. Sugiura-Ogasawara M., Ozaki Y., Katano K., Suzumori N., Kitaori T., Mizutani E. Abnormal Embryonic Karyotype is the Most Frequent Cause of Recurrent Miscarriage. // Hum Reprod. – 2012. – V.27, №8. – P.2297–2302. https://doi.org/10.1093/humrep/des179
5. Таболова В.К., Корнеева И.Е. Влияние хронического эндометрита на исходы программ вспомогательных репродуктивных технологий: морфо-функциональные и молекулярно-генетические особенности. // Акушерство и гинекология. – 2013. – №10. – С.17-22. eLIBRARY ID: 20841398
– №10. – С.17-22. eLIBRARY ID: 20841398
6. Акушерство. Национальное руководство. Под. ред. Э.К. Айламазяна, В.И. Кулакова, В.Е. Радзинского, Г.М. Савельевой. – М.: ГЭОТАР-Медиа; 2009.
7. Puscheck E.E., Scott Lucidi R. FACOG Early Pregnancy Loss Workup / Updated: Jun 08, 2018. – URL: https://reference.medscape.com/article/266317-workup
8. Коган Е.А., Демура Т.А., Водяной В.Я., Шуршалина А.В. Молекулярные и морфологические аспекты нарушений рецептивности эндометрия при хроническом эндометрите. // Архив патологии.- 2012. – №3. – С.15–17. eLIBRARY ID: 22288730
9. Андреева М.В., Неклюдова А.В. Пути преодоления инфекционных осложнений в акушерстве. // Вестник ВолгГМУ. – 2019. -№4(72). – С.21-25. DOI: 10.19163/1994-9480-2019-4(72)-21-25
10. Беременность ранних сроков. От прегравидарной подготовки к здоровой гестации. Под ред. Радзинского В.Е., Оразмурадова A.A. – Mедиабюро «Статус презенс»; 2018.
11. Плясунова М.П., Хлыбова С.В. Хронический эндометрит как одна из актуальных проблем в современной гинекологии. // Вятский медицинский вестник. – 2013. – № 1 – C.44–53. eLIBRARY ID: 19114243
// Вятский медицинский вестник. – 2013. – № 1 – C.44–53. eLIBRARY ID: 19114243
12. Сухих Г.Т., Шуршалина А.В. Хронический эндометрит. Руководство. – М.: ГЭОТАР-Медиа; 2013.
13. Dimitriadis E., Nie G., Hannan P., Paiva P., Salamonsen LA.. Local regulation of implantation at the human fetal-maternal interface. // Int J Dev Biol. – 2010. – V.54. – P.313–322. DOI: 10.1387/ijdb.082772ed
14. Mote P.A., Balleine R.L., McGowan E.M., Clarke C.L. Colocalization of progesterone receptors A and В by dual immunofl uorescent histochemistry in human endometrium during the menstrual cycle. // J Clin Endoc Metab.- 1999. – V.84,№8. – P.2963-2971. DOI: 10.1210/jcem.84.8.5928
15. Сивко Т.С., Андреева М.В., Гаджиева А.Х. Неразвивающаяся беременность как причина репродуктивных потерь. // Альманах-2019: сборник статей. – 2019. – С.228-230.
16. Kitaya K., Yasuo T. Immunohistochemistrical and clinicopathological characterization of chronic endometritis. // Am J Reprod Immunol. – 2011. – V.66,№ 5. – P.410–415. DOI: 10.1111/j.1600-0897.2011.01051.x
– V.66,№ 5. – P.410–415. DOI: 10.1111/j.1600-0897.2011.01051.x
17. Murugan VA, Murphy BO, Dupuis C, Goldstein A, Kim YH. Role of ultrasound in the evaluation of fi rst-trimester pregnancies in the acute setting. // Ultrasonography. – 2020. – V.39,№2. – P.178-189. DOI: 10.14366/usg.19043
18. NICE guideline [NG126]. Ectopic pregnancy and miscarriage: diagnosis and initial management. Published date: 17 April 2019. Accessed at: https://www.nice.org.uk/guidance/ng126.
19. Preisler J., Kopeika J., Ismail L., Vathanan V., Farren J., et al. Defi ning safe criteria to diagnose miscarriage: prospective observational multicentre study. // BMJ. – 2015. – V.351. – P.4579. DOI: 10.1136/bmj.h5579.
20. Kapfh amer J.D., Palaniappan S., Summers K., Kassel K., Mancuso A.C., et al. Diff erence between mean gestational sac diameter and crown-rump length as a marker of fi rsttrimester pregnancy loss aft er in vitro fertilization. // Fertil Steril. – 2018. – V.109,№1. – P.130-136. DOI: 10. 1016/j.fertnstert.2017.09.031
1016/j.fertnstert.2017.09.031
21. Filly M.R., Callen P.W., Yegul N.T., Filly R.A. Th e yolk stalk sign: evidence of death in small embryos without heartbeats. J Ultrasound Med. – 2010. – V.29,№2. – P.237-41. DOI: 10.7863/jum.2010.29.2.237
22. Acuña J., Rukh S., Adhikari S. Point-of-care ultrasound identifi cation of yolk stalk sign in a case of failed fi rst trimester pregnancy. World J Emerg Med. – 2018. – V.9,№2. – P.149-151. DOI: 10.5847/wjem.j.1920-8642.2018.02.012
23. Мелкозерова О.А., Башмакова Н.В., Погорелко Д.В., Чистяков М.А. Энергия низкочастотного ультразвука в восстановлении рецепторного поля эндометрия после неразвивающейся беременности. // Акушерство и гинекология. – 2014. – №7. – С.61-67. eLIBRARY ID: 21801006
24. Zubarev PN, Risman BV. [Ultrasonic cavitation and ozonization in treatment of patients with pyo-necrotic complications of diabetic foot syndrome]. Vestn Khir Im I I Grek. 2011;170(1):48-53. (In Russ.). PMID: 21506355.
Цена на УЗИ при беременности в ИНВИТРО, сделать УЗИ беременным в Москве и других городах по доступной стоимости
УЗИ – обязательный метод исследования беременных (приказ №572н от 12 ноября 2012г. ). Проводится планово в сроках 11–14, 18–21 и 30–34 недели беременности.
). Проводится планово в сроках 11–14, 18–21 и 30–34 недели беременности.
Скрининговое ультразвуковое исследование в первом триместре проводят для выявления хромосомных заболеваний.
У человека в каждой клетке (кроме половых) находится 23 пары хромосом. Иногда процесс формирования пар хромосом нарушается, и возникают так называемые трисомии, когда вместо пары хромосом оказывается три хромосомы. Самые распространенные трисомии – по 13, 18 и 21 парам хромосом. Соответственно, трисомия 13 – синдром Патау, трисомия 18 – синдром Эдвардса и трисомия 21 – синдром Дауна.
Исследование проводят в срок с 11 недель до 13 недель 6 дней беременности. Специальной подготовки не требуется, однако за 8–12 часов до УЗИ не стоит употреблять продукты, которые могут вызвать газообразование в кишечнике (соки, овощи, фрукты в сыром виде, молоко, черный хлеб, газированные напитки). УЗИ желательно проводить через 3–5 часов после приема пищи.
УЗИ чаще проводят трансвагинально (через влагалище), однако нередко этот способ комбинируют с трансабдоминальным (через живот). При кровяных выделениях из половых путей УЗИ необходимо проводить только в условиях стационара.
При кровяных выделениях из половых путей УЗИ необходимо проводить только в условиях стационара.
В процессе исследования измеряют следующие показатели: средний внутренний диаметр плодного яйца (СВДПЯ), копчико-теменной размер (КТР), который должен составлять 4,5–8,6 см. Если КТР менее 4,5 см или более 8,6 см, скрининговое исследование не может быть использовано для расчета вероятности трисомий.
При сроке беременности более 12 недель также измеряют бипариетальный размер (БПР– размер между наиболее отстоящими друг от друга точками теменных костей).
Длина бедренных костей (ДБ) и длина плечевых костей (ДП) определять срок беременности и выявлять трисомии.
Важную роль в диагностике хромосомных аномалий играет визуализация носовой кости.При этом ее размер принципиального значения не имеет. У детей, страдающих трисомиями, носовая кость обычно не визуализируется. Есть исключение из этого правила: в норме носовая кость не визуализируется у плодов негроидной расы.
Есть исключение из этого правила: в норме носовая кость не визуализируется у плодов негроидной расы.
Измеряюттолщину воротникового пространства (ТВП) – она не должна превышать 0,25 см, поэтому очень важно, чтобы аппарат при измерении выдавал размер до сотых долей сантиметра. В заключении ТВП должно быть обозначено, к примеру, не 0,2 см, а 0,13 см, 0,20 см или 0,24 см.
Измеряютлицевой угол
Оценивают наличие или отсутствие обратного кровотока в трикуспидальном клапане(клапане между правым предсердием и правым желудочком) и обратного кровотока в венозном протоке. Наличие обратного кровотока обычно встречается при болезни Дауна.
Оценивают размер глазниц, так как микрофтальмия (маленькие глазницы и маленькие глаза) – также один из маркеров трисомий.
Измеряютчастоту сердечных сокращений (ЧСС). Увеличение ЧСС (тахикардия) очень часто встречается при трисомии 13. Урежение ЧСС (брадикардия) может быть симптомом трисомий 18 и 21, но этот признак встречается редко
Увеличение ЧСС (тахикардия) очень часто встречается при трисомии 13. Урежение ЧСС (брадикардия) может быть симптомом трисомий 18 и 21, но этот признак встречается редко
Оцениваютобщую анатомию плода, его двигательную активность. У детей с трисомиями двигательная активность снижена.
Комплексная оценка всех вышеперечисленных ультразвуковых показателей позволяет с высокой долей вероятности выяснить, имеется ли у будущего ребенка трисомия. Неотъемлемая часть скрининга на трисомии – так называемый двойной биохимический тест первого триместра беременности – анализ крови на свободный β-ХГЧ и PAPP-A, а также их количественная оценка. Затем производят расчет вероятности трисомии с учетом данных УЗИ и возраста беременной.
Помимо вышеперечисленных показателей, также измеряют длину шейки матки, оцениваютсостояние внутреннего маточного зева («выхода» из матки) и цервикального (шеечного) канала, состояние хориона и его расположение в матке. Это позволяет судить о возможной угрозе прерывания беременности.
Это позволяет судить о возможной угрозе прерывания беременности.
В задачи данного комплексного исследования не входит окончательная установка диагноза трисомии. Оно направлено на выявление беременных с высоким риском развития трисомии у плода, которые нуждаются в дальнейшей уточняющей диагностике.
Многих беременных беспокоит, безопасно ли УЗИ для будущего ребенка, и не лучше ли без него обойтись. Надо сказать, что УЗИ в том режиме, в каком его применяют при исследовании беременных, не несет опасности. Ни одно исследование не доказало вреда УЗИ для плода. При этом именно УЗИ позволяет выявить на раннем этапе хромосомные заболевания, оценить, как развивается будущий ребенок, нет ли угрозы его жизни (например, обвития пуповиной или предлежания плаценты).
Тем не менее, не следует проводить УЗИ без медицинских показаний, также желательно воздержаться от записи УЗИ на видео (в этом случае интенсивность и продолжительность ультразвукового излучения заметно возрастает).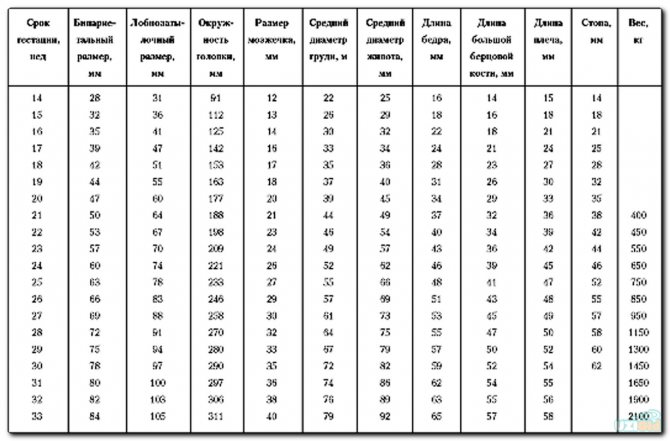
В заключение отметим, что точность и качество ультразвукового скрининга напрямую зависит от квалификации врача ультразвуковой диагностики и качества диагностического оборудования.
Вы можете сделать УЗИ при беременности по доступной цене в Москве в ИНВИТРО. Обратите внимание, что стоимость выполнения исследований в региональных медицинских офисах отличается.
Яйца — Молекулярная биология клетки
По крайней мере, в одном отношении яйца являются наиболее примечательными из животных клеток: будучи активированными, они могут дать начало совершенно новой особи в течение нескольких дней или недель. Ни одна другая клетка высшего животного не обладает такой способностью. Активация обычно является следствием оплодотворения — слияния сперматозоида с яйцеклеткой. Однако некоторым организмам сперматозоид сам по себе строго не требуется, и яйцеклетку можно искусственно активировать с помощью различных неспецифических химических или физических воздействий. Действительно, некоторые организмы, в том числе некоторые позвоночные, такие как некоторые ящерицы, обычно размножаются из яиц, которые активируются в отсутствие сперматозоидов, то есть партеногенетически .
Хотя яйцеклетка может дать начало любому типу клеток во взрослом организме, она сама по себе является высокоспециализированной клеткой, уникально приспособленной для единственной функции — создания новой особи. Цитоплазма яйцеклетки может даже перепрограммировать ядро соматической клетки, чтобы ядро могло направлять развитие новой особи. Так появилась знаменитая овечка Долли. Ядро неоплодотворенной яйцеклетки овцы было разрушено и заменено ядром взрослой соматической клетки. Для активации яйцеклетки использовали электрический ток, а полученный эмбрион имплантировали в матку суррогатной матери. Полученная нормальная взрослая овца имела геном донорской соматической клетки и, следовательно, была клоном донорской овцы.
В этом разделе мы кратко рассмотрим некоторые особенности яйцеклетки, а затем обсудим, как она развивается и становится готовой к оплодотворению.
Яйцо высокоспециализировано для самостоятельного развития, с большими запасами питательных веществ и сложной оболочкой
Яйца большинства животных представляют собой гигантские одиночные клетки, содержащие запасы всех материалов, необходимых для начального развития эмбриона до стадии, на которой новый человек может начать кормление.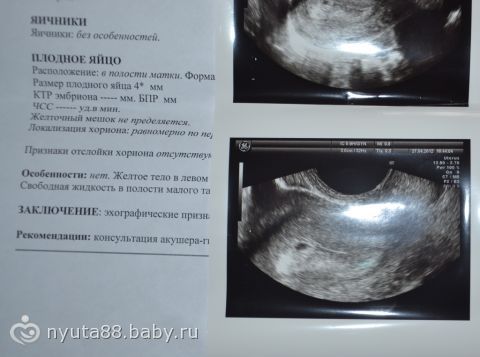 Перед стадией питания гигантская клетка расщепляется на множество более мелких клеток, но чистого роста не происходит. Эмбрион млекопитающих является исключением. Он может начать расти рано, получая питательные вещества от матери через плаценту. Таким образом, яйцо млекопитающего, хотя и является большой клеткой, не обязательно должно быть таким же большим, как, например, яйцо лягушки или птицы. В общем, яйца обычно имеют сферическую или яйцевидную форму, диаметром около 0,1 мм у человека и морских ежей (у которых крошечные питающиеся личинки), от 1 до 2 мм у лягушек и рыб и много сантиметров у птиц и рептилий (). Типичная соматическая клетка, напротив, имеет диаметр всего около 10 или 20 мкм (10).
Перед стадией питания гигантская клетка расщепляется на множество более мелких клеток, но чистого роста не происходит. Эмбрион млекопитающих является исключением. Он может начать расти рано, получая питательные вещества от матери через плаценту. Таким образом, яйцо млекопитающего, хотя и является большой клеткой, не обязательно должно быть таким же большим, как, например, яйцо лягушки или птицы. В общем, яйца обычно имеют сферическую или яйцевидную форму, диаметром около 0,1 мм у человека и морских ежей (у которых крошечные питающиеся личинки), от 1 до 2 мм у лягушек и рыб и много сантиметров у птиц и рептилий (). Типичная соматическая клетка, напротив, имеет диаметр всего около 10 или 20 мкм (10).
Рисунок 20-19
Фактические размеры трех яиц. Человеческое яйцо имеет диаметр 0,1 мм.
Рисунок 20-20
Относительные размеры различных яиц. Размеры сравнивают с типичными соматическими клетками.
Цитоплазма яйца содержит запасы питательных веществ в виде желтка, который богат липидами, белками и полисахаридами и обычно содержится в дискретных структурах, называемых гранулами желтка . У некоторых видов каждая гранула желтка окружена мембраной, а у других нет. В яйцах, которые развиваются в крупных животных вне тела матери, желток может составлять более 95% объема клетки. У млекопитающих, зародыши которых в основном питаются матерями, желтка почти нет.
У некоторых видов каждая гранула желтка окружена мембраной, а у других нет. В яйцах, которые развиваются в крупных животных вне тела матери, желток может составлять более 95% объема клетки. У млекопитающих, зародыши которых в основном питаются матерями, желтка почти нет.
Яичная оболочка – еще одна особенность яиц. Это особая форма внеклеточного матрикса, состоящего в основном из молекул гликопротеинов, некоторые из которых секретируются яйцеклеткой, а другие откладываются на ней окружающими клетками. У многих видов основная оболочка представляет собой слой, непосредственно окружающий плазматическую мембрану яйца; в яйцах немлекопитающих, таких как морские ежи или куры, он называется желточный слой, , тогда как в яйцеклетках млекопитающих он называется zona pellucida (). Этот слой предохраняет яйцеклетку от механических повреждений, а во многих яйцеклетках выступает еще и видоспецифическим барьером для сперматозоидов, пропуская только сперматозоиды того же или близкородственного вида.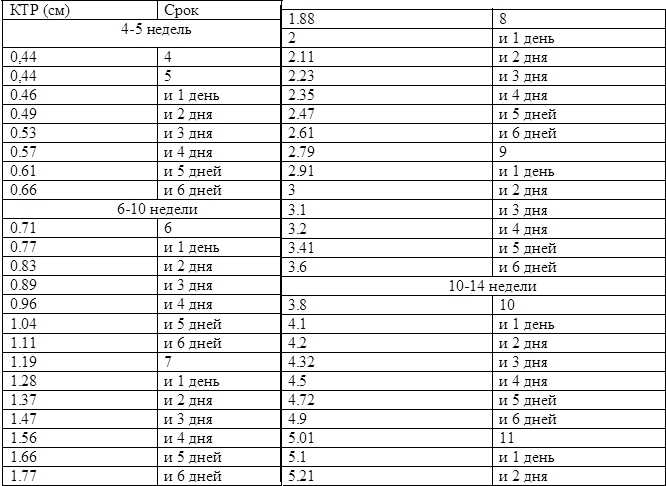
Рисунок 20-21
Зона пеллюцида. (A) Сканирующая электронная микрофотография яйца хомяка, показывающая блестящую оболочку. (B) Сканирующая электронная микрофотография аналогичной яйцеклетки, в которой зона (к которой прикреплено много сперматозоидов) была отслоена, чтобы показать нижележащую плазму (подробнее…)
Многие яйца (включая яйца млекопитающих) содержат специализированные секреторные везикулы прямо под плазматической мембраной во внешней области, или коре , цитоплазмы яйца. Когда яйцеклетка активируется сперматозоидом, эти кортикальные гранулы высвобождают свое содержимое путем экзоцитоза; содержимое гранул влияет на изменение оболочки яйцеклетки, чтобы предотвратить слияние более чем одного спермия с яйцеклеткой (обсуждается ниже).
Кортикальные гранулы обычно равномерно распределены по всей коре яйцеклетки, но у некоторых организмов другие компоненты цитоплазмы имеют поразительно асимметричное распределение. Некоторые из этих локализованных компонентов позже помогают установить полярность эмбриона, как это обсуждалось в главе 21.
Яйцеклетки развиваются поэтапно
Развивающаяся яйцеклетка называется ооцитом. Его дифференцировка в зрелую яйцеклетку (или
Хотя детали развития ооцитов (оогенеза) варьируются от вида к виду, общие стадии сходны, как указано в . Первичные зародышевые клетки мигрируют в формирующиеся гонады, чтобы стать оогониями, которые пролиферируют путем митоза в течение периода, прежде чем дифференцироваться в первичных ооцитов. На этой стадии (обычно перед рождением у млекопитающих) начинается первое мейотическое деление: ДНК реплицируется так, что каждая хромосома состоит из двух сестринских хроматид, дуплицированные гомологичные хромосомы спариваются вдоль своих длинных осей, и происходит кроссинговер между несестринскими хроматидами эти парные хромосомы. После этих событий клетка остается задержанной в профазе I деления мейоза (в состоянии, эквивалентном, как мы указывали ранее, G 2 фаза цикла митотического деления) в течение периода продолжительностью от нескольких дней до многих лет, в зависимости от вида. В течение этого длительного периода (или, в некоторых случаях, в начале половой зрелости) первичные ооциты синтезируют оболочку и гранулы коры. В случае больших ооцитов не млекопитающих они также накапливают рибосомы, желток, гликоген, липиды и мРНК, которые позже будут управлять синтезом белков, необходимых для раннего эмбрионального роста и развертывания программы развития. Во многих ооцитах интенсивная биосинтетическая активность отражается в структуре хромосом, которые деконденсируются и образуют латеральные петли, приобретая характерный вид «ламповых щеток», что свидетельствует об их очень активном участии в синтезе РНК (см.
На этой стадии (обычно перед рождением у млекопитающих) начинается первое мейотическое деление: ДНК реплицируется так, что каждая хромосома состоит из двух сестринских хроматид, дуплицированные гомологичные хромосомы спариваются вдоль своих длинных осей, и происходит кроссинговер между несестринскими хроматидами эти парные хромосомы. После этих событий клетка остается задержанной в профазе I деления мейоза (в состоянии, эквивалентном, как мы указывали ранее, G 2 фаза цикла митотического деления) в течение периода продолжительностью от нескольких дней до многих лет, в зависимости от вида. В течение этого длительного периода (или, в некоторых случаях, в начале половой зрелости) первичные ооциты синтезируют оболочку и гранулы коры. В случае больших ооцитов не млекопитающих они также накапливают рибосомы, желток, гликоген, липиды и мРНК, которые позже будут управлять синтезом белков, необходимых для раннего эмбрионального роста и развертывания программы развития. Во многих ооцитах интенсивная биосинтетическая активность отражается в структуре хромосом, которые деконденсируются и образуют латеральные петли, приобретая характерный вид «ламповых щеток», что свидетельствует об их очень активном участии в синтезе РНК (см.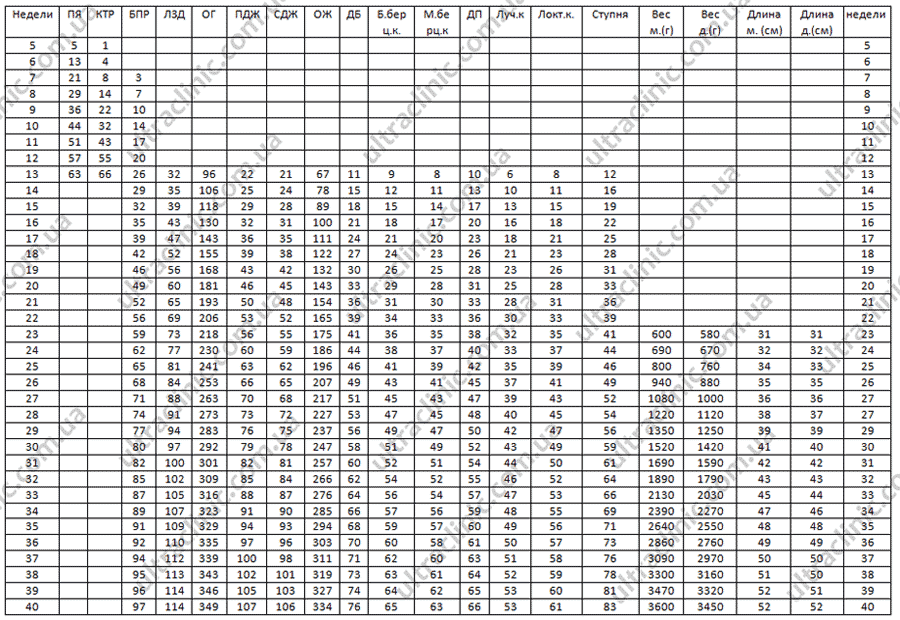
Рисунок 20-22
Стадии оогенеза. Оогонии развиваются из первичных зародышевых клеток, которые мигрируют в развивающиеся гонады в начале эмбриогенеза. После ряда митотических делений оогонии вступают в I мейотическое деление, после чего называются первичными ооцитами. У млекопитающих (подробнее…)
Следующая фаза развития ооцитов называется созреванием ооцитов. Обычно это не происходит до половой зрелости, когда ооцит стимулируется гормонами. Под влиянием этих гормонов клетка возобновляет свой прогресс через I деление мейоза. Хромосомы реконденсируются, ядерная оболочка разрушается (это обычно считается началом созревания), и реплицированные гомологичные хромосомы разделяются в анафазе I на два дочерних ядра, каждое из которых содержит половину исходного числа хромосом. Чтобы закончить деление I, цитоплазма делится асимметрично, образуя две клетки, которые сильно различаются по размеру: одна маленькая полярное тело, и другой большой вторичный ооцит , предшественник яйца. На этой стадии каждая из хромосом еще состоит из двух сестринских хроматид. Эти хроматиды не разделяются до II деления мейоза, когда они разделяются на отдельные клетки, как описано ранее. После этого окончательного разделения хромосом в анафазе II цитоплазма большого вторичного ооцита снова асимметрично делится с образованием зрелой яйцеклетки (или яйцеклетки ) и второго маленького полярного тельца, каждое из которых имеет гаплоидный набор одиночных хромосом (см. ). Из-за этих двух асимметричных делений цитоплазмы ооциты сохраняют свой большой размер, несмотря на два мейотических деления. Оба полярных тельца маленькие и со временем дегенерируют.
На этой стадии каждая из хромосом еще состоит из двух сестринских хроматид. Эти хроматиды не разделяются до II деления мейоза, когда они разделяются на отдельные клетки, как описано ранее. После этого окончательного разделения хромосом в анафазе II цитоплазма большого вторичного ооцита снова асимметрично делится с образованием зрелой яйцеклетки (или яйцеклетки ) и второго маленького полярного тельца, каждое из которых имеет гаплоидный набор одиночных хромосом (см. ). Из-за этих двух асимметричных делений цитоплазмы ооциты сохраняют свой большой размер, несмотря на два мейотических деления. Оба полярных тельца маленькие и со временем дегенерируют.
У большинства позвоночных созревание ооцитов переходит в метафазу мейоза II, а затем приостанавливается до оплодотворения. При овуляции задержанный вторичный ооцит высвобождается из яичника и проходит стадию быстрого созревания, превращая его в яйцеклетку, готовую к оплодотворению. Если происходит оплодотворение, яйцеклетка стимулируется к завершению мейоза.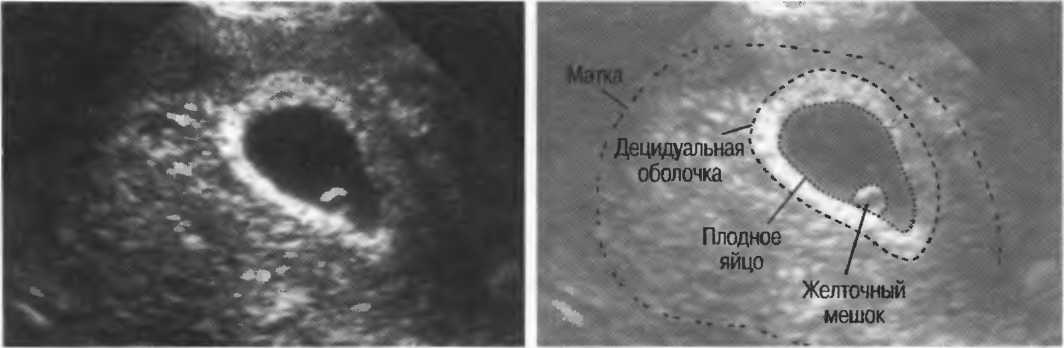
Ооциты используют специальные механизмы для роста до больших размеров
Соматической клетке диаметром 10–20 мкм обычно требуется около 24 часов, чтобы удвоить свою массу при подготовке к клеточному делению. При такой скорости биосинтеза такой клетке потребовалось бы очень много времени, чтобы достичь в тысячу раз большей массы яйца млекопитающего диаметром 100 мкм. Потребовалось бы еще больше времени, чтобы достичь в миллион раз большей массы яйца насекомого диаметром 1000 мкм. Однако некоторые насекомые живут всего несколько дней и умудряются откладывать яйца диаметром даже больше 1000 мкм. Ясно, что яйца должны иметь специальные механизмы для достижения их больших размеров.
Одной из простых стратегий быстрого роста является наличие дополнительных копий гена в клетке. Таким образом, ооцит задерживает завершение первого мейотического деления, чтобы расти, пока он содержит диплоидный набор хромосом в дубликате. Таким образом, она имеет в два раза больше ДНК, доступной для синтеза РНК, чем средняя соматическая клетка в фазе G 1 клеточного цикла. Ооциты некоторых видов идут еще дальше, чтобы накопить дополнительную ДНК: они производят много дополнительных копий определенных генов. В главе 6 мы обсуждаем, как соматическим клеткам большинства организмов требуется от 100 до 500 копий генов рибосомной РНК, чтобы произвести достаточное количество рибосом для синтеза белка. Яйцеклетки требуют еще большего количества рибосом для поддержки синтеза белка во время раннего эмбриогенеза, а в ооцитах многих животных гены рибосомной РНК специфически амплифицируются; некоторые яйца земноводных, например, содержат 1 или 2 миллиона копий этих генов.
Ооциты некоторых видов идут еще дальше, чтобы накопить дополнительную ДНК: они производят много дополнительных копий определенных генов. В главе 6 мы обсуждаем, как соматическим клеткам большинства организмов требуется от 100 до 500 копий генов рибосомной РНК, чтобы произвести достаточное количество рибосом для синтеза белка. Яйцеклетки требуют еще большего количества рибосом для поддержки синтеза белка во время раннего эмбриогенеза, а в ооцитах многих животных гены рибосомной РНК специфически амплифицируются; некоторые яйца земноводных, например, содержат 1 или 2 миллиона копий этих генов.
Рост ооцитов также может частично зависеть от синтетической активности других клеток. Желток, например, обычно синтезируется вне яичника и импортируется в ооцит. У птиц, земноводных и насекомых белки желтка вырабатываются клетками печени (или их аналогами), которые выделяют эти белки в кровь. В яичниках ооциты поглощают белки желтка из внеклеточной жидкости посредством рецептор-опосредованного эндоцитоза (см. ). Питательная помощь может также исходить от соседних добавочных клеток в яичнике. Они могут быть двух типов. У некоторых беспозвоночных часть потомства оогоний становится питающими клетками, а не ооцитами. Эти клетки обычно связаны с ооцитом цитоплазматическими мостиками, через которые макромолекулы могут проходить непосредственно в цитоплазму ооцита (). Для ооцита насекомого питающие клетки производят многие продукты — рибосомы, мРНК, белок и т. д., — которые ооциты позвоночных должны производить для себя.
). Питательная помощь может также исходить от соседних добавочных клеток в яичнике. Они могут быть двух типов. У некоторых беспозвоночных часть потомства оогоний становится питающими клетками, а не ооцитами. Эти клетки обычно связаны с ооцитом цитоплазматическими мостиками, через которые макромолекулы могут проходить непосредственно в цитоплазму ооцита (). Для ооцита насекомого питающие клетки производят многие продукты — рибосомы, мРНК, белок и т. д., — которые ооциты позвоночных должны производить для себя.
Рисунок 20-23
Питательные клетки и фолликулярные клетки, связанные с Drosophila ооцит. Питательные клетки и ооцит возникают из общего оогония, который дает начало одному ооциту и 15 питающим клеткам (только 7 из которых видны в этой плоскости сечения). Эти клетки остаются (подробнее…)
Другими вспомогательными клетками в яичнике, которые помогают питать развивающиеся ооциты, являются обычные соматические клетки, называемые фолликулярными клетками, которые встречаются как у беспозвоночных, так и у позвоночных. Они располагаются в виде эпителиального слоя вокруг ооцита (, и см.), с которым связаны только щелевыми контактами, позволяющими обмениваться небольшими молекулами, но не макромолекулами. Хотя эти клетки не могут обеспечить ооцит предварительно сформированными макромолекулами через эти сообщающиеся соединения, они могут помочь поставлять более мелкие молекулы-предшественники, из которых состоят макромолекулы. Кроме того, фолликулярные клетки часто секретируют макромолекулы, которые вносят вклад в оболочку яйцеклетки, или поглощаются рецептор-опосредованным эндоцитозом в растущий ооцит, или воздействуют на рецепторы поверхности яйцеклетки, чтобы контролировать пространственное формирование паттерна и осевую асимметрию яйцеклетки (обсуждается в главе 21).
Они располагаются в виде эпителиального слоя вокруг ооцита (, и см.), с которым связаны только щелевыми контактами, позволяющими обмениваться небольшими молекулами, но не макромолекулами. Хотя эти клетки не могут обеспечить ооцит предварительно сформированными макромолекулами через эти сообщающиеся соединения, они могут помочь поставлять более мелкие молекулы-предшественники, из которых состоят макромолекулы. Кроме того, фолликулярные клетки часто секретируют макромолекулы, которые вносят вклад в оболочку яйцеклетки, или поглощаются рецептор-опосредованным эндоцитозом в растущий ооцит, или воздействуют на рецепторы поверхности яйцеклетки, чтобы контролировать пространственное формирование паттерна и осевую асимметрию яйцеклетки (обсуждается в главе 21).
Рисунок 20-24
Электронные микрофотографии развивающихся первичных ооцитов в яичнике кролика. (A) Ранняя стадия развития первичного ооцита. Ни zona pellucida, ни кортикальные гранулы не развились, а ооцит окружен одним слоем уплощенного фолликула (подробнее.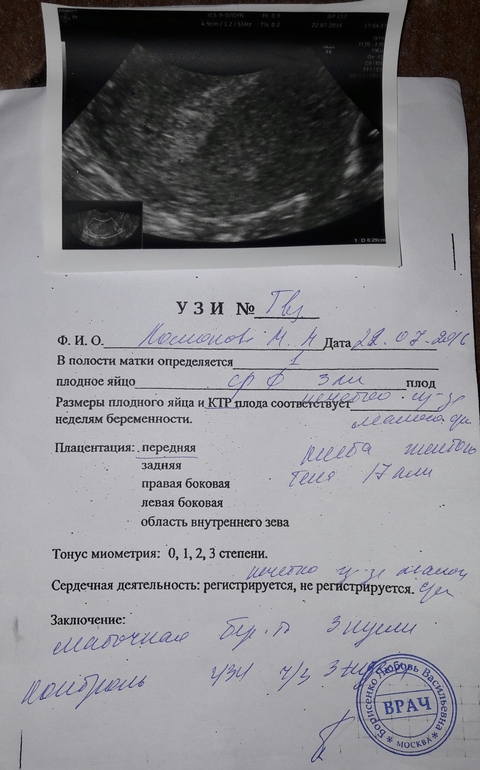 ..)
..)
Резюме
Яйцеклетки развиваются поэтапно из первичных зародышевых клеток, которые мигрируют в развивающуюся гонаду на ранних стадиях развития стать оогонией. После митотической пролиферации оогонии становятся первичными ооцитами, которые начинают мейотическое деление I, а затем останавливаются в профазе I на несколько дней или лет, в зависимости от вида. Во время этого периода остановки профазы-I первичные ооциты растут, синтезируют оболочку и накапливают рибосомы, мРНК и белки, часто заручаясь помощью других клеток, включая окружающие вспомогательные клетки. В процессе созревания первичные ооциты завершают I мейотическое деление с образованием малого полярного тельца и крупного вторичного ооцита, который переходит в метафазу II мейотического деления. Там, у многих видов, ооцит задерживается до тех пор, пока не будет стимулирован оплодотворением для завершения мейоза и начала эмбрионального развития.
5 фактов о женской яйцеклетке | Человеческие яйца
Приготовьтесь узнать удивительные факты о женской яйцеклетке! В этом посте мы углубимся в работу менструального цикла и исследуем маленькую и хрупкую клетку, которая имеет решающее значение, когда речь идет о фертильности.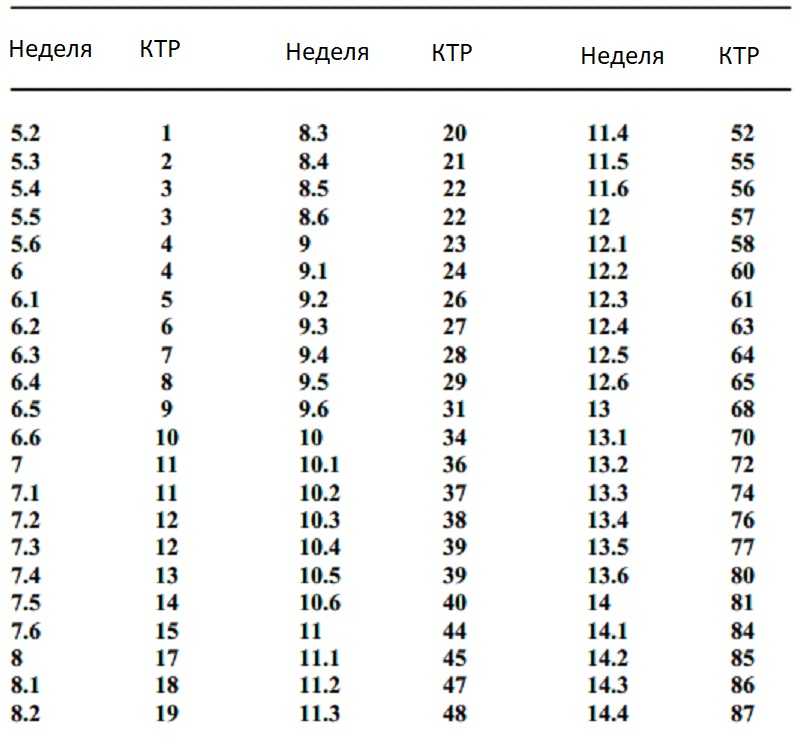 Читайте дальше, чтобы узнать, почему человеческие яйцеклетки такие особенные и как жизнь яйцеклетки тесно связана с планированием или предотвращением беременности…
Читайте дальше, чтобы узнать, почему человеческие яйцеклетки такие особенные и как жизнь яйцеклетки тесно связана с планированием или предотвращением беременности…
Эта статья также доступна на испанском языке.
1. Женская яйцеклетка больше, чем вы думаете
Большинство клеток невозможно увидеть невооруженным глазом: вам нужен микроскоп, чтобы увидеть их. Человеческая яйцеклетка является исключением, на самом деле это самая большая клетка в организме, и ее можно увидеть без микроскопа. Это впечатляет.
По сравнению с другими клетками человека, яйцеклетки огромны. Они имеют диаметр 100 микрон (это миллионная доля метра) и примерно такую же ширину, как прядь волос. Это может показаться маленьким, но ни одна другая клетка не приближается к таким размерам.
2. Вы рождаетесь со всеми яйцеклетками
Знаете ли вы, что каждая женщина рождается со всеми яйцеклетками, уже находящимися в яичниках? У вас может быть до семи миллионов яйцеклеток в яичниках, когда вы рождаетесь, и они будут выделяться каждый менструальный цикл на протяжении всей вашей фертильной жизни.
Поскольку вы рождаетесь со всеми своими яйцеклетками, это на самом деле означает, что ваши яйцеклетки когда-то были внутри вашей матери, когда вы были плодом в ее утробе. Это означает, что ваша мать носила яйцеклетки, которые однажды могут быть оплодотворены и превратиться в ее собственного внука!
3. Качество яйцеклеток человека со временем ухудшается
Чем старше мы становимся, тем лучше становятся наши клетки, и женская яйцеклетка не является исключением. Хотя женщины рождаются с миллионами яйцеклеток, качество их со временем ухудшается. Многие умирают еще до того, как мы достигаем половой зрелости, а это означает, что к моменту начала менструации у нас остается около 700 000 яйцеклеток.
Каждый месяц женщина продолжает терять яйцеклетки, поэтому в момент менопаузы у женщины, скорее всего, останется менее 1000 яйцеклеток. Это распространенное заблуждение, что гормональные противозачаточные средства или беременность могут приостановить естественный износ женских яйцеклеток. Они продолжают ухудшаться, несмотря ни на что.
Они продолжают ухудшаться, несмотря ни на что.
Попрощаться с гормонами — отличный способ лучше узнать свое тело. Natural Cycles на 100% не содержит гормонов, и его эффективность доказана научными исследованиями. Зарегистрируйтесь сегодня, чтобы попробовать первое в мире приложение для контроля над рождаемостью.
4. Яйцеклетка выделяется каждый цикл
Большинство женщин выделяют яйцеклетку каждый цикл, это называется овуляцией. Некоторые женщины могут выпускать две яйцеклетки за цикл, что может привести к зачатию разнояйцевых близнецов. Однояйцевые близнецы получаются, когда оплодотворенная яйцеклетка делится надвое. Однояйцевые близнецы растут в одном амниотическом мешке и, в отличие от разнояйцевых близнецов, генетически одинаковы.
Гормональные противозачаточные средства подавляют овуляцию. Вот как можно предотвратить беременность, полностью исключив яйцеклетку из уравнения. Когда овуляция не происходит в регулярном менструальном цикле, это называется ановуляторным циклом. Ановуляторные циклы распространены, и большинство женщин, вероятно, испытают их в какой-то момент своей жизни. Вы можете не осознавать, что у вас нет овуляции, если вы не отслеживаете свой менструальный цикл.
Когда овуляция не происходит в регулярном менструальном цикле, это называется ановуляторным циклом. Ановуляторные циклы распространены, и большинство женщин, вероятно, испытают их в какой-то момент своей жизни. Вы можете не осознавать, что у вас нет овуляции, если вы не отслеживаете свой менструальный цикл.
5. Короткая жизнь женской яйцеклетки после овуляции
После овуляции высвобожденная женская яйцеклетка начинает очень быстро разрушаться, и фертильное окно начинает закрываться. Через 12-24 часа яйцеклетка погибнет и повторно забеременеть не получится до следующего цикла.
По этой причине лучшее время для зачатия — день перед овуляцией. По сравнению с яйцеклетками после высвобождения сперматозоиды более устойчивы и могут выживать в женских половых путях до пяти дней! Выживание сперматозоидов зависит от правильных условий, таких как консистенция цервикальной слизи. Определение овуляции является ключевым этапом в планировании беременности.
Противозачаточные средства и менструальный цикл
Точно так же, как знание того, что вы способны к зачатию, можно спланировать беременность, эту науку можно использовать и для предотвращения беременности.
