Содержание
Карта сайта
|
|
Оптимизация лечения перинатальных гипоксически-ишемических поражений головного мозга у недоношенных детей :: ТРУДНЫЙ ПАЦИЕНТ
М. И. Медведев1, С.О. Рогаткин1, А.В. Горбунов1, М.Г. Дегтярева1, О.В. Гребенникова1, О.В. Потапова2, Е.Н. Морозова2
И. Медведев1, С.О. Рогаткин1, А.В. Горбунов1, М.Г. Дегтярева1, О.В. Гребенникова1, О.В. Потапова2, Е.Н. Морозова2
1Российский государственный медицинский университет им. Н.И. Пирогова
2Городская больница № 8, Москва
Проведено лечение 20 недоношенных детей с гипоксически-ишемическим поражением головного мозга средней степени тяжести ноотропным препаратом Церебролизин в виде монотерапии. Эффективность лечения оценивалась по данным клинического наблюдения с использованием шкалы балльной оценки «Infanib» и динамики становления показателей биоэлектрической активности головного мозга с использованием метода ЭЭГ. В результате проведённого исследования, по сравнению с контрольной группой недоношенных детей с аналогичным поражением головного мозга не получавших лечение Церебролизином, выявлено, что после проведения лечения достоверно улучшались показатели мышечно-постурального тонуса и рефлексов, а так же нормализовались показатели становления биоэлектрической активности головного мозга.
Ключевые слова: недоношенные дети, перинатальные гипосически-ишемические поражения головного мозга, церебролизин, электроэнцефалография.
Гипоксически-ишемические поражения головного мозга, связанные с неблагополучным течением беременности и родов (так называемые перинатальные поражения) наблюдаются более чем в 40 % у преждевременно рождённых детей [1-3]. Данные поражения определяют чрезвычайную актуальность изучаемой проблемы, так как в дальнейшем они способствуют развитию очень тяжёлых заболеваний – детские церебральные параличи, симптоматические формы эпилепсии, органические формы слабоумия, нарушения формирования речи и др. [4, 5]. В течение многих лет разрабатываются методы лечения перинатальных поражений головного мозга, однако до настоящего времени не отработана единая система терапии, а использование отдельных препаратов, особенно ноотропных представляется спорным [2, 3, 6].
В проведённом исследовании использовали для лечения перинатальных поражений головного мозга гипоксически-ишемического характера средней степени тяжести у недоношенных детей ноотропный препарат Церебролизин фирмы «Ebewe Pharma» (Австрия). Диагноз и степень тяжести перинатальных поражений ЦНС устанавливались в соответствии с Классификацией перинатальных поражений нервной системы и их последствий у новорождённых и детей первого года жизни [5]. Нами обследован 41 недоношенный ребёнок, тяжесть состояния которых по неврологическому статусу была обусловлена синдромом угнетения ЦНС, развившегося после перенесённой перинатальной гипоксии мозга. В остром периоде клиническая картина синдрома угнетения характеризовалась снижением спонтанной двигательной активности, мышечной гипотонией, снижением рефлексов орального и спинального автоматизма, снижением сухожильных рефлексов. В восстановительном периоде на фоне восстановления рефлексов орального автоматизма сохранялось снижение мышечного тонуса и объёма спонтанных движений, оставались сниженными рефлексы спинального автоматизма.
Диагноз и степень тяжести перинатальных поражений ЦНС устанавливались в соответствии с Классификацией перинатальных поражений нервной системы и их последствий у новорождённых и детей первого года жизни [5]. Нами обследован 41 недоношенный ребёнок, тяжесть состояния которых по неврологическому статусу была обусловлена синдромом угнетения ЦНС, развившегося после перенесённой перинатальной гипоксии мозга. В остром периоде клиническая картина синдрома угнетения характеризовалась снижением спонтанной двигательной активности, мышечной гипотонией, снижением рефлексов орального и спинального автоматизма, снижением сухожильных рефлексов. В восстановительном периоде на фоне восстановления рефлексов орального автоматизма сохранялось снижение мышечного тонуса и объёма спонтанных движений, оставались сниженными рефлексы спинального автоматизма.
Весо-ростовые показатели обследованных детей представлены в таблице 1.
В зависимости от проводимой в восстановительном периоде терапии были сформированы две группы: основная (n = 20) и контрольная группы (n = 21). Лечение препаратом Церебролизин в виде монотерапии начинали по достижении пациентами скорректированного возраста (СВ) 40 недель от зачатия (календарный или паспортный их возраст составлял от 28 до 42 дней в зависимости от срока гестации). Церебролизин вводился в дозе 0,1 мл в сутки в течение первых 3 суток лечения, затем в дозе 0,1 мл/кг/сутки в течение последующих дней. Общая продолжительность курса лечения составляла 20 дней. Препарат вводился внутримышечно в утренние часы (с 9-00 до 12-00). Во время терапии Церебролизином приём других ноотропных препаратов исключался. Детям контрольной группы проводился лечебный массаж, гимнастика. Как следует из представленных в таблице 1 данных, по половому составу, антропометрическим показателям и оценке по шкале Апгар показатели были сопоставимы.
Лечение препаратом Церебролизин в виде монотерапии начинали по достижении пациентами скорректированного возраста (СВ) 40 недель от зачатия (календарный или паспортный их возраст составлял от 28 до 42 дней в зависимости от срока гестации). Церебролизин вводился в дозе 0,1 мл в сутки в течение первых 3 суток лечения, затем в дозе 0,1 мл/кг/сутки в течение последующих дней. Общая продолжительность курса лечения составляла 20 дней. Препарат вводился внутримышечно в утренние часы (с 9-00 до 12-00). Во время терапии Церебролизином приём других ноотропных препаратов исключался. Детям контрольной группы проводился лечебный массаж, гимнастика. Как следует из представленных в таблице 1 данных, по половому составу, антропометрическим показателям и оценке по шкале Апгар показатели были сопоставимы.
Для постановки диагноза перинатального гипоксически-ишемического поражения головного мозга и оценки их степени тяжести, всем наблюдаемым детям проводилось комплексное этапное лучевое обследование головного мозга с помощью методов нейросонографии и компьютерной томографии. Нейросонография (НСГ) выполнялась всем детям, кратность повторных исследований определялась степенью тяжести и характером выявленных первично изменений, а также клиническими показаниями. При обследовании, выполненном в первые дни жизни, в среднем, на 3,9 ± 0,3 сутки жизни, в 60,98 % случаев были выявлены ишемические изменения, в 39,02 % случаев – сочетанные ишемически-геморрагические изменения. При НСГ обследовании в возрасте до 14 сут. жизни ВЖК I/II степени выявлялись в основной и контрольной группах с сопоставимой частотой – 50 и 47,62 % соответственно. Для верификации и уточнения степени постгипоксических изменений головного мозга 38 детям была выполнена компьютерная томография (КТ). При этом внутрижелудочковые кровоизлияния (ВЖК) были обнаружены только у 2 (10 %) детей основной и 2 (9,52 %) – в контрольной группе.
Нейросонография (НСГ) выполнялась всем детям, кратность повторных исследований определялась степенью тяжести и характером выявленных первично изменений, а также клиническими показаниями. При обследовании, выполненном в первые дни жизни, в среднем, на 3,9 ± 0,3 сутки жизни, в 60,98 % случаев были выявлены ишемические изменения, в 39,02 % случаев – сочетанные ишемически-геморрагические изменения. При НСГ обследовании в возрасте до 14 сут. жизни ВЖК I/II степени выявлялись в основной и контрольной группах с сопоставимой частотой – 50 и 47,62 % соответственно. Для верификации и уточнения степени постгипоксических изменений головного мозга 38 детям была выполнена компьютерная томография (КТ). При этом внутрижелудочковые кровоизлияния (ВЖК) были обнаружены только у 2 (10 %) детей основной и 2 (9,52 %) – в контрольной группе.
Примечательно то, что по данным динамического НСГ обследования у 20 новорождённых было выявлено наличие признаков перенесённого ВЖК I-II степени, причём у 12 из них в сроки от 12-28 суток жизни отмечено формирование субэпендимальных псевдокист. Однако при проведении КТ только у 4 детей из 12 были выявлены признаки перенесённых ранее ВЖК I-II степени или их последствий. Временной интервал между НСГ и КТ исследованиями у обследованных детей составил от 2 до 18 суток. Наибольшая частота совпадений диагнозов при использовании этих двух методов нейровизуализации была отмечена в тех случаях, когда временной интервал не превышал 4 суток.
Однако при проведении КТ только у 4 детей из 12 были выявлены признаки перенесённых ранее ВЖК I-II степени или их последствий. Временной интервал между НСГ и КТ исследованиями у обследованных детей составил от 2 до 18 суток. Наибольшая частота совпадений диагнозов при использовании этих двух методов нейровизуализации была отмечена в тех случаях, когда временной интервал не превышал 4 суток.
Объективная оценка функционального состояния ЦНС в группах сравнения до начала восстановительной терапии проводилась на основании характеристик ЭЭГ в цикле физиологического сна [7]. В возрасте 40 недель от зачатия характеристики биоэлектрической активности (БЭА) у детей групп сравнения ни в одном случае не соответствовали I типу ЭЭГ-паттерна («норма»). Частота встречаемости ЭЭГ-паттернов II типа («задержка созревания») и III типа «нарушение созревания» в группах сравнения была сопоставима. Важно подчеркнуть, что наиболее тяжёлые нарушения функционального состояния ЦНС, соответствующие IV и V типам ЭЭГ («патология» и «угнетение БЭА» соответственно), также не встречались. Полученные данные иллюстрирует рис. 1.
Полученные данные иллюстрирует рис. 1.
Непосредственное клиническое наблюдение за детьми мы начинали с момента их перевода в отделение патологии новорождённых. Для объективизации оценки мышечно-постурального тонуса и рефлексов применяли стандартизованную шкалу «Infanib» (1995). При клинической оценке положительная динамика в неврологическом статусе за счёт восстановления рефлексов орального и спинального автоматизма, нормализации мышечного тонуса и объёма спонтанной двигательной активности, формирования цепных установочных реакций на голову отмечалась у подавляющего большинства наблюдаемых детей. Объективные изменения в двигательно-рефлекторной сфере у детей основной и контрольной групп на фоне восстановительной терапии представлены на рис. 2.
Как следует из представленных данных, в СВ 40 недель от зачатия у детей основной группы средний балл по шкале составлял 49,15 ± 2,96 и был достоверно ниже, чем у детей контрольной группы (52,86 ± 3,86), t (df = 39) = 3,4; р = 0,001. При этом оценки 90,48 % детей в контрольной группе и 50 % в основной группе соответствовали диапазону «транзиторное нарушение», и 9,52 % детей в контрольной группе и 50 % в основной группе – показателям «патология». Ни в одном случае полученный по шкале балл не соответствовал норме.
Ни в одном случае полученный по шкале балл не соответствовал норме.
При повторном осмотре в СВ 44 недели после проведения курса лечения Церебролизином, достоверная положительная динамика в виде увеличения балла отмечалась как в основной (58,55 ± 4,15), так и в контрольной группах (56,0 ± 3,86), p Таким образом, на фоне терапии Церебролизином, отмечалась существенная объективная положительная динамика со стороны мышечного тонуса и рефлексов, о чём свидетельствует достоверное повышение балла по шкале «Infanib» и увеличение доли детей, чья оценка соответствовала диапазону «транзиторное нарушение».
При повторном обследовании после проведённого лечения Церебролизином, в СВ 44 недели у детей основной группы отмечалась выраженная достоверная положительная динамика за счёт резкого увеличения доли детей с II типом ЭЭГ-паттерна, характеризующего относительно удовлетворительное функциональное состояние ЦНС и нормализацию онтогенетического формирования БЭА. Вместе с тем, у детей контрольной группы достоверной динамики выявлено не было, при этом доля детей с III типом ЭЭГ-паттерна составила 42,86 % и достоверно превышала таковую в основной группе, χ2 (df = 1) = 7,96, p = 0,005 (рис. 3).Следует отметить, что на фоне применения Церебролизина, ни в одном случае не было отмечено отрицательной динамики ЭЭГ-характеристик, в том числе, появления и/или увеличения амплитуды патологических графоэлементов (рис. 4)
3).Следует отметить, что на фоне применения Церебролизина, ни в одном случае не было отмечено отрицательной динамики ЭЭГ-характеристик, в том числе, появления и/или увеличения амплитуды патологических графоэлементов (рис. 4)
Вместе с тем, у детей контрольной группы в 2 (9 %) случаях имела место отрицательная динамика в виде увеличения степени задержки формирования БЭА и появления высокоамплитудной пароксизмальной активности (см. рис. 3).
Для повышения информативности и объективности оценки функционального состояния головного мозга мы дополнили визуальную оценку ЭЭГ-паттерна данными количественными анализа, последовательно применив методологический принцип «функциональной топографии ». Обследование данной выборки детей проводилось с использованием программного пакета «Нейрокартограф 4.45» (эпоха анализа 5 с, шаг 0,2 Гц в диапазоне частот от 0,2 до 20,0 Гц). Анализ проводился с использованием модуля «ANOVA» программы «Statistika 6.0». При дисперсионном анализе независимым фактором была Группа (Гр – основная и контрольная) – 2 уровня), фактором повторных измерений выступала Топография (Der – 7 уровней – Fp1, F3, C3, P3, О1, F7, T5), а зависимой переменной – спектральная мощность данного частотного сегмента (табл. 2).
2).
Изложенные нами ранее результаты экспертной оценки ЭЭГ представили исходно сопоставимые изменения функционального состояния ЦНС в группах сравнения. Однако как следует из изложенных в таблице данных, по спектральным характеристикам БЭА имели место существенные отличия в основных частотных диапазонах, формирующих картину спокойного сна детей в СВ 36-40 недель. Общая спектральная мощность всех ритмических компонентов дельта-1 и дельта-2 (0,2-4,0 Гц) диапазонов, формирующих основную картину фазы спокойного сна, у детей основной и контрольной групп не имела достоверных отличий, безотносительно её топографического распределения. Топографическое распределение медленно волновой активности в группах сравнения существенно отличалось. У детей контрольной группы максимум спектральной мощности отмечался в теменных отведениях, что соответствует нормальному ходу онтогенетического созревания БЭА спокойного сна, с формированием амплитудного максимума над задними областями коры головного мозга. В то же время у детей основной группы, наряду с преобладанием спектральной мощности дельта-активности в центральных отведениях, отмечалось также существенное повышение таковой над передними областями коры.
В то же время у детей основной группы, наряду с преобладанием спектральной мощности дельта-активности в центральных отведениях, отмечалось также существенное повышение таковой над передними областями коры.
Таким образом, препарат Церебролизин оказал положительное влияние не только на клинические показатели развития у недоношенных детей с последствиями церебрального гипоксически-ишемического поражения головного мозга, подтверждёнными объективными данными шкалы бальной оценки «Infanib», но и на показатели становления БЭА головного мозга, выявленные при динамической ЭЭГ. Данные показатели свидетельствовали о нормализации основных паттернов БЭА в основной группе детей, получавших препарат Церебролизин, где достоверно выявлялись показатели «норма» или «задержка созревания» по сравнению с контрольной группой без лечения, где доминировали показатели «нарушения созревания» и повышался индекс пароксизмальности. Возможно это связано с особенностью состава препарата Церебролизин, состоящего из нейропептидов, аминокислот, витаминов и микроэлементов и доказавшего в экспериментальных исследованиях свою способность не только оказывать трофическое воздействие на нервные клетки, подвергшиеся воздействию гипоксии, но и способствовать формированию новых ассоциативных связей между нейронами [8, 9]. Данное положение может также рассматриваться как один из ведущих механизмов, определяющих противосудорожную защитную реактивность головного мозга [9-11]. Ни в одном случае у детей, получавших лечение Церебролизином, не отмечено, по данным ЭЭГ, повышения судорожной активности, напротив, в большинстве исследований снижался индекс пароксизмальности. Мы рекомендуем следующую схему лечения препаратом Церебролизин гипоксически-ишемических поражений головного мозга у недоношенных детей в раннем восстановительном периоде в СВ 40 недель: в первые 3 дня доза назначается 0,1 мл в сутки, препарат вводится внутримышечно в утренние часы, в виде монотерапии. В последующие дни доза рассчитывается 0,1 мл/кг массы тела в сутки, препарат вводится также внутримышечно в утренние часы, в виде монотерапии. Курс составляет от 20 до 30 дней. Необходимым условием является исключение судорог или судорожной активности на ЭЭГ.
Данное положение может также рассматриваться как один из ведущих механизмов, определяющих противосудорожную защитную реактивность головного мозга [9-11]. Ни в одном случае у детей, получавших лечение Церебролизином, не отмечено, по данным ЭЭГ, повышения судорожной активности, напротив, в большинстве исследований снижался индекс пароксизмальности. Мы рекомендуем следующую схему лечения препаратом Церебролизин гипоксически-ишемических поражений головного мозга у недоношенных детей в раннем восстановительном периоде в СВ 40 недель: в первые 3 дня доза назначается 0,1 мл в сутки, препарат вводится внутримышечно в утренние часы, в виде монотерапии. В последующие дни доза рассчитывается 0,1 мл/кг массы тела в сутки, препарат вводится также внутримышечно в утренние часы, в виде монотерапии. Курс составляет от 20 до 30 дней. Необходимым условием является исключение судорог или судорожной активности на ЭЭГ.
Таким образом, применение ноотропного препарата Церебролизин позволило оптимизировать исходы у недоношенных детей пострадавших от перинатальной церебральной гипоксии-ишемии не только по данным клинического наблюдения, но и по результатам объективных показателей – становления БЭА головного мозга.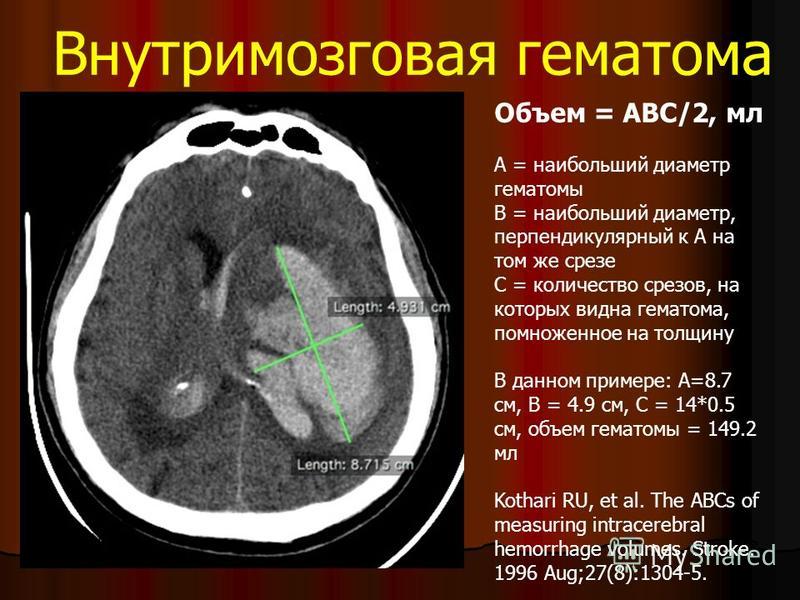 Это безусловно определяет перспективы для использования препарата Церебролизин для лечения перинатальных гипоксически-ишемических поражений головного мозга у недоношенных детей.
Это безусловно определяет перспективы для использования препарата Церебролизин для лечения перинатальных гипоксически-ишемических поражений головного мозга у недоношенных детей.
Литература
1. Неонатология: Национальное руководство / Под ред. академика РАМН Н.Н. Володина Москва, «ГЭОТАР-Медиа», 2007; 848 .
2. Барашнев Ю. И. Перинатальная неврология. Mосква: Триада-Х, 2001; 640.
3. Volpe J. Neurology of Newborn. – N.Y.: Ch. L. 2002. p.930.
4. Барашнев Ю.И. Клинико-морфологическая характеристика и исходы церебральных расстройств при гипоксически-ишемических энцефалопатиях // Акуш. гинек., 2000, 5, 39-42.
5. Классификация перинатальных поражений нервной системы и их последствий у детей первого года жизни. Методические рекомендации. М.: ФГОУ «ВУНМЦ Росздрава», 2007; 88.
6. Медведев М.И., Рогаткин С.О., Гребенникова О.В. и соавт. Применение «Церебролизина» в терапии гипоксически-ишемических поражений ЦНС у недоношенных детей // Вопросы практической педиатрии. 2007; 2: 5: 27.
7. Володин Н.Н., Рогаткин С.О., Дегтярева М.Г., Ворон О.А. Экспертная оценка ЭЭГ физиологического сна у недоношенных детей различного гистационного возраста с перинальными поражениями ЦНС // Вопросы практической педиатрии. 2006; 1: 5.
8. Wahlgren N.G., Ahmed N. Neuroprotection in cerebral ischaemia: facts and fancies-the need for new approaches // Cerebrovasc Dis. 2004; 17: Suppl 1: 153-166.
9. Ladurner G., Kalvach P., Moessler H. Cerebrolysin Study Group. Neuroprotective treatment with cerebrolysin in patients with acute stroke: a randomised controlled trial // J Neural Transm. 2005; 112: 415-428.
Внутрижелудочковое кровоизлияние у недоношенных детей: механизм заболевания
1. Guyer B, Hoyert DL, Martin JA, Ventura SJ, MacDorman MF, Strobino DM. Ежегодная сводка статистики естественного движения населения — 1998 год. Педиатрия. 1999; 104:1229–1246. [PubMed] [Google Scholar]
2. Хьюхан А.М., Эванс Н., Хендерсон Смарт ди-джей, Симпсон Дж.М. Перинатальные факторы риска большого внутрижелудочкового кровоизлияния в неонатальной сети Австралии и Новой Зеландии, 1995–97. Arch Dis Child Fetal Neonatal Ed. 2002;86:F86–F90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Arch Dis Child Fetal Neonatal Ed. 2002;86:F86–F90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Philip AG, Allan WC, Tito AM, Wheeler LR. Внутрижелудочковые кровоизлияния у недоношенных детей: снижение заболеваемости в 1980-х гг. Педиатрия. 1989; 84: 797–801. [PubMed] [Google Scholar]
4. Jain NJ, Kruse LK, Demissie K, Khandelwal M. Влияние способа родоразрешения на неонатальные осложнения: тенденции между 1997 и 2005 гг. J Matern Fetal Neonatal Med. 2009; 22: 491–500. [PubMed] [Google Scholar]
5. Уилсон-Костелло Д., Фридман Х., Минич Н., Фанарофф А.А., Хак М. Повышение показателей выживаемости с повышенной неврологической инвалидностью у детей с экстремально низкой массой тела при рождении в возрасте 19 лет.90-е. Педиатрия. 2005; 115:997–1003. [PubMed] [Google Scholar]
6. Whitelaw A. Внутрижелудочковое кровоизлияние и постгеморрагическая гидроцефалия: патогенез, профилактика и будущие вмешательства. Семин Неонатол. 2001; 6: 135–146. [PubMed] [Google Scholar]
7. Мерфи Б.П., Индер Т.Е., Рукс В., Тейлор Г.А., Андерсон Н.Дж., Могридж Н., Хорвуд Л.Дж., Вольпе Дж.Дж. Постгеморрагическая дилатация желудочков у недоношенных детей: естественное течение и предикторы исхода. Arch Dis Child Fetal Neonatal Ed. 2002; 87: F37–F41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мерфи Б.П., Индер Т.Е., Рукс В., Тейлор Г.А., Андерсон Н.Дж., Могридж Н., Хорвуд Л.Дж., Вольпе Дж.Дж. Постгеморрагическая дилатация желудочков у недоношенных детей: естественное течение и предикторы исхода. Arch Dis Child Fetal Neonatal Ed. 2002; 87: F37–F41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Пинто-Мартин Дж.А., Уитакер А.Х., Фельдман Дж.Ф., Ван Россем Р., Панет Н. Связь ультразвуковых аномалий черепа у детей с низким весом при рождении с двигательными или когнитивными способностями в возрасте 2, 6 и 9 лет. Dev Med Child Neurol. 1999;41:826–833. [PubMed] [Google Scholar]
9. Vohr BR, Allan WC, Westerveld M, Schneider KC, Katz KH, Makuch RW, Ment LR. Исходы школьного возраста у младенцев с очень низкой массой тела при рождении в исследовании профилактики внутрижелудочкового кровоизлияния индометацином. Педиатрия. 2003; 111:e340–e346. [PubMed] [Академия Google]
10. Розе Э., Ван Брекель К.Н., ван дер Вере К.Н., Маатуис К.Г., Мартейн А., Бос А.Ф. Функциональный исход в школьном возрасте у недоношенных детей с перивентрикулярным геморрагическим инфарктом. Педиатрия. 2009; 123:1493–1500. [PubMed] [Google Scholar]
Функциональный исход в школьном возрасте у недоношенных детей с перивентрикулярным геморрагическим инфарктом. Педиатрия. 2009; 123:1493–1500. [PubMed] [Google Scholar]
11. Антонюк С., да Силва Р.В. Перивентрикулярные и внутрижелудочковые кровоизлияния у недоношенных детей. Преподобный Нейрол. 2000; 31: 238–243. [PubMed] [Google Scholar]
12. Кенни Дж. Д., Гарсия-Пратс Дж. А., Хиллиард Дж. Л., Корбет А. Дж., Рудольф А. Дж. Гиперкапния при рождении: возможная роль в патогенезе внутрижелудочковых кровоизлияний. Педиатрия. 1978;62:465–467. [PubMed] [Google Scholar]
13. DiSalvo D Исследователи сети эпидемиологии развития. Корреляция между плацентарной патологией и внутрижелудочковым кровоизлиянием у недоношенных детей. Педиатр рез. 1998; 43:15–19. [PubMed] [Google Scholar]
14. Volpe JJ. Внутрижелудочковые кровоизлияния у недоношенных детей: современные представления. Часть I. Энн Нейрол. 1989; 25:3–11. [PubMed] [Google Scholar]
15. Ballabh P, Braun A, Nedergaard M. Анатомический анализ кровеносных сосудов в зародышевой матрице, коре головного мозга и белом веществе у развивающихся младенцев. Педиатр рез. 2004; 56: 117–124. [PubMed] [Академия Google]
Анатомический анализ кровеносных сосудов в зародышевой матрице, коре головного мозга и белом веществе у развивающихся младенцев. Педиатр рез. 2004; 56: 117–124. [PubMed] [Академия Google]
16. Ballabh P, Hu F, Kumarasiri M, Braun A, Nedergaard M. Развитие молекул плотного соединения в кровеносных сосудах зародышевого матрикса, коры головного мозга и белого вещества. Педиатр рез. 2005; 58: 791–798. [PubMed] [Google Scholar]
17. Эль-Хури Н., Браун А., Ху Ф., Пандей М., Недергаард М., Лагамма Э.Ф., Баллабх П. Концы астроцитов в зародышевом матриксе, коре головного мозга и белом веществе в развитии младенцы. Педиатр рез. 2006; 59: 673–679. [PubMed] [Google Scholar]
18. Xu H, Hu F, Sado Y, Ninomiya Y, Borza DB, Ungvari Z, Lagamma EF, Csiszar A, Nedergaard M, Ballabh P. Изменения созревания ламинина, фибронектина, коллагена IV и перлекан в зародышевой матрице, коре и белом веществе и эффект бетаметазона. J Neurosci Res. 2008; 86: 1482–1500. [PubMed] [Академия Google]
19. Braun A, Xu H, Hu F, Kocherlakota P, Siegel D, Chander P, Ungvari Z, Csiszar A, Nedergaard M, Ballabh P. Малочисленность перицитов в сосудистой матрице зародышевого матрикса недоношенных детей. Дж. Нейроски. 2007; 27:12012–12024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Braun A, Xu H, Hu F, Kocherlakota P, Siegel D, Chander P, Ungvari Z, Csiszar A, Nedergaard M, Ballabh P. Малочисленность перицитов в сосудистой матрице зародышевого матрикса недоношенных детей. Дж. Нейроски. 2007; 27:12012–12024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Ballabh P, Xu H, Hu F, Braun A, Smith K, Rivera A, Lou N, Ungvari Z, Goldman SA, Csiszar A, Nedergaard M. Angiogenic ингибирование уменьшает кровоизлияние в зародышевый матрикс. Нат Мед. 2007; 13: 477–485. [PubMed] [Академия Google]
21. Hellstrom M, Gerhardt H, Kalen M, Li X, Eriksson U, Wolburg H, Betsholtz C. Отсутствие перицитов приводит к гиперплазии эндотелия и аномальному морфогенезу сосудов. Джей Селл Биол. 2001; 153: 543–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Ballabh P, Braun A, Nedergaard M. Гематоэнцефалический барьер: обзор: структура, регулирование и клинические последствия. Нейробиол Дис. 2004; 16:1–13. [PubMed] [Google Scholar]
23. Уилкинсон М. , Хьюм Р., Стрейндж Р., Белл Дж. Э. Глиальная и нейрональная дифференцировка в головном мозге плода человека 9–23 недели беременности. Приложение Нейропатол Нейробиол. 1990; 16: 193–204. [PubMed] [Google Scholar]
, Хьюм Р., Стрейндж Р., Белл Дж. Э. Глиальная и нейрональная дифференцировка в головном мозге плода человека 9–23 недели беременности. Приложение Нейропатол Нейробиол. 1990; 16: 193–204. [PubMed] [Google Scholar]
24. Гулд С.Дж., Ховард С. Иммуногистохимическое исследование зародышевого слоя головного мозга плода человека на поздних сроках беременности. Приложение Нейропатол Нейробиол. 1987; 13: 421–437. [PubMed] [Google Scholar]
25. Сарнат Х.Б. Роль эпендимы плода человека. Педиатр Нейрол. 1992; 8: 163–178. [PubMed] [Google Scholar]
26. Моррисон Р.С., Де Веллис Дж., Ли Ю.Л., Брэдшоу Р.А., Eng LF. Гормоны и факторы роста индуцируют синтез глиального фибриллярного кислого белка в астроцитах головного мозга крысы. J Neurosci Res. 1985;14:167–176. [PubMed] [Google Scholar]
27. Hallmann R, Horn N, Selg M, Wendler O, Pausch F, Sorokin LM. Экспрессия и функция ламининов в эмбриональной и зрелой сосудистой сети. Physiol Rev. 2005; 85: 979–1000. [PubMed] [Google Scholar]
28. Тиллинг Т., Энгельбертц С., Декер С., Корте Д., Хьювел С., Галла Х.Дж. Экспрессия и адгезивные свойства белков базальной мембраны в культурах эндотелиальных клеток капилляров головного мозга. Сотовые Ткани Res. 2002; 310:19–29. [PubMed] [Академия Google]
Тиллинг Т., Энгельбертц С., Декер С., Корте Д., Хьювел С., Галла Х.Дж. Экспрессия и адгезивные свойства белков базальной мембраны в культурах эндотелиальных клеток капилляров головного мозга. Сотовые Ткани Res. 2002; 310:19–29. [PubMed] [Академия Google]
29. Джордж Э.Л., Жорж-Лабуэсс Э.Н., Патель-Кинг Р.С., Рэйберн Х., Хайнс Р.О. Дефекты мезодермы, развития нервной трубки и сосудов у эмбрионов мышей, лишенных фибронектина. Разработка. 1993; 119:1079–1091. [PubMed] [Google Scholar]
30. Форсберг Э., Челлен Л. Гепарансульфат: уроки нокаутированных мышей. Джей Клин Инвест. 2001; 108: 175–180. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Gould DB, Phalan FC, Breedveld GJ, van Mil SE, Smith RS, Schimenti JC, Aguglia U, van der Knaap MS, Heutink P, John SW. Мутации в Col4a1 вызывают перинатальное кровоизлияние в мозг и порэнцефалию. Наука. 2005; 308:1167–1171. [PubMed] [Академия Google]
32. Mao Y, Schwarzbauer JE. Фибронектиновый фибриллогенез, клеточно-опосредованный процесс сборки матрикса. Матрица биол. 2005; 24: 389–399. [PubMed] [Google Scholar]
Матрица биол. 2005; 24: 389–399. [PubMed] [Google Scholar]
33. Хокинг Д.С., Соттиле Дж., Лангенбах К.Дж. Стимуляция опосредованной интегрином сократительной способности клеток путем полимеризации фибронектина. Дж. Биол. Хим. 2000; 275:10673–10682. [PubMed] [Google Scholar]
34. Sottile J, Hocking DC, Langenbach KJ. Полимеризация фибронектина стимулирует рост клеток по RGD-зависимым и независимым механизмам. Дж. Клеточные науки. 2000; 113:4287–4299. [PubMed] [Google Scholar]
35. Мент Л.Р., Стюарт В.Б., Ардито Т.А., Мадри Дж.А. Исследования созревания зародышевого матрикса щенков бигля. Гладить. 1991; 22: 390–395. [PubMed] [Google Scholar]
36. Мент Л.Р., Стюарт В.Б., Ардито Т.А., Хуанг Э., Мадри Дж.А. Индометацин способствует созреванию микрососудов зародышевого матрикса у новорожденного щенка бигля. Гладить. 1992; 23:1132–1137. [PubMed] [Google Scholar]
37. Anstrom JA, Thore CR, Moody DM, Challa VR, Block SM, Brown WR. Морфометрическая оценка накопления коллагена в сосудах зародышевого матрикса недоношенных новорожденных человека. Приложение Нейропатол Нейробиол. 2005; 31: 181–19.0. [PubMed] [Google Scholar]
Приложение Нейропатол Нейробиол. 2005; 31: 181–19.0. [PubMed] [Google Scholar]
38. Pasinetti GM, Nichols NR, Tocco G, Morgan T, Laping N, Finch CE. Трансформирующий фактор роста бета 1 и матричная РНК фибронектина в мозге крыс: реакция на повреждение и локализация клеточного типа. Неврология. 1993; 54: 893–907. [PubMed] [Google Scholar]
39. Балабанов Р., Доре-Даффи П. Роль микрососудистого перицита ЦНС в гематоэнцефалическом барьере. J Neurosci Res. 1998; 53: 637–644. [PubMed] [Google Scholar]
40. Hirschi KK, D’Amore PA. Контроль ангиогенеза перицитом: молекулярные механизмы и значение. ЭКС. 1997;79:419–428. [PubMed] [Google Scholar]
41. Джейн Р.К. Молекулярная регуляция созревания сосудов. Нат Мед. 2003; 9: 685–693. [PubMed] [Google Scholar]
42. Lindahl P, Johansson BR, Leveen P, Betsholtz C. Потеря перицитов и образование микроаневризм у мышей с дефицитом PDGF-B. Наука. 1997; 277: 242–245. [PubMed] [Google Scholar]
43. Yancopoulos GD, Davis S, Gale NW, Rudge JS, Wiegand SJ, Holash J. Сосудисто-специфические факторы роста и формирование кровеносных сосудов. Природа. 2000; 407: 242–248. [PubMed] [Академия Google]
Сосудисто-специфические факторы роста и формирование кровеносных сосудов. Природа. 2000; 407: 242–248. [PubMed] [Академия Google]
44. Bertolino P, Deckers M, Lebrin F, ten Dijke P. Трансдукция трансдукции сигнала бета-фактора роста при ангиогенезе и сосудистых нарушениях. Грудь. 2005; 128:585С–590С. [PubMed] [Google Scholar]
45. Джайн Р.К. Нормализация сосудистой сети опухоли: новая концепция антиангиогенной терапии. Наука. 2005; 307: 58–62. [PubMed] [Google Scholar]
46. Winkler F, Kozin SV, Tong RT, Chae SS, Booth MF, Garkavtsev I, Xu L, Hicklin DJ, Fukumura D, di Tomaso E, Munn LL, Jain RK. Кинетика нормализации сосудов при блокаде VEGFR2 определяет реакцию опухоли головного мозга на облучение: роль оксигенации, ангиопоэтина-1 и матриксных металлопротеиназ. Раковая клетка. 2004; 6: 553–563. [PubMed] [Академия Google]
47. Uemura A, Ogawa M, Hirashima M, Fujiwara T, Koyama S, Takagi H, Honda Y, Wiegand SJ, Yancopoulos GD, Nishikawa S. Рекомбинантный ангиопоэтин-1 восстанавливает архитектуру более высокого порядка растущих кровеносных сосудов у мышей в отсутствие пристеночных ячеек. Джей Клин Инвест. 2002; 110:1619–1628. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 2002; 110:1619–1628. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Mu D, Jiang X, Sheldon RA, Fox CK, Hamrick SE, Vexler ZS, Ferriero DM. Регуляция индуцируемого гипоксией фактора 1альфа и индукция фактора роста эндотелия сосудов в модели неонатального инсульта у крыс. Нейробиол Дис. 2003; 14: 524–534. [PubMed] [Академия Google]
49. Цудзи М., ДюПлесси А., Тейлор Г., Крокер Р., Вольпе Дж.Дж. Спектроскопия в ближней инфракрасной области выявляет ишемию головного мозга при гипотензии у поросят. Педиатр рез. 1998; 44: 591–595. [PubMed] [Google Scholar]
50. Перлман Дж.М., Макменамин Дж.Б., Вольпе Дж.Дж. Колебания скорости мозгового кровотока при респираторно-дистресс-синдроме. Отношение к развитию внутрижелудочкового кровоизлияния. N Engl J Med. 1983; 309: 204–209. [PubMed] [Google Scholar]
51. Perlman JM, Goodman S, Kreusser KL, Volpe JJ. Уменьшение внутрижелудочковых кровоизлияний за счет устранения колебаний скорости мозгового кровотока у недоношенных детей с респираторным дистресс-синдромом. N Engl J Med. 1985;312:1353–1357. [PubMed] [Google Scholar]
N Engl J Med. 1985;312:1353–1357. [PubMed] [Google Scholar]
52. Van Bel F, Van de Bor M, Stijnen T, Baan J, Ruys JH. Этиологическая роль нарушений мозгового кровотока в развитии и распространении периинтравентрикулярных кровоизлияний. Dev Med Child Neurol. 1987; 29: 601–614. [PubMed] [Google Scholar]
53. Rennie JM, South M, Morley CJ. Вариабельность скорости мозгового кровотока у детей раннего возраста, получающих вспомогательную вентиляцию легких. Арч Дис Чайлд. 1987; 62: 1247–1251. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Муллаарт Р.А., Хопман Дж.К., Роттевел Дж.Дж., Дэниэлс О., Столинга Г.Б., Де Хаан А.Ф. Флуктуации мозгового кровотока при дыхательной недостаточности новорожденных и перивентрикулярных кровоизлияниях. Ранний Хам Дев. 1994; 37: 179–185. [PubMed] [Google Scholar]
55. Coughtrey H, Rennie JM, Evans DH. Вариабельность скорости мозгового кровотока: наблюдения в течение одной минуты у недоношенных детей. Ранний Хам Дев. 1997; 47: 63–70. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
56. du Plessis AJ. Цереброваскулярная травма у недоношенных детей: современное понимание и проблемы будущей профилактики. Клин Перинатол. 2008;35:609–641. [PubMed] [Google Scholar]
57. Soul JS, Hammer PE, Tsuji M, Saul JP, Bassan H, Limperopoulos C, Disalvo DN, Moore M, Akins P, Ringer S, Volpe JJ, Trachtenberg F, du Plessis AJ . Колеблющееся давление-пассивность характерна для нарушений мозгового кровообращения у больных недоношенных детей. Педиатр рез. 2007; 61: 467–473. [PubMed] [Google Scholar]
58. Вонг Ф.Ю., Леунг Т.С., Остин Т., Уилкинсон М., Мик Дж.Х., Вятт Дж.С., Уокер А.М. Нарушение ауторегуляции у недоношенных детей, выявленное с помощью спектроскопии с пространственным разрешением. Педиатрия. 2008; 121:e604–e611. [PubMed] [Академия Google]
59. Pryds O, Greisen G, Lou H, Friis-Hansen B. Неоднородность церебральной вазореактивности у недоношенных детей, получающих искусственную вентиляцию легких. J Педиатр. 1989; 115: 638–645.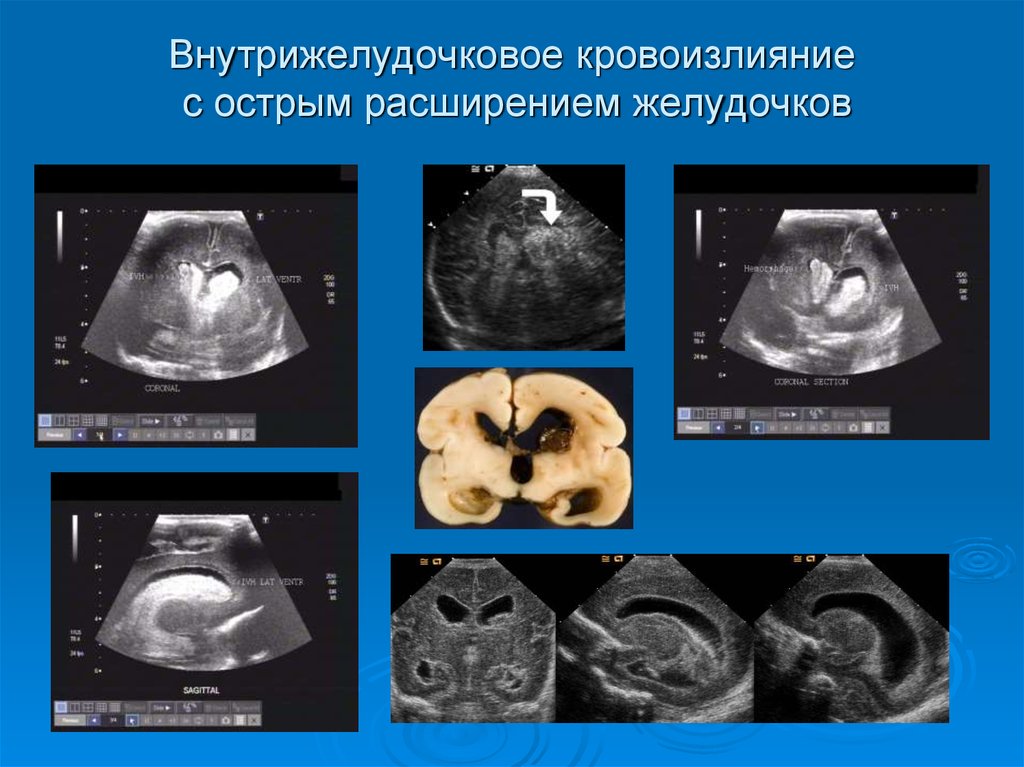 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
60. Tsuji M, Saul JP, du Plessis A, Eichenwald E, Sobh J, Crocker R, Volpe JJ. Церебральная внутрисосудистая оксигенация коррелирует со средним артериальным давлением у критически больных недоношенных детей. Педиатрия. 2000; 106: 625–632. [PubMed] [Google Scholar]
61. Reynolds KJ, Panerai RB, Kelsall AW, Rennie JM, Evans DH. Спектральная картина неонатальной скорости мозгового кровотока: сравнение со спектрами артериального давления и частоты сердечных сокращений. Педиатр рез. 1997;41:276–284. [PubMed] [Google Scholar]
62. Аль-Авил И., Персли Д.М., Рубин Л.П., Шах Б., Вайсбергер С., Ричардсон Д.К. Различия в распространенности гипотонии, гипертонии и использования вазопрессоров в отделениях интенсивной терапии. Дж. Перинатол. 2001; 21: 272–278. [PubMed] [Google Scholar]
63. Фанаров Ю.М., Фанаров А.А. Нарушения артериального давления у новорожденных: гипотензия и гипертония. Semin Fetal Neonatal Med. 2006; 11: 174–181. [PubMed] [Google Scholar]
64. Miall-Allen VM, de Vries LS, Whitelaw AG. Среднее артериальное давление и неонатальные поражения головного мозга. Арч Дис Чайлд. 1987;62:1068–1069. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Miall-Allen VM, de Vries LS, Whitelaw AG. Среднее артериальное давление и неонатальные поражения головного мозга. Арч Дис Чайлд. 1987;62:1068–1069. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Watkins AM, West CR, Cooke RW. Артериальное давление, кровоизлияние в мозг и ишемия у младенцев с очень низкой массой тела при рождении. Ранний Хам Дев. 1989; 19: 103–110. [PubMed] [Google Scholar]
66. Bada HS, Korones SB, Perry EH, Arheart KL, Ray JD, Pourcyrous M, Magill HL, Runyan W, 3rd, Somes GW, Clark FC. Средние изменения артериального давления у недоношенных детей и детей с риском внутрижелудочкового кровоизлияния. J Педиатр. 1990;117:607–614. [PubMed] [Google Scholar]
67. Weindling AM, Wilkinson AR, Cook J, Calvert SA, Fok TF, Rochefort MJ. Перинатальные события, предшествующие перивентрикулярному кровоизлиянию и лейкомаляции у новорожденных. Br J Obstet Gynaecol. 1985; 92: 1218–1223. [PubMed] [Google Scholar]
68. Muller AM, Morales C, Briner J, Baenziger O, Duc G, Bucher HU. Потеря реактивности церебрального кровотока на CO2 связана с тяжелым повреждением головного мозга у младенцев с очень низкой массой тела при рождении, находящихся на искусственной вентиляции легких. Eur J Paediatr Neurol. 1997;1:157–163. [PubMed] [Google Scholar]
Потеря реактивности церебрального кровотока на CO2 связана с тяжелым повреждением головного мозга у младенцев с очень низкой массой тела при рождении, находящихся на искусственной вентиляции легких. Eur J Paediatr Neurol. 1997;1:157–163. [PubMed] [Google Scholar]
69. Volpe JJ. Внутричерепное кровоизлияние: кровоизлияние в зародышевый матрикс. В: Volpe JJ, редактор. Неврология новорожденного. Филадельфия: Сондерс Эльзевир; 2008. стр. 517–288. [Google Scholar]
70. Ghazi-Birry HS, Brown WR, Moody DM, Challa VR, Block SM, Reboussin DM. Зародышевый матрикс человека: венозное происхождение кровотечения и сосудистые характеристики. AJNR Am J Нейрорадиол. 1997; 18: 219–229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Wigglesworth JS, Keith IH, Girling DJ, Slade SA. Болезнь гиалиновых мембран, щелочь и внутрижелудочковое кровоизлияние. Арч Дис Чайлд. 1976;51:755–762. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Андерсон Дж. М., Бейн А. Д., Браун Дж.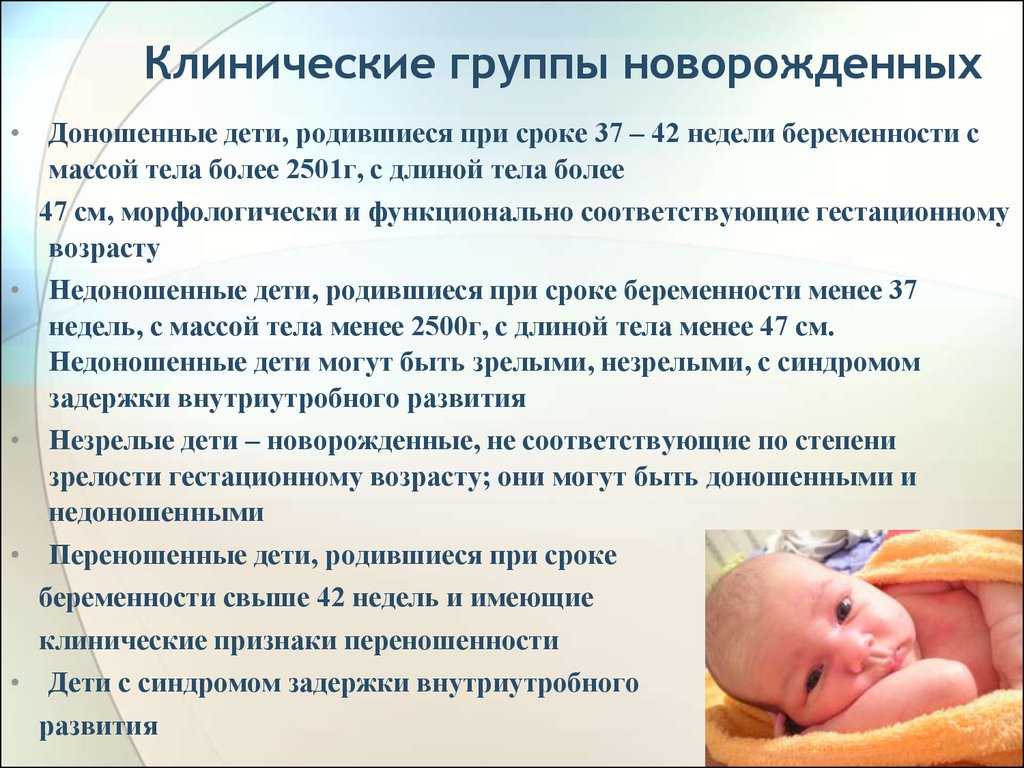 К., Кокберн Ф., Форфар Дж. О., Мачин Г. А., Тернер Т. Л. Болезнь гиалиновых мембран, обработка щелочным буфером и церебральная внутрижелудочковая геморрагия. Ланцет. 1976; 1: 117–119. [PubMed] [Google Scholar]
К., Кокберн Ф., Форфар Дж. О., Мачин Г. А., Тернер Т. Л. Болезнь гиалиновых мембран, обработка щелочным буфером и церебральная внутрижелудочковая геморрагия. Ланцет. 1976; 1: 117–119. [PubMed] [Google Scholar]
73. Iadecola C, Nedergaard M. Глиальная регуляция микроциркуляторного русла головного мозга. Нат Нейроски. 2007; 10:1369–1376. [PubMed] [Google Scholar]
74. Hill MA, Sun Z, Martinez-Lemus L, Meininger GA. Новые технологии анализа артериолярного миогенного ответа. Trends Pharmacol Sci. 2007; 28: 308–315. [PubMed] [Академия Google]
75. Iadecola C. Нервно-сосудистая регуляция в нормальном мозге и при болезни Альцгеймера. Нат Рев Нейроски. 2004; 5: 347–360. [PubMed] [Google Scholar]
76. Филлис Дж.В. Аденозиновые и адениновые нуклеотиды как регуляторы мозгового кровотока: роль ацидоза, набухания клеток и КАТФ-каналов. Критический преподобный Нейробиол. 2004; 16: 237–270. [PubMed] [Google Scholar]
77. Niwa K, Araki E, Morham SG, Ross ME, Iadecola C. Циклооксигеназа-2 способствует функциональной гиперемии в коре усов. Дж. Нейроски. 2000; 20: 763–770. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Циклооксигеназа-2 способствует функциональной гиперемии в коре усов. Дж. Нейроски. 2000; 20: 763–770. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Niwa K, Haensel C, Ross ME, Iadecola C. Циклооксигеназа-1 участвует в отдельных сосудорасширяющих реакциях мозгового кровообращения. Цирк рез. 2001; 88: 600–608. [PubMed] [Google Scholar]
79. Upton RN, Rasmussen M, Grant C, Martinez AM, Cold GE, Ludbrook GL. Фармакокинетика и фармакодинамика индометацина: влияние на мозговой кровоток у анестезированных овец. Clin Exp Pharmacol Physiol. 2008; 35: 317–323. [PubMed] [Google Scholar]
80. Эндрю М., Касл В., Сайгал С., Картер С., Келтон Дж. Г. Клинические последствия неонатальной тромбоцитопении. J Педиатр. 1987;110:457–464. [PubMed] [Google Scholar]
81. Луптон Б.А., Хилл А., Уитфилд М.Ф., Картер С.Дж., Уодсворт Л.Д., Роланд Э.Х. Снижение числа тромбоцитов как фактор риска внутрижелудочкового кровоизлияния. Am J Dis Чайлд. 1988; 142:1222–1224. [PubMed] [Google Scholar]
82. Ширахата А., Накамура Т., Шимоно М., Канеко М., Танака С. Результаты свертывания крови и эффективность концентрата фактора XIII у недоношенных детей с внутричерепными кровоизлияниями. Рез. Тромб. 1990; 57: 755–763. [PubMed] [Академия Google]
Ширахата А., Накамура Т., Шимоно М., Канеко М., Танака С. Результаты свертывания крови и эффективность концентрата фактора XIII у недоношенных детей с внутричерепными кровоизлияниями. Рез. Тромб. 1990; 57: 755–763. [PubMed] [Академия Google]
83. Гопел В., Хартель С., Аренс П., Кониг И., Каттнер Э., Кульс Э., Кустер Х., Моллер Дж., Мюллер Д., Рот Б., Сегерер Х., Виг С., Хертинг Э. Генотип интерлейкина-6-174 , сепсис и повреждение головного мозга у новорожденных с очень низкой массой тела при рождении. Гены Иммун. 2006; 7: 65–68. [PubMed] [Google Scholar]
84. Harding DR, Dhamrait S, Whitelaw A, Humphries SE, Marlow N, Montgomery HE. Влияет ли генотип интерлейкина-6 на повреждение головного мозга или прогресс развития после преждевременных родов? Педиатрия. 2004; 114: 941–9.47. [PubMed] [Google Scholar]
85. Harding D, Brull D, Humphries SE, Whitelaw A, Montgomery H, Marlow N. Изменение гена интерлейкина-6 связано с нарушением когнитивного развития у недоношенных детей: предварительное исследование. Педиатр рез. 2005; 58: 117–120. [PubMed] [Google Scholar]
Педиатр рез. 2005; 58: 117–120. [PubMed] [Google Scholar]
Что такое внутрижелудочковое кровоизлияние? IVH
Внутрижелудочковое кровоизлияние может произойти без предупреждения. Результатом кровоизлияния в мозг часто является повреждение, нарушающее способность мозга контролировать когнитивные и двигательные функции. Различают четыре стадии кровотечения, каждая из которых может представлять значительную опасность для новорожденных и младенцев и требует деликатного хирургического вмешательства.
Что такое внутрижелудочковое кровоизлияние?Черепно-мозговая травма – кровоизлияние в мозг
Кровоизлияние в мозг, клинически называемое внутрижелудочковым кровоизлиянием или ВЖК, может повредить или убить участки мозга, имеющие решающее значение для развития и двигательной функции. Когда это происходит, результирующее нарушение, а также тяжесть нарушения зависят от местоположения и степени повреждения. Кровоизлияние может быть артериальным или венозным.
- Артериальное кровотечение приводит к дополнительной потере кислорода тканями, поскольку артерии несут насыщенную кислородом кровь к сердцу.
- Венозное кровотечение — это внутренние кровоизлияния, поражающие вены, возвращающие кровь к сердцу. Артериальные кровотечения труднее остановить, чем венозные.
Кровотечение есть кровотечение. Когда кровотечение изолировано в определенном органе или ткани, может возникнуть локальный отек, известный как гематома. Гематома может повредить и убить окружающие ткани, сдавливая ткань или уменьшая ее кровоснабжение. Механизмы свертывания крови или отек, которые блокируют кровоснабжение, в конечном итоге остановят гематому.
Какие существуют четыре степени внутрижелудочкового кровоизлияния?
Внутрижелудочковое кровоизлияние является значительным фактором риска церебрального паралича. Это чаще всего встречается у недоношенных детей, особенно у тех, кто перенес респираторный дистресс-синдром, коллапс легкого или высокое кровяное давление. Внутрижелудочковое кровоизлияние чаще всего происходит в первые 48 часов после рождения и с меньшей вероятностью по мере взросления младенцев. Внутрижелудочковое кровоизлияние подразделяется на четыре степени (степени с I по IV) в зависимости от степени тяжести.
Внутрижелудочковое кровоизлияние чаще всего происходит в первые 48 часов после рождения и с меньшей вероятностью по мере взросления младенцев. Внутрижелудочковое кровоизлияние подразделяется на четыре степени (степени с I по IV) в зависимости от степени тяжести.
- Стадии I и II обычно связаны с небольшим объемом кровотечения в желудочках и обычно не вызывают долговременных проблем.
- Степени III и IV влекут за собой более сильное кровотечение, которое приводит к отеку или обструкции головного мозга.
Отек и непроходимость, в свою очередь, могут привести к состоянию, называемому гидроцефалией — повышенному содержанию жидкости в головном мозге, — которое вызывает опасное давление и может потребовать хирургических процедур для снятия.
Изменения артериального давления также могут привести к разрыву тонких кровеносных сосудов младенцев. Младенцы, подключенные к аппаратам ИВЛ, вызывают особую озабоченность; хотя большое внимание уделяется предотвращению разрыва, возможно, ребенок может дышать не синхронно с респиратором и вызывать повышенное давление в легких и головном мозге.
Каковы факторы риска внутрижелудочкового кровоизлияния?
Факторы риска внутрижелудочкового кровоизлияния включают:
- Плацентарные тромбы
- Аномальные или слабые кровеносные сосуды головного мозга
- Нарушения свертывания крови
- Высокое кровяное давление (гипертония) у матери
- Материнская инфекция
- Воспалительные заболевания органов малого таза
- Синдром встряхивания ребенка
- Травма головы
Каковы наиболее частые признаки внутричерепного кровоизлияния?
Наиболее частые признаки внутричерепного кровоизлияния включают:
- Апноэ (дыхательные паузы)
- Бледная или синяя окраска
- Аномальное движение глаз
- Пронзительный крик
- Изъятия
- Снижение мышечного тонуса
- Снижение рефлексов
- Чрезмерный сон
- Летаргия
- Слабое сосание
- Падший анализ крови
Младенцам, рожденным недоношенными, рекомендуется проводить рутинное ультразвуковое исследование черепа между 7 и 14 днями жизни, а второе — в первоначальный срок родов. Дополнительные УЗИ назначаются, если у недоношенного ребенка появляются новые признаки или симптомы, особенно если его или ее здоровье внезапно ухудшается. Подсчитано, что УЗИ выявит проблемы, требующие дополнительного наблюдения, у 25% детей, рожденных до 30 недель беременности.
Дополнительные УЗИ назначаются, если у недоношенного ребенка появляются новые признаки или симптомы, особенно если его или ее здоровье внезапно ухудшается. Подсчитано, что УЗИ выявит проблемы, требующие дополнительного наблюдения, у 25% детей, рожденных до 30 недель беременности.
Какие пять форм внутрижелудочкового кровоизлияния существуют?
Пять форм внутрижелудочкового кровоизлияния:
Внутрижелудочковое кровоизлияние Внутрижелудочковое кровоизлияние и гипербилирубинемия, повышенный уровень билирубина в крови, представляют значительный риск развития церебрального паралича. Этот тип кровоизлияния обычно вызывается внутрипаренхиматозным кровоизлиянием в мозолистое тело, мостик нервной ткани, соединяющий два полушария головного мозга, обеспечивающий связь между ними. При осмотре обычно обнаруживают кровь в боковых желудочках. Внутрижелудочковое кровоизлияние чаще встречается у недоношенных детей, которые подверглись физическому стрессу из-за респираторного дистресс-синдрома, высокого кровяного давления или аномального присутствия воздуха или газа в легких, что приводит к коллапсу легкого.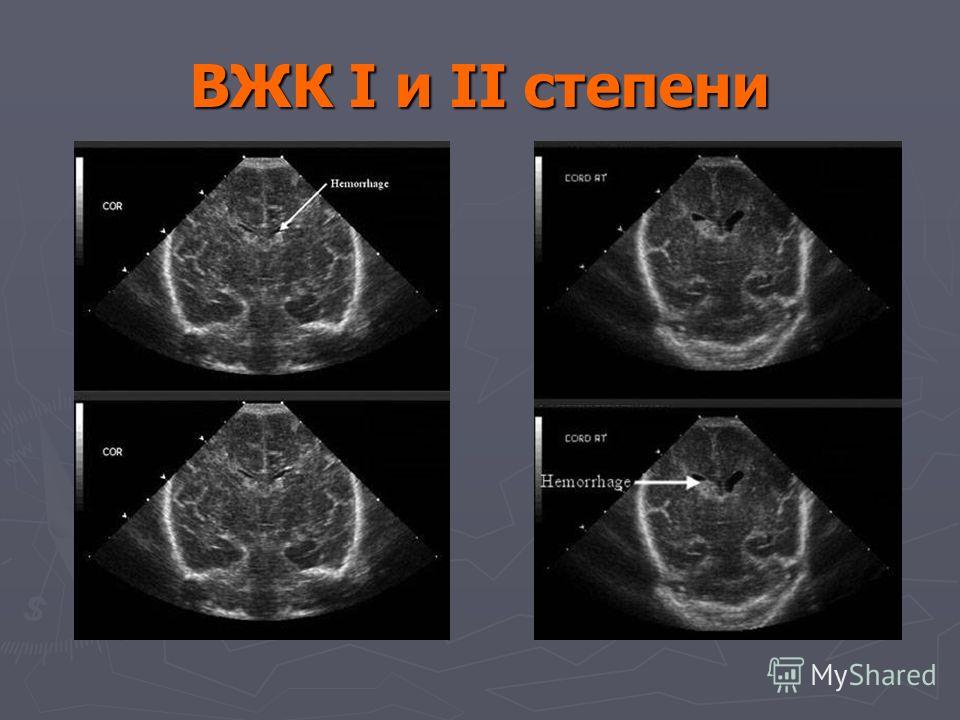 Это состояние может возникать в редких случаях у доношенных детей, но редко присутствует при рождении. Травма головы, синдром встряхивания ребенка или инсульт плода являются частыми причинами внутрижелудочкового кровоизлияния. Факторы риска, повышающие вероятность инсульта плода, включают тромбы плаценты, неправильно сформированные или слабые кровеносные сосуды в головном мозге, высокое кровяное давление матери (гипертонию), материнскую инфекцию, воспалительные заболевания органов малого таза или нарушения свертывания крови.
Это состояние может возникать в редких случаях у доношенных детей, но редко присутствует при рождении. Травма головы, синдром встряхивания ребенка или инсульт плода являются частыми причинами внутрижелудочкового кровоизлияния. Факторы риска, повышающие вероятность инсульта плода, включают тромбы плаценты, неправильно сформированные или слабые кровеносные сосуды в головном мозге, высокое кровяное давление матери (гипертонию), материнскую инфекцию, воспалительные заболевания органов малого таза или нарушения свертывания крови.
Эпидуральная гематома возникает в результате разрыва артерий и поверхностных венозных синусов. Чаще всего это связано с внезапной травмой головы или несчастным случаем. Хотя мозг не поврежден, в 60–90% эпидуральных гематом имеется лежащий в основе перелом. Часто требуется хирургическое вмешательство для удаления гематомы и снятия давления. У детей классический симптом кратковременной и постепенной потери сознания встречается редко. Считается, что у детей старше 6 лет травма боковой части головы, например, полученная при падении с велосипеда, является наиболее частым событием, которое может привести к эпидуральной гематоме.
Считается, что у детей старше 6 лет травма боковой части головы, например, полученная при падении с велосипеда, является наиболее частым событием, которое может привести к эпидуральной гематоме.
Субдуральная гематома, как правило, является более серьезным заболеванием, чем эпидуральная гематома, и часто является компонентом более тяжелых травм головы. Субдуральная гематома возникает в результате прямой травмы, тяжелой травмы ускорения-замедления или тряски. У детей субдуральные гематомы могут возникать в результате родовой травмы, жестокого обращения с детьми или синдрома встряхивания ребенка. Клинические признаки субдуральной гематомы у детей раннего возраста включают раздражительность, вялость, рвоту и выпячивание мягкого участка. В случаях жестокого обращения у ребенка часто наблюдается немедленная потеря сознания, головная боль, изменение личности, ригидность затылочных мышц, судороги, рвота, субфебрильная температура и папиллярное расширение. Как правило, после травмы головы и потери сознания может произойти некоторое выздоровление, но маловероятно, что ребенок вернется в свое нормальное состояние. Смертность среди пациентов с субдуральной гематомой значительна из-за высокой частоты ассоциированных необратимых повреждений головного мозга.
Как правило, после травмы головы и потери сознания может произойти некоторое выздоровление, но маловероятно, что ребенок вернется в свое нормальное состояние. Смертность среди пациентов с субдуральной гематомой значительна из-за высокой частоты ассоциированных необратимых повреждений головного мозга.
Субарахноидальная гематома венозная (относящаяся к венам). Это наиболее распространенный тип внутрижелудочкового кровоизлияния после родовой травмы. Внутрижелудочковые кровоизлияния в результате родовой травмы чаще всего субарахноидальные (кровоизлияние в голову между двумя оболочками, окружающими мозг). Субарахноидальные гематомы приводят к классической задней межполушарной области, аналогично обнаруженной в случаях синдрома встряхивания ребенка, но также вызывают кровоизлияние в субарахноидальное пространство. У ребенка с субарахноидальной гематомой, скорее всего, разовьются судороги в течение 48 часов после рождения. У ребенка может появиться ригидность затылочных мышц и вялость. Практикующие врачи, скорее всего, будут использовать люмбальную пункцию, чтобы исключить менингит, прежде чем диагностировать этот тип гематомы. КТ без контрастного усиления часто используется для обнаружения до 90% всех субарахноидальных кровотечений в течение первых 24 часов после травмы.
Практикующие врачи, скорее всего, будут использовать люмбальную пункцию, чтобы исключить менингит, прежде чем диагностировать этот тип гематомы. КТ без контрастного усиления часто используется для обнаружения до 90% всех субарахноидальных кровотечений в течение первых 24 часов после травмы.
Внутримозговое кровоизлияние (ВМК) представляет собой разрыв кровеносных сосудов между мозгом и черепом, который часто возникает, когда мозг не может поглощать силу удара при травме головы. Неврологическое повреждение может возникнуть, если возникает дополнительное кровотечение и содержится спинномозговая жидкость. Двумя наиболее распространенными областями мозга, в которых возникает этот тип кровоизлияния, являются передняя часть височной доли и задняя часть лобной доли. Хотя травма головы может казаться незначительной, гематома может быть опасной для жизни и часто требует немедленных хирургических процедур для снятия давления, вызванного сдавлением мозговой ткани. Этот тип кровоизлияния не характерен для детей.
Этот тип кровоизлияния не характерен для детей.
Причина: Уточнение терминологии
Поскольку используемая терминология настолько специфична, но удивительно похожа, такие термины, как дефект головного мозга, порок развития головного мозга и поражение головного мозга, могут показаться запутанными. Полезно знать разницу между терминами при попытке понять причину церебрального паралича.
Развитие мозга начинается вскоре после зачатия. Относительно небольшое количество клеток делится и размножается в миллиарды клеток. Небольшая полоска ткани скручивается в нервную трубку. Один конец развивается в головной, другой в спинной мозг. Повсюду формируются, группируются и мигрируют различные типы клеток, образуя различные области мозга. Мозг считается полностью развитым через два-пять лет после рождения.
Дефекты головного мозга — это аномалии в структуре головного мозга, которые обычно вызывают нарушения. Дефекты могут возникать в результате уродства, травмы, болезни или заболевания. Степень нарушения часто связана с тяжестью повреждения. Мозг иногда компенсирует дефекты, по сути, путем «перестройки», чтобы обойти или компенсировать поврежденные области. По этой причине обычно рекомендуется начинать лечение как можно раньше.
Степень нарушения часто связана с тяжестью повреждения. Мозг иногда компенсирует дефекты, по сути, путем «перестройки», чтобы обойти или компенсировать поврежденные области. По этой причине обычно рекомендуется начинать лечение как можно раньше.
Пороки развития головного мозга — дефекты, возникающие в результате аномального развития головного мозга. Хотя дефекты могут возникнуть в любой момент внутриутробного развития, в первые 20 недель младенец наиболее уязвим; любой порок развития, возникающий во время формирования нервной трубки, может иметь необратимые последствия. Пороки развития головного мозга могут привести к неразвитым областям, аномальному росту, порокам развития или неправильному разделению мозга на полушария и доли.
Поражения головного мозга — дефекты, возникающие в результате травмы или болезни. К причинам поражения головного мозга в период внутриутробного развития относят кровоизлияния в мозг, инфекции, токсины, асфиксию и многие другие.

 Практика
Практика