Содержание
Вопрос задает – Анна, — вопрос-ответ от специалистов клиники «Мать и дитя»
23.10.2014
Здравствуйте! Помогите, пожалуйста. У меня такая ситуация. Мне 24 года, замужем, половая жизнь с 21 года, беременностей, абортов не было, половой партнер один. В 2000 г. на фоне сильного стресса (умерла мама) я похудела с 46 разм. до 44. В этом же году уехала за границу на стажировку на полгода, там постепенно начала успокаиваться и набирать вес. Постепенно вернулась к 46 разм., а потом поправилась до 48. После возвращения из заграницы сбился менструальный цикл, месячные задерживались, 1-2 недели могли быть мажущие кровянистые выделения, а месячные отсутствовали. Обратилась к гинекологу, установили дисфункцию яичников. Пила 3 месяца норколут с 16 по 25 день, потом регивидон с 5 по 25 — 6 месяцев, потом по УЗИ установили мультифолликулярные изменения яичников и прописали Диане-35, которые я пила 1, 5 года. Затем вышла замуж, в будущем планировала беременность, обратилась к гинекологу-эндокринологу. Сделав мне УЗИ, она сказала, что у меня поликистоз (гормоны я не сдавала), первичное бесплодие. Прописала утрожестан с 16 по 25 день цикла, на фоне которого у меня на 10 дней задерживались менструациии и были мажущие кровянистые выделения в середине цикла. Утрожестан я пила 3 месяца, предохранялась презервативом. Потом 2 месяца пила регулон, чтобы забеременеть на фоне его отмены. Не получилось (в течение 2 месяцев). Потом была назначена стимуляция. В июне 2004 назначили стимуляцию клостилбегитом (50 мг в день) с 5 по 9 день цикла + дуфастон 2 табл. в день с 16 по 25 день цикла. Беременности нет. В июле была проверка проходимости маточных труб рентгеном (трубы проходимы), стимуляция не проводилась, пила дюфастон с 16 по 25 день цикла. В августе доза клостилбегита увеличена до 100 мг в день + дуфастон по той же схеме + с 18 дня менструального цикла до 1 дня следующего цикла дексаметазон 1/2 табл. (повышен тестостерон). Беременности не было, при этом в июле и августе менструация задерживалась, во время чего была сильная тошнота.
Сделав мне УЗИ, она сказала, что у меня поликистоз (гормоны я не сдавала), первичное бесплодие. Прописала утрожестан с 16 по 25 день цикла, на фоне которого у меня на 10 дней задерживались менструациии и были мажущие кровянистые выделения в середине цикла. Утрожестан я пила 3 месяца, предохранялась презервативом. Потом 2 месяца пила регулон, чтобы забеременеть на фоне его отмены. Не получилось (в течение 2 месяцев). Потом была назначена стимуляция. В июне 2004 назначили стимуляцию клостилбегитом (50 мг в день) с 5 по 9 день цикла + дуфастон 2 табл. в день с 16 по 25 день цикла. Беременности нет. В июле была проверка проходимости маточных труб рентгеном (трубы проходимы), стимуляция не проводилась, пила дюфастон с 16 по 25 день цикла. В августе доза клостилбегита увеличена до 100 мг в день + дуфастон по той же схеме + с 18 дня менструального цикла до 1 дня следующего цикла дексаметазон 1/2 табл. (повышен тестостерон). Беременности не было, при этом в июле и августе менструация задерживалась, во время чего была сильная тошнота.
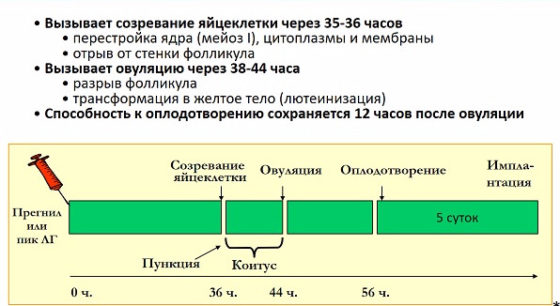
 е. не блокирует ли он ее, и прогестерон ведь способствует сгущению шеечной слизи? Вопрос 4: была ли в последнем цикле стимуляции овуляция или это так называемая лютеинизация неовулировавшего фолликула?
Помогите, пожалуйста, я в растерянности не знаю, что делать дальше. Извините за длинный вопрос.
Спасибо.
С уважением, Анна
е. не блокирует ли он ее, и прогестерон ведь способствует сгущению шеечной слизи? Вопрос 4: была ли в последнем цикле стимуляции овуляция или это так называемая лютеинизация неовулировавшего фолликула?
Помогите, пожалуйста, я в растерянности не знаю, что делать дальше. Извините за длинный вопрос.
Спасибо.
С уважением, АннаЛекарственные Препараты Используемые Для Стимуляции Яичников — IVF Fertility Center
Летрозол – препарат применяемый для стимуляции овуляции при ановуляторном бесплодии, или с целью получения нескольких фолликулов при овуляторных циклах. Фемара назначается также при различных нарушениях менструального цикла. Фемара является антиэстрогенным препаратом, приводящим к понижению уровня эстрогенов в крови, в результате чего в организме вырабатывается большое количество ФСГ, который действует на яичники и приводит к образованию одного или нескольких фолликулов. Примерно 30% женщин, которые после получения клостилбегита не имели овуляции, после приема Фемары как правило овулируют. Препарат принимают по 1 или 2 таблетки в день, в одно и тоже время суток в течении 5 дней, начиная с 3, 4 или 5 дня менструального цикла.
Препарат принимают по 1 или 2 таблетки в день, в одно и тоже время суток в течении 5 дней, начиная с 3, 4 или 5 дня менструального цикла.
Несмотря на то, что многие женщины принимая Фемару не отмечают жалоб, у некоторых все-таки могут наблюдаться боли в костях, приливы жара, расстройство желудка, боли в суставах, усталость, головокружение, кашель, головные боли, бессонница. Обычно после приема всего 5 таблеток Фемары, такие побочные эффекты не встречаются, но при их наличии нужно сразу обратится к лечащему врачу. После приема Фемары повышаются шансы на беременность, и в 5-8% случаев могут быть двойни в случае, если в период стимуляции было получено более одного фолликула. Тройни встречаются очень редко (менее 1%). После приема Фемары не наблюдается увеличения случаев с выкидышами, мертворождением или пороками развития плода. А также не отмечается повышения риска развития рака яичника или молочных желез.
Кломифен Цитрат
Это лекарство, которое применяется для стимуляции овуляции у женщин с ановуляторным бесплодием, или для получения нескольких фолликулов у женщин с овуляторными циклами. Клостилбегит непосредственно блокирует рецепторы эстрогенов, что приводит к понижению уровня эстрогенов в крови. Это в свою очередь приводит к увеличению выработки ФСГ в гипофизе. ФСГ воздействует на яичники , в которых начинают расти фолликулы (один или несколько). Дозу клостилбегита подбирает врач, в зависимости от конкретной ситуации.
Клостилбегит непосредственно блокирует рецепторы эстрогенов, что приводит к понижению уровня эстрогенов в крови. Это в свою очередь приводит к увеличению выработки ФСГ в гипофизе. ФСГ воздействует на яичники , в которых начинают расти фолликулы (один или несколько). Дозу клостилбегита подбирает врач, в зависимости от конкретной ситуации.
Как Принимать Клофимен Цитрат?
Пациент должен принимать препарат в одно и то же время суток, начиная с 3,4 или 5 дня менструального цикла в течении 5 дней. Однако перед началом стимуляции клостилбегитом необходимо провести УЗИ и определить уровень некоторых гормонов в крови. В случаях, если на 3 день менструального цикла уровни ФСГ и Е2 повышены, или имеются остаточные кисты диаметром 2см и более, клостилбегит нельзя назначать. Через 5 дней после приема препарата необходимо провести УЗИ и некоторые анализы крови, что дает возможность оценить ответ организма на стимуляцию, т.е. сколько имеется доминантных фолликулов и какая толщина эндометрия.
Многие женщины принимая клостилбегит не предьявляют никаких жалоб, однако у некоторых наблюдаются приливы жара, изменение настроения, раздражительность и бессонница. Часто эти явления проходят сразу после прекращения принятия препарата. Очень редко могут развиться зрительные нарушения, такие как скотомы, т.е. появление белых пятен в поле зрения. В таких случаях необходимо сразу же прекратить прием препарата и обратиться к врачу. Клостилбегит повышает шансы на беременность и даже в 5-8% случаев имеется возможность развития двойни (тройня, цетверня и т.д. встречаются еще реже).
Гиперстимуляция Как Побочный Эффект
Теоретически после приема клостилбегита возможно развитие синдрома гиперстимуляции яичников, когда происходит рост 3х и более фолликулов. Этот процесс контролируется при помощи УЗИ и гормональных исследований, и при подозрении на его развитие нужно немедленно отменить стимуляцию. После принятия клостилбегита не наблюдается увеличения случаев с выкидышами, мертворождением или пороками развития плода. А также нет данных об увеличении случаев рака яичников или молочных желез после приема клостилбегита.
А также нет данных об увеличении случаев рака яичников или молочных желез после приема клостилбегита.
Ганодотропин
Гонадотропинами являются препараты стимуляции овуляции, которые вводятся в виде иньекций. К ним относятся чистые гонадотропины, содержащие только ФСГ (Гонал-Ф, Пурегон, Фоллитропин и.т.д.), а также человеческие менопаузальные гонадотропины, которые включают в себя ФСГ и ЛГ (Менотропин, Менопур, Меногон и т.д.). Эти препараты назначаются при ановуляторном бесплодии с целью достижения овуляции, а также для повышения шансов на беременность в случае овуляторных циклов, т.е. после назначения гонадотропинов созревает большее число фолликулов с соответствующими фолликулами внутри них. Кроме того гонадотропины используются для получения многих фолликулов при подготовке к программе ЭКО. Перед назначением гонадотропинов нужно провести УЗИ и некоторые гормональные исследования для исключения наличия остаточных кист в яичниках. При высоких уровнях ФСГ и Е2 необходимо отменить стимуляцию. После получения иньекций гонадотропинов, нужно провести УЗИ и некоторые анализы крови. Каждая женщина по-разному отвечает на стимуляцию. Обычно УЗИ проводят через 4 дня после получения иньекций, а далее еще чаще, возможно даже каждый день до достижения фолликула 18мм. Далее назначается иньекция хорионического гонадотропина, после чего как известно происходит овуляция через 36-40 часов. И в течении этого времени либо проводятся внутриматочные инсеминации, либо происходит половое сношение.
После получения иньекций гонадотропинов, нужно провести УЗИ и некоторые анализы крови. Каждая женщина по-разному отвечает на стимуляцию. Обычно УЗИ проводят через 4 дня после получения иньекций, а далее еще чаще, возможно даже каждый день до достижения фолликула 18мм. Далее назначается иньекция хорионического гонадотропина, после чего как известно происходит овуляция через 36-40 часов. И в течении этого времени либо проводятся внутриматочные инсеминации, либо происходит половое сношение.
Многие женщины в период стимуляции гонадотропинами не отмечают никаких жалоб, однако некоторые женщины жалуются на напряжение в молочных железах, перепады настроения, вздутие живота, чувство усталости и некоторые другие. Часто эти явления исчезают сразу же после прекращения иньекций.
Иньекции гонадотропинов повышают шансы на беременность, а в 25% случаев увеличивают вероятность развития двойни (тройни-5%, четверни-1%). Если в процессе стимуляции созревает большое количество фолликулов, то пациентка должна быть информирована о потенциальном риске развития многоплодной беременности, и в данном случае нужно либо воздержатся от половых сношений или внутриматочных инсеминаций, либо перейти на программу экстракорпорального оплодотворения — ЭКО.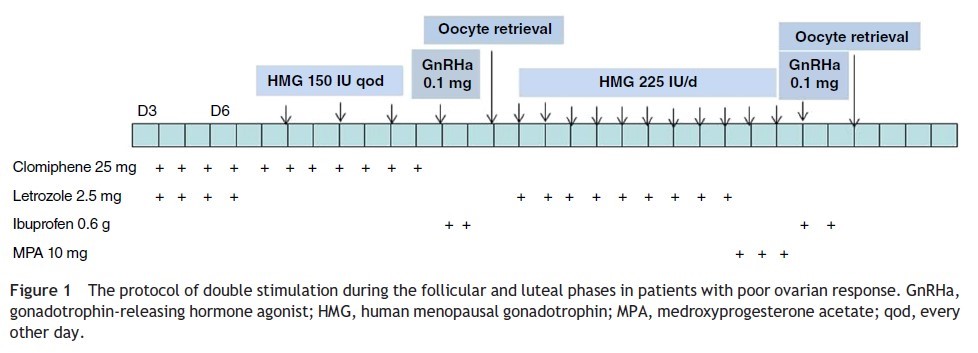 Иногда после стимуляции гонадотропинами имеется риск развития синдрома гиперстимуляции яичников, при котором уровень Е2 превышает 1500рg/mg. и имеется большое количество зрелых фолликулов. При этом женщины отмечают вздутие живота, тошноту и уменьшение количества суточной мочи. Синдром гиперстимуляции яичников встречается не чаще чем в 5% случаев стимуляции и является обратимым процессом. Для того чтобы предотвратить этот синдром, нужно уменьшить дозы гонадотропинов , а также чаще проводить УЗИ.
Иногда после стимуляции гонадотропинами имеется риск развития синдрома гиперстимуляции яичников, при котором уровень Е2 превышает 1500рg/mg. и имеется большое количество зрелых фолликулов. При этом женщины отмечают вздутие живота, тошноту и уменьшение количества суточной мочи. Синдром гиперстимуляции яичников встречается не чаще чем в 5% случаев стимуляции и является обратимым процессом. Для того чтобы предотвратить этот синдром, нужно уменьшить дозы гонадотропинов , а также чаще проводить УЗИ.
Однако если не смотря ни на что развивается синдром гиперстимуляции яичников, то нужно либо прекратить стимуляцию, либо перейти к программе ЭКО. После стимуляции гонадотропинами не наблюдается увеличения случаев с пороками развития плода, мертворождением или выкидышами. А также не наблюдается увеличения риска развития рака яичников и молочных желез.
Menopur для индукции овуляции | Форум поддержки друзей фертильности
JavaScript отключен.
1 — 20 из 30 сообщений
полумесяц
·Зарегистрировано
полумесяц
·Зарегистрировано
Марипоса15
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
· Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
полумесяц
·Зарегистрировано
Лиззи Фокс
·Зарегистрировано
1 — 20 из 30 Сообщений
- Это старая тема, возможно, вы не получили ответа и, возможно, старая тема возрождается.
 Пожалуйста, рассмотрите возможность создания новой темы.
Пожалуйста, рассмотрите возможность создания новой темы.
Верх
Отчет о клиническом случае: Индукция овуляции у большого однорогого носорога (Rhinoceros unicornis)
Введение
Средняя продолжительность эстрального цикла большого однорогого носорога (GOH) составляет 43 ± 6 дней (1, 2). Как и все другие виды носорогов, носорог GOH ( Rhinoceros unicornis ) является моноовуляторной. Фолликулы растут волнами, из которых развивается доминантный преовуляторный фолликул. Преовуляторный фолликул Граафа имеет исключительный диаметр 10–12 см, что намного больше, чем у других видов носорогов. Фактически, с объемом 300-500 мл, это самый большой овуляторный фолликул, описанный для любого вида млекопитающих (2).
Несмотря на наличие глубоких знаний о репродукционной биологии носорогов с ГОГ, у многих особей наблюдается субфертильность или бесплодие, тихая эстральная и анэстральная стадии, ранняя эмбриональная смерть или мертворождение (3–5). Раннее и регулярное разведение в неволе имеет большое значение для самок носорогов GOH из-за высокой распространенности у них опухолей половых путей и последующего прекращения размножения к 18 годам в неволе (4). До настоящего времени при искусственном осеменении (ИИ) использовалась вспомогательная репродукция с использованием свежей и замороженно-размороженной спермы (5). Частота наступления беременности после ИИ до 50% достигалась при овуляторных эстральных циклах (5).
Раннее и регулярное разведение в неволе имеет большое значение для самок носорогов GOH из-за высокой распространенности у них опухолей половых путей и последующего прекращения размножения к 18 годам в неволе (4). До настоящего времени при искусственном осеменении (ИИ) использовалась вспомогательная репродукция с использованием свежей и замороженно-размороженной спермы (5). Частота наступления беременности после ИИ до 50% достигалась при овуляторных эстральных циклах (5).
Эстральная синхронизация у самок без эструса для достижения овуляции и зачатия после естественного спаривания или искусственного осеменения — это инструмент вспомогательной репродукции, ранее описанный у черного и белого носорога (6–8). Для этого синтетический прогестин, алтреногест и ацетат хлормадинона в сочетании с ХГЧ или аналогом ГнРГ использовались для синхронизации эструса и запуска овуляции (8–10). Оральный прогестин останавливает фолликулогенез на время лечения. Удаление перорального прогестина вызывает рикошетный эффект на гипоталамо-гипофизарную ось, что инициирует рост новой фолликулярной волны и развитие овуляторного фолликула. У белого носорога, не имевшего половой охоты, пероральное лечение прогестином в сочетании с имплантатами дезлорелина, аналогом ГнРГ, приводило к повышению лютеиновой активности, что свидетельствует о частоте овуляции 93,3% (4). Следовательно, использование протоколов оральной эстральной синхронизации привело к многократным беременностям после естественного спаривания и вспомогательного размножения у белых и черных носорогов без эструса (8, 9, Hermes, неопубликованные данные). Кроме того, индукция овуляции с использованием аналогов ГнРГ также была описана у белых носорогов (11, 12).
У белого носорога, не имевшего половой охоты, пероральное лечение прогестином в сочетании с имплантатами дезлорелина, аналогом ГнРГ, приводило к повышению лютеиновой активности, что свидетельствует о частоте овуляции 93,3% (4). Следовательно, использование протоколов оральной эстральной синхронизации привело к многократным беременностям после естественного спаривания и вспомогательного размножения у белых и черных носорогов без эструса (8, 9, Hermes, неопубликованные данные). Кроме того, индукция овуляции с использованием аналогов ГнРГ также была описана у белых носорогов (11, 12).
У носорогов с ГОГ нерегулярные и ановуляторные эстральные циклы с последующим образованием геморрагических фолликулов представляют сложную проблему в программах разведения в неволе. Однако эстральная синхронизация еще не описана для носорога GOH. Кратко упоминается только индукция овуляции, используемая во время ИИ (2, 5). Здесь экзогенные аналоги ГнРГ использовались для индукции овуляции у двух самок с поведенческой, но иногда и ановуляторной эструсом. Эти предварительные данные показывают, что аналоги ГнРГ, цисторелин и дезлорелин, индуцировали пять овуляций в общей сложности за семь эстральных циклов (2, 5). Тем не менее, выводы об эффективности аналогов GnRH в индукции овуляции у носорогов с GOH ограничены, поскольку количество обработок разделено между различными препаратами аналога GnRH, а также потому, что обработанные самки с поведенческой течкой могли спонтанно овулировать даже без введения GnRH.
Эти предварительные данные показывают, что аналоги ГнРГ, цисторелин и дезлорелин, индуцировали пять овуляций в общей сложности за семь эстральных циклов (2, 5). Тем не менее, выводы об эффективности аналогов GnRH в индукции овуляции у носорогов с GOH ограничены, поскольку количество обработок разделено между различными препаратами аналога GnRH, а также потому, что обработанные самки с поведенческой течкой могли спонтанно овулировать даже без введения GnRH.
Несмотря на то, что активность гормонов и динамику яичников можно тщательно контролировать (1, 2), нет сообщений о синхронизации эстральной фазы, а данные об индукции овуляции у носорогов с ГОГ ограничены. Поэтому мы намеревались проверить гистрелин, аналог ХГЧ и ГнРГ, на их способность индуцировать овуляцию у носорогов с гонадотропной гипертензией без овуляции.
Методы и материалы
Исследование животных и гормональный мониторинг
Индукция овуляции проводилась у одной 12-летней самки носорога GOH, содержавшейся в неволе (номер в племенной книге: 367) в течение 4-летнего периода исследования.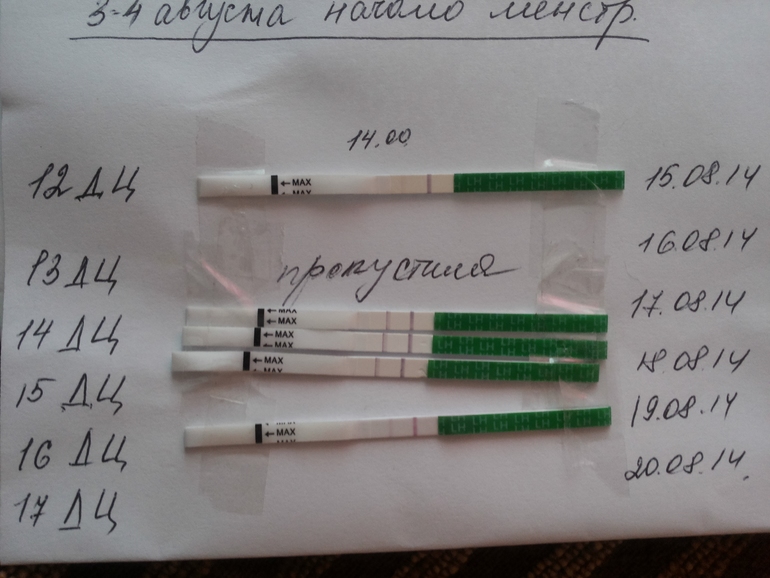 Исследуемое животное — рожденное в дикой природе сирота, переведенное из Непала в Венский зоопарк в возрасте 3 лет. Самка содержится с фертильным самцом в отдельных вольерах. Непрерывный гормональный анализ проводился с 4-летнего возраста этой самки. С 9 летлет регулярные пики предшественников эстрогенов указывали на развитие фолликулов, но не было зарегистрировано четких пиков прегнана, что позволяет предположить, что овуляция никогда не происходила.
Исследуемое животное — рожденное в дикой природе сирота, переведенное из Непала в Венский зоопарк в возрасте 3 лет. Самка содержится с фертильным самцом в отдельных вольерах. Непрерывный гормональный анализ проводился с 4-летнего возраста этой самки. С 9 летлет регулярные пики предшественников эстрогенов указывали на развитие фолликулов, но не было зарегистрировано четких пиков прегнана, что позволяет предположить, что овуляция никогда не происходила.
Образцы кала собирали два раза в неделю и анализировали с помощью иммуноферментного анализа на 20α-ОН-прегнаны и 17-оксо-андростаны (1). Как и эстрогены, их предшественники, фекальные 17-оксо-андростаны, являются индикаторами фолликулярной фазы. Поскольку концентрация 17-оксо-андростанов в фекалиях выше, чем у эстрогенов, эти предшественники эстрогенов обычно анализируются для репродуктивного мониторинга носорогов GOH в рамках Европейской программы разведения. Для мониторинга гормональной активности до и после индукции овуляции образцы анализировали с интервалом в 2 дня.
Трансректальное ультразвуковое исследование и лечение
Женщина обучена переносить трансректальное ультразвуковое исследование (GE LOGIQ e Vet, GE Medical Systems, Wuxi 214028, Китай). Трансректальное УЗИ контролировало динамику яичников и развитие преовуляторных фолликулов. Еженедельные осмотры постепенно увеличивали до ежедневных УЗИ по мере появления доминантного фолликула и его роста >8 см. Тем не менее, без лечения преовуляторные фолликулы становились атретичными или геморрагическими, как описано ранее Stoops et al. (2). Лечение для индукции овуляции начинали, когда животному было 12 лет, в возрасте, когда уже давно должен был установиться регулярный эстральный цикл. При наличии преовуляторного фолликула (≥11 см) в течение 48 ч 10 000 МЕ чХГ (Хорлулон 5000 МЕ, MSD Tiergesundheit, A-1220 Вена, Австрия) или 1,5 мг гистрельина (гистрелина ацетат биорелиз, 0,5 мг/мл, Bet Pharm, Lexington, KY 40511, USA) вводили внутримышечно под ухо. В первой серии лечения ХГЧ вводили четыре раза.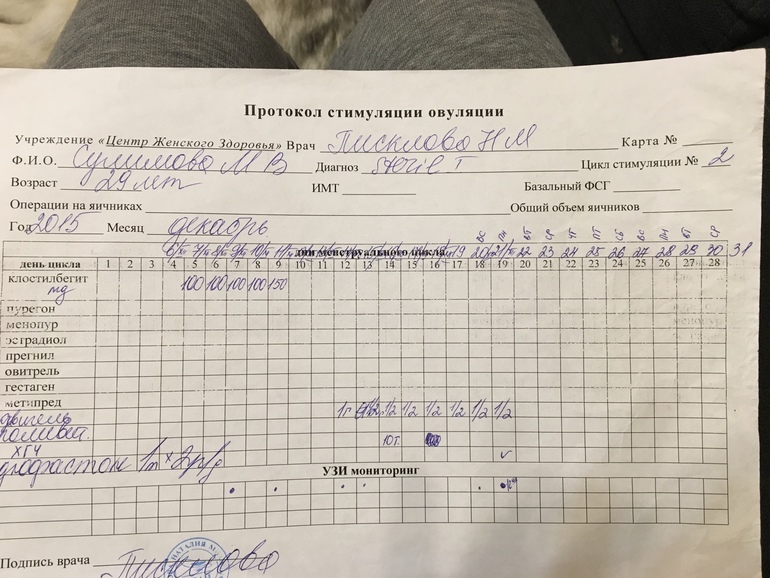 За этим последовал один раз ГнРГ, два раза ХГЧ, два раза ГнРГ и, наконец, еще два раза ХГЧ. Интервал между обработками колебался от 43 до 364 дней. Нерегулярные интервалы между обработками были обусловлены: (1) сезонными ограничениями для размножения самок после индукции овуляции в течение зимнего сезона; (2) наличие персистирующих геморрагических фолликулов до начала новых фолликулярных волн; и (3) периоды бездействия фолликулов, в течение которых преовуляторные фолликулы не развиваются. Длительные интервалы между курсами лечения >43 дней гарантировали, что возможные лекарственные взаимодействия не могут возникнуть при использовании разных гормонов.
За этим последовал один раз ГнРГ, два раза ХГЧ, два раза ГнРГ и, наконец, еще два раза ХГЧ. Интервал между обработками колебался от 43 до 364 дней. Нерегулярные интервалы между обработками были обусловлены: (1) сезонными ограничениями для размножения самок после индукции овуляции в течение зимнего сезона; (2) наличие персистирующих геморрагических фолликулов до начала новых фолликулярных волн; и (3) периоды бездействия фолликулов, в течение которых преовуляторные фолликулы не развиваются. Длительные интервалы между курсами лечения >43 дней гарантировали, что возможные лекарственные взаимодействия не могут возникнуть при использовании разных гормонов.
Успех индукции овуляции определялся разрывом граафова фолликула и образованием желтого тела >48 ч после инъекции ХГЧ/ГнРГ и подтверждался эндокринным мониторингом.
Статистика
Для статистического анализа день 0 соответствует дню введения ХГЧ. Результаты гормонов суммировали с 3-дневными интервалами, начиная с -9 дней до и до +30 дней после индукции овуляции. Эндокринные результаты лечения были сгруппированы в те, где прегнан повышался на 6-й день >100 нг/г фекалий и желтое тело было диагностировано с помощью ультразвука, по сравнению с теми, где прегнан на 6-й день оставался <100 нг/г фекалий и желтое тело не обнаруживалось. обнаружено. Результаты гормонов сравнивали с использованием теста Манна-Уитни и считали, что они значительно различаются, когда Р < 0,05.
Эндокринные результаты лечения были сгруппированы в те, где прегнан повышался на 6-й день >100 нг/г фекалий и желтое тело было диагностировано с помощью ультразвука, по сравнению с теми, где прегнан на 6-й день оставался <100 нг/г фекалий и желтое тело не обнаруживалось. обнаружено. Результаты гормонов сравнивали с использованием теста Манна-Уитни и считали, что они значительно различаются, когда Р < 0,05.
Результаты
Развитие преовуляторного фолликула у ановуляторной самки заняло 26,9 ± 4,4 дня ( n = 9). Преовуляторный фолликул со средним диаметром 11,9 ± 0,2 см был визуализирован в течение восьми молчаливых эструсов (рис. 1). Когда преовуляторный фолликул находился в яичнике в течение 48 часов, овуляцию индуцировали внутримышечно. инъекции ХГЧ или ГнРГ под ухо.
Рисунок 1 . Слева: преовуляторный фолликул размером ~11 см у большого однорогого носорога. Справа: Разорвавшийся фолликул с заполненным кровью центром вскоре после индукции овуляции через 48 часов.
Успешной индукции овуляции ( n = 7/11) предшествовало значительное преовуляторное повышение концентрации эстрогенов в кале до >75 нг/г фекалий. Наличие желтого тела размером 11,3 ± 0,9 см (рис. 1) в сочетании со значительным постовуляторным повышением концентрации 20α-ОН-прегнанов >750 нг/г фекалий подтвердило овуляцию и определило успех лечения ( P < 0,005; Таблица 1, Рисунок 2). Четыре индукции овуляции (2 hcG/2 GnRH) не индуцировали овуляцию, несмотря на наличие преовуляторного фолликула. Неудачные индукции характеризовались значительно более низкими преовуляторными концентрациями эстрогенов <20 нг/г фекалий, отсутствием образования желтого тела и значительно более низкими концентрациями прегнана начиная с 6-го дня (таблица 1; 9).0142 P
< 0,005). Таблица 1 . Двусторонние P — значения сравнения между высокими и низкими концентрациями эстрогена и прегнана во время индукции овуляции ( n = 11) у одного носорога GOH.
Рисунок 2 . Концентрация фекального эстрогена 90 180 (A, B) 90 181 и прегнана 90 180 (C, D) 90 181 у носорогов с гонадотропной эстрацией. День 0 отмечает день инъекции ХГЧ/ГнРГ. (A,C) : Когда овуляция не индуцировалась, средний уровень эстрогена и прегнана оставался низким до и после лечения (
ХГЧ, введенный в присутствии преовуляторного фолликула, вызвал шесть овуляций, что привело к частоте овуляции 75% ( n = 6/8). Инъекционный аналог ГнРГ вызвал овуляцию только один раз ( n = 1/3). Несмотря на повышение уровня эстрогена, образование желтого тела и повышение лютеиновой активности как индикаторов индуцированной овуляции, поведенческого эструса не наблюдалось ни до, ни после лечения ХГЧ/ГнРГ.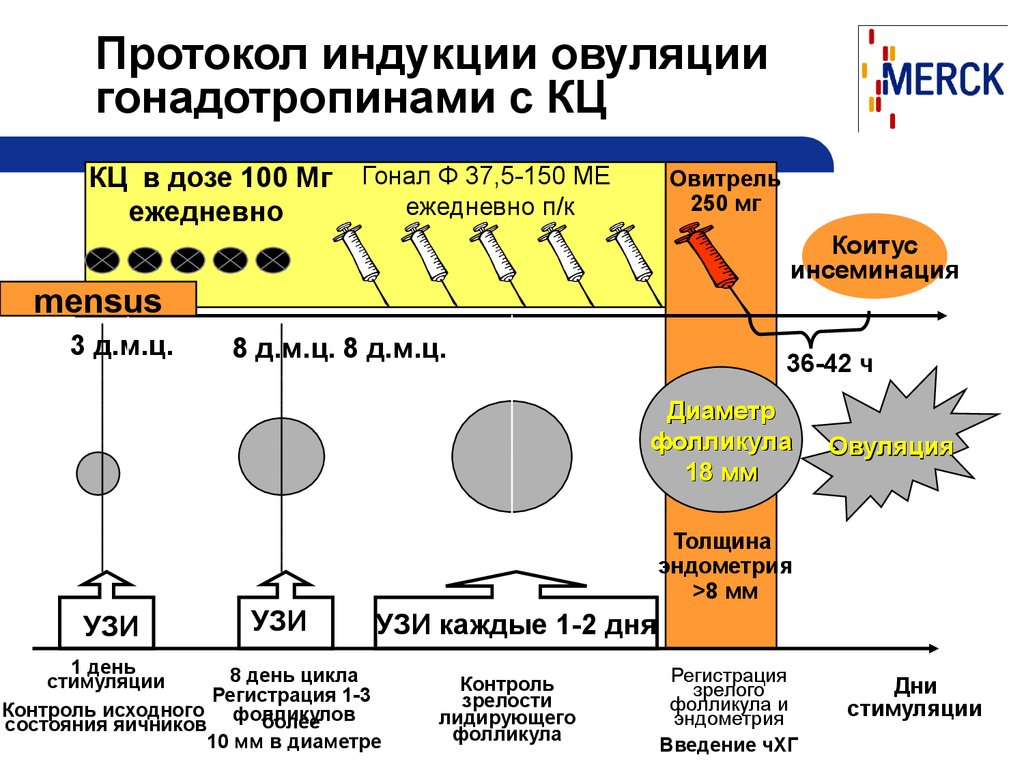
Обсуждение
Анэструсные и неовуляторные носороги представляют собой проблему для программ разведения в неволе (1, 2, 5, 12–14). Высокая генетическая ценность самки, у которой после естественного спаривания или вспомогательной репродукции диагностирована недостаточность овуляции, требует средств надежной индукции овуляции. Здесь мы показали, что инъекционный ХГЧ или ГнРГ, вводимый в присутствии преовуляторного фолликула, индуцировал овуляцию у одного носорога с ГГГ без овуляции. В обоих случаях индукция овуляции была успешной в 63,6% случаев.
До сих пор ГнРГ случайно применяли для индукции овуляции у двух носорогов с ГОГ (2, 5). Считалось, что GnRH помогает определить время овуляции для ИИ у женщин с поведенческими иногда ановуляторными эструсами (5). Смешанные результаты с использованием различных аналогов GnRH позволяют предположить, что GnRH может быть ненадежным для индукции овуляции у носорогов с гонадотропной гипертензией без овуляции (2, 5). В этом исследовании ХГЧ неоднократно индуцировал овуляцию у женщин с персистирующей ановуляторной ГОГ с молчаливой поведенческой течкой.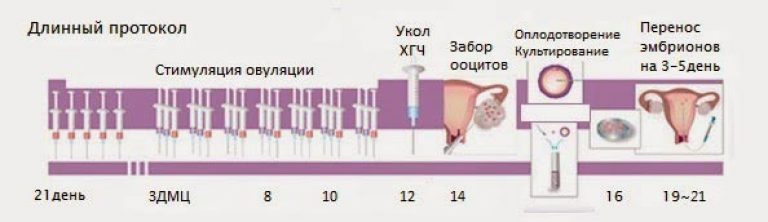 При наличии преовуляторного фолликула введение 10 000 МЕ ХГЧ вызывало овуляцию в 75% случаев. Несмотря на повторное введение ХГЧ у одного и того же животного, частота овуляции у носорога с ГОГ была аналогична частоте овуляции 78–87% у кобыл после однократной инъекции ХГЧ (15). Таким образом, даже при однократном введении ХГЧ кобылы не демонстрировали намного более высокой скорости овуляции по сравнению с самками носорогов, получавших повторно ГОГ в этом исследовании. Инъекционный аналог ГнРГ гистрелин индуцировал овуляцию только один раз. Наши данные подтверждают более широкое использование ХГЧ для индукции овуляции при наличии преовуляторного фолликула у носорогов с ГОГ. Суммарное количество ранее зарегистрированных индукций ГнРГ (2, 5) и проведенных в этом исследовании (всего n = 10) указывают на то, что аналоги GnRH одинаково подходят для индукции овуляции у носорогов с неовуляторной GOH, чем hCG.
При наличии преовуляторного фолликула введение 10 000 МЕ ХГЧ вызывало овуляцию в 75% случаев. Несмотря на повторное введение ХГЧ у одного и того же животного, частота овуляции у носорога с ГОГ была аналогична частоте овуляции 78–87% у кобыл после однократной инъекции ХГЧ (15). Таким образом, даже при однократном введении ХГЧ кобылы не демонстрировали намного более высокой скорости овуляции по сравнению с самками носорогов, получавших повторно ГОГ в этом исследовании. Инъекционный аналог ГнРГ гистрелин индуцировал овуляцию только один раз. Наши данные подтверждают более широкое использование ХГЧ для индукции овуляции при наличии преовуляторного фолликула у носорогов с ГОГ. Суммарное количество ранее зарегистрированных индукций ГнРГ (2, 5) и проведенных в этом исследовании (всего n = 10) указывают на то, что аналоги GnRH одинаково подходят для индукции овуляции у носорогов с неовуляторной GOH, чем hCG.
Результаты использования ХГЧ для индукции овуляции у носорогов с ГОГ согласуются с результатами, полученными у белых носорогов, у которых 67% эстральных синхронизаций с использованием ХГЧ приводили к овуляции (10). У белых носорогов аналог ГнРГ дезлорелин индуцировал овуляцию лучше, чем ХГЧ (10). Тем не менее, применение имплантатов дезлорелина с медленным высвобождением является более сложной задачей, чем в/м. инъекциями, поэтому в этом исследовании не предпринималось попыток (10).
У белых носорогов аналог ГнРГ дезлорелин индуцировал овуляцию лучше, чем ХГЧ (10). Тем не менее, применение имплантатов дезлорелина с медленным высвобождением является более сложной задачей, чем в/м. инъекциями, поэтому в этом исследовании не предпринималось попыток (10).
С одной стороны, индуцированная гормонами овуляция технически сложна для многих учреждений и не является исчерпывающим методом управления воспроизводством содержащихся в неволе носорогов GOH. Это, вероятно, ограничено объектами с продвинутой программой дрессировки животных и там, где присутствует критически важное оборудование, такое как ультразвуковой аппарат и парашют. С другой стороны, у самок в пожилом возрасте, с «неустойчивыми» ановуляторными эстральными циклами и неудачным зачатием, но все же важной генетикой для популяции в неволе, использование ХГЧ/ГнРГ во время поведенческой эстральной фазы может представлять собой новый практический инструмент управления репродуктивной функцией. .
В заключение, наши данные показывают, что в присутствии преовуляторного фолликула ХГЧ индуцирует овуляцию у носорога с овуляторной ГОГ в 75% случаев лечения. Таким образом, инъекционный ХГЧ представляет собой простое в применении и практичное средство для индукции овуляции у носорогов с ГОГ с поведенческой, но иногда и ановуляторной эструсом. Поскольку носороги с ГОГ без овуляции представляют собой проблему для программ разведения в неволе, частое использование индукторов овуляции, таких как ХГЧ или ГнРГ, может помочь добиться поздних беременностей у генетически важных носорогов с ГОГ без овуляции.
Таким образом, инъекционный ХГЧ представляет собой простое в применении и практичное средство для индукции овуляции у носорогов с ГОГ с поведенческой, но иногда и ановуляторной эструсом. Поскольку носороги с ГОГ без овуляции представляют собой проблему для программ разведения в неволе, частое использование индукторов овуляции, таких как ХГЧ или ГнРГ, может помочь добиться поздних беременностей у генетически важных носорогов с ГОГ без овуляции.
Заявление о доступности данных
Первоначальные материалы, представленные в исследовании, включены в статью/дополнительный материал. Дальнейшие запросы можно направлять соответствующему автору/авторам.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Комитетом по этике Института исследований зоопарков и дикой природы им. Лейбница. От владельцев получено письменное информированное согласие на участие их животных в данном исследовании.
Вклад авторов
RH: дизайн исследования, анализ данных, написание и редактирование рукописи. FB: дизайн исследования, сбор данных, анализ данных и редактирование рукописи. SH: Сбор данных. ЭД: сбор данных. TH: контроль и редактирование рукописи. FS: дизайн исследования, сбор данных, анализ данных, написание и редактирование рукописей. Все авторы внесли свой вклад в статью и одобрили представленную версию.
FB: дизайн исследования, сбор данных, анализ данных и редактирование рукописи. SH: Сбор данных. ЭД: сбор данных. TH: контроль и редактирование рукописи. FS: дизайн исследования, сбор данных, анализ данных, написание и редактирование рукописей. Все авторы внесли свой вклад в статью и одобрили представленную версию.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Schwarzenberger F, Rietschel W, Vahala J, Holeckova D, Thomas P, Maltzan J, et al. Фекальный прогестерон, эстроген и метаболиты андрогенов для неинвазивного мониторинга репродуктивной функции у самок индийского носорога, Rhinoceros unicornis . Gen Comp Endocrinol . (2000) 119:300–7. doi: 10.1006/gcen.2000.7523
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
2. Ступс М.А., Пайран Р. Д., Рот Т.Л. Фолликулярная, эндокринная и поведенческая динамика индийского носорога ( Rhinoceros unicornis ) эстральный цикл. Репродукция . (2004) 128:843–56. doi: 10.1530/rep.1.00328
Д., Рот Т.Л. Фолликулярная, эндокринная и поведенческая динамика индийского носорога ( Rhinoceros unicornis ) эстральный цикл. Репродукция . (2004) 128:843–56. doi: 10.1530/rep.1.00328
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
3. Schaftenaar W, Fernandes T, Fritsch G, Frey R, Szentiks CA, Wegner RD, et al. Дистоция и фетотомия, связанные с церебральной аплазией у большого однорогого носорога ( Rhinoceros unicornis ). Репрод Дом Аним. (2011) 46:e97–10. doi: 10.1111/j.1439-0531.2010.01610.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
4. Hermes R, Göritz F, Saragusty J, Stoops MA, Hildebrandt TB. Опухоли половых путей: бич женской репродукции Болезни индийских носорогов. ПЛОС ОДИН. (2014) 9:e92595. doi: 10.1371/journal.pone.0092595
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
5. Stoops M, Campell MK, DeChant CJ, Hauser J, Kottwitz J, Pairan RD, et al. Улучшение генетики содержащихся в неволе индийских носорогов с помощью искусственного оплодотворения криоконсервированной спермы. Анимация Репродукция Наука . (2016) 172: 60–75. doi: 10.1016/j.anireprosci.2016.07.003
Улучшение генетики содержащихся в неволе индийских носорогов с помощью искусственного оплодотворения криоконсервированной спермы. Анимация Репродукция Наука . (2016) 172: 60–75. doi: 10.1016/j.anireprosci.2016.07.003
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
6. Walzer C, Schwarzenberger F. Эстральная индукция у белого носорога ( Ceratotherium simum simum ) и сопутствующий анализ фекального прогестагена с помощью EIA. В: Proceedings American Association of Zoo Veterinarians . Ист-Лансинг, Мичиган (1995). п. 322–4.
7. Schwarzenberger F, Walzer C, Tomasova K, Vahala J, Meister J, Goodrowe KL, et al. Анализ фекальных метаболитов прогестерона для неинвазивного мониторинга репродуктивной функции у белых носорогов (Ceratotherium simum). Anim Reprod Sci. (1998) 53:173–90. doi: 10.1016/S0378-4320(98)00112-2
Полный текст CrossRef | Google Scholar
8. Schwarz C, Grothmann P, Gottschalk J, Eulenberger K, Einspanier A. Zuchtmanagement bei Spitzmaulnashörnern (Diceros bicornis michaeli) в зоопарке Магдебурга. Tieraerztl Praxis. (2014) 42:150–5. doi: 10.1055/s-0038-1623220
Zuchtmanagement bei Spitzmaulnashörnern (Diceros bicornis michaeli) в зоопарке Магдебурга. Tieraerztl Praxis. (2014) 42:150–5. doi: 10.1055/s-0038-1623220
CrossRef Полный текст | Google Scholar
9. Hildebrandt TB, Hermes R, Walzer C, Sós E, Molnar V, Mezösi L, et al. Искусственное осеменение белых носорогов после родов и после эструса с использованием аналога ГнРГ для индукции овуляции. Терио. (2007) 67:1473–84. doi: 10.1016/j.theriogenology.2007.03.005
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
10. Hermes R, Hildebrandt TB, Walzer C, Göritz F, Gray G, Niemuller C, et al. Индукция эструса у белого носорога (Ceratotherium simum). Терио. (2012) 78:1217–23. doi: 10.1016/j.theriogenology.2012.05.015
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
11. Hermes R, Goeritz F, Saragusty J, Sos E, Molnar V, Reid CE, et al. Первое успешное искусственное осеменение замороженной-оттаявшей спермой носорога. Терио. (2009) 71:393–9. doi: 10.1016/j.theriogenology.2008.10.008
Терио. (2009) 71:393–9. doi: 10.1016/j.theriogenology.2008.10.008
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
12. Пеннингтон П.М., Маршалл К.Л., Капиро Дж.М., Фелтон Р.Г., Даррант Б.С. Индукция овуляции у ановуляторных южных белых носорогов (Ceratotherium simum simum) без альтреногеста. Физиол консервации. (2019) 7:coz033. doi: 10.1093/conphys/coz033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
13. Эдвардс К.Л., Шульц С., Пилигрим М., Уокер С.Л. Нерегулярная активность яичников, состояние тела и различия в поведении связаны с репродуктивным успехом самок восточного черного носорога (Diceros bicornis michaeli). Gen Comp Эндокринол. (2015) 214:186–94. doi: 10.1016/j.ygcen.2014.07.026
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
14. Patton ML, Swaisgood RR, Czekala NM, White AM, Fetter GA, Montagne JP, et al. Продолжительность репродуктивного цикла и беременность у южных белых носорогов (Ceratotherium simum simum), определяемые анализом прегнана фекалий и наблюдениями за поведением при спаривании.
