Содержание
Особенности сократительной деятельности матки при спонтанных родах у первородящих
- Особенности сократительной деятельности матки при спонтанных родах у первородящих
ru К содержанию
HEALTH OF WOMAN.2015.3(99):35–37; doi 10.15574/HW.2015.99.35
Особенности сократительной деятельности матки при спонтанных родах у первородящих
Агакишиева Л. Г., Алиева Э. М., Аббасова Н. В.
I Азербайджанский Медицинский Университет, г. Баку
Целью исследования является определение особенностей сократительной активности матки у первородящих в родах в условиях г. Баку.
Изучена сократительная активность матки у 46 первородящих методом наружной интранатальной кардиотокографии.
Установлено, что спонтанные роды без аномалии родовой деятельности у первородящих сопровождаются в латентную фазу наличием дискоординированных сокращений, низкой интенсивностью схватки, более длительным интервалом между схватками.
В динамике родового процесса определяется достоверное увеличение схваток, длительности сокращения матки, частоты схваток в течение 10 мин, маточной активности и уменьшением интервала между схватками.
Ключевые слова: сократительная активность матки, интенсивность схватки, сокращение матки, расслабление матки, маточная активность, единица Монтевидео, Александрийская единица.
Литература:
1. Алиева ЭМ. 1997. Патология родовой деятельности у первобеременных (патогенез, клиника, диагностика, терапия, профилактика). Дис. д. мед. наук. М:283.
2. Виноградова ОА. 2011. Особенности сократительной активности матки в родах в условиях применения регионарной анестезии. Автореф. дисс. канд. мед. наук. Санкт-Петербург: 24.
3. Габаева ММ. 2012. Особенности функционального состояния плодов и сократительной активности матки при различной степени биологической готовности к родам. Автореф. дис. канд. мед. наук. Санкт-Петербург: 23.
4. Мальгина ГБ, Жукова ИФ, Андреева МЕ. 2009. Оценка сократительной деятельности матки методом многоканальной наружной гистерографии (НГГ) в процессе проведения партнерских родов. Вестник Уральской медицинской академической науки 4:20–24.
Мальгина ГБ, Жукова ИФ, Андреева МЕ. 2009. Оценка сократительной деятельности матки методом многоканальной наружной гистерографии (НГГ) в процессе проведения партнерских родов. Вестник Уральской медицинской академической науки 4:20–24.
5. Basu J, Buchmann E, Basu D. 2009. Role of a second stage partoqram in predicting the outcome of normal labour. Aust. N.Z.J. Obstet Gynaecol. 49;2:158–161. http://dx.doi.org/10.1111/j.1479-828X.2009.00987.x; PMid:19432603
6. Garfield RE, Mane WL. 2007. Physiology and electrical activity of uterine contractions. Semin.Cell.Dev. Biol. 3:289–295. http://dx.doi.org/10.1016/j.semcdb.2007.05.004; PMid:17659954 PMCid:PMC2048588
7. Maul H, MAner WL, Saade GR, Garfield RE. 2003. The physiology of uterine contractions. Clin Perinatol. 30:665–676. http://dx.doi.org/10.1016/S0095-5108(03)00105-2
Новый выпуск
Физиология, схватки при беременности — StatPearls
NCBI Книжная полка. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2023 янв.
StatPearls [Интернет].
Показать подробности
Критерий поиска
Остин МакЭвой; Сара Сабир.
Информация об авторе и организациях
Последнее обновление: 19 сентября 2022 г.
Введение
Матка представляет собой полый орган, обеспечивающий защитную и питательную поддержку яйцеклетки с момента ее оплодотворения до тех пор, пока она не превратится в хорошо развитый плод, готовый к родам. Его средний мышечный слой называется миометрием, который известен своими ритмичными сокращениями, которые приводят к «волнам эндометрия» в небеременной матке, сокращениям Брэкстона-Хикса во время беременности и настоящим родам к концу третьего триместра. Родовые схватки болезненные, регулярные, сопровождаются изменением раскрытия и/или сглаживания шейки матки.
Вопросы, вызывающие озабоченность
Поскольку маточные сокращения всегда присутствуют в процветающей матке, они различаются по частоте, амплитуде, продолжительности и направлению распространения. Несмотря на недавние достижения в знаниях о маточных сокращениях, все еще остается огромный пробел в понимании связанной с ними физиологии на клеточном и молекулярном уровнях. Знание процесса сокращения матки, который в конечном итоге приводит к изгнанию ребенка, поможет клиницистам выявить аномалии, которые могут привести к акушерским осложнениям, таким как преждевременные роды и остановка родов. Это также поможет фармацевтам в разработке и улучшении препаратов, используемых для стимуляции родовой деятельности, индукции и токолиза. Сокращения матки также играют важную роль в минимизации послеродового кровотечения, что объясняет, почему многие препараты, используемые для лечения этого осложнения, воздействуют на пути, участвующие в сократительной способности миометрия.
Сотовый уровень
Миоциты матки представляют собой гладкомышечные клетки, сильно упакованные миофиламентами, плотными телами и плотными тяжами. В этих клетках больше актина, чем миозина, в 6 раз. Плотные тельца прикрепляют актиновые филаменты друг к другу, гарантируя, что сокращение приводит к силе вдоль продольного направления миоцита. Актиновые филаменты сократительного аппарата прикреплены к цитоскелету с помощью плотных тяжей. Это приводит к передаче сил от сократительных единиц к плазматической мембране, что приводит к укорочению миоцита.
В этих клетках больше актина, чем миозина, в 6 раз. Плотные тельца прикрепляют актиновые филаменты друг к другу, гарантируя, что сокращение приводит к силе вдоль продольного направления миоцита. Актиновые филаменты сократительного аппарата прикреплены к цитоскелету с помощью плотных тяжей. Это приводит к передаче сил от сократительных единиц к плазматической мембране, что приводит к укорочению миоцита.
Миозин, присутствующий в этих клетках, классифицируется как MII. Это гексамерная молекула, состоящая из двух тяжелых цепей миозина (MHC) и двух пар легких цепей миозина (MLC). Он образует три основных домена. Область «головы» состоит из глобулярного N-конца MHC, который выступает латерально от филамента. Он имеет актин-связывающую область, а также сайт гидролиза АТФ, который дает энергию, необходимую для сокращения. Это преобразуется в большее движение из-за области жесткой шеи на С-концевом конце двигательной области [1]. Домен «шея» также является местом, где легкие цепи миозина связываются нековалентно. Домен «хвост» состоит из С-концевых концов тяжелых цепей миозина, которые переплетаются в α-спиральный стержень и образуют основные составляющие толстых филаментов миоцитов.
Домен «хвост» состоит из С-концевых концов тяжелых цепей миозина, которые переплетаются в α-спиральный стержень и образуют основные составляющие толстых филаментов миоцитов.
Промежуточные филаменты, присутствующие в миоцитах, не только придают форму клетке, но также помогают в передаче сигналов и пространственно-временной организации клетки, усиливая напряжение, создаваемое сократительным действием.
Клетки взаимодействуют друг с другом через соединения, называемые щелевыми соединениями, которые увеличиваются к концу беременности, чтобы способствовать синхронным сокращениям. Количество актина и миозина, присутствующих в миоцитах, увеличивается во время беременности по мере гипертрофии матки. Отложения фосфокреатина, гликогена и жирных кислот увеличиваются, чтобы обеспечить энергию для сокращений. Приток крови к матке во время беременности увеличивается синхронно с растущей потребностью в перфузии, но позже к концу беременности отстает.
Развитие
Миометрий состоит из двух слоев. Кольцевой слой тоньше и присутствует на самой внутренней стороне мышечных волокон и происходит от парамезонефральных/мюллеровых протоков. Это называется субэндометриальным или соединительным эндометрием. Наружный продольный слой состоит из переплетенных мышечных пучков, встроенных во внеклеточный матрикс из коллагеновых волокон, который сильно васкуляризирован. Это помогает создать интенсивное давление, необходимое для сокращений. Продольный слой происходит из немюллеровой ткани. Оба слоя работают вместе, чтобы вытолкнуть плод из полости матки. В некоторых исследованиях было высказано предположение, что клетки миометрия обладают способностями «водителей ритма», например, присутствующими в кишечнике и уретре, которые способствуют синхронным сокращениям матки, хотя доказательства этого противоречивы.
Кольцевой слой тоньше и присутствует на самой внутренней стороне мышечных волокон и происходит от парамезонефральных/мюллеровых протоков. Это называется субэндометриальным или соединительным эндометрием. Наружный продольный слой состоит из переплетенных мышечных пучков, встроенных во внеклеточный матрикс из коллагеновых волокон, который сильно васкуляризирован. Это помогает создать интенсивное давление, необходимое для сокращений. Продольный слой происходит из немюллеровой ткани. Оба слоя работают вместе, чтобы вытолкнуть плод из полости матки. В некоторых исследованиях было высказано предположение, что клетки миометрия обладают способностями «водителей ритма», например, присутствующими в кишечнике и уретре, которые способствуют синхронным сокращениям матки, хотя доказательства этого противоречивы.
Функция
Основной функцией сокращений матки является изгнание плода из полости матки. Однако схватки также играют важную роль в минимизации послеродового кровотечения. Знание нормальной физиологии маточных сокращений также позволяет клиницистам лучше различать истинное начало родов и продромальные роды, также известные как схватки Брэкстона-Хикса. Схватки Брэкстона-Хикса возникают спорадически и не увеличиваются в силе. Они нерегулярны по продолжительности, частоте и интенсивности, непредсказуемы и неритмичны и скорее неприятны, чем болезненны. Истинные роды состоят из схваток через равные промежутки времени. По мере прогрессирования родов эти сокращения становятся сильнее, а время между каждым сокращением уменьшается. Первый период родов делится на две фазы, которые определяются степенью раскрытия шейки матки. Латентная фаза наступает при раскрытии от 0 до 6 см, тогда как активная фаза начинается с 6 см до полного раскрытия шейки матки в 10 см. Второй период родов начинается с раскрытия шейки матки на 10 см и заканчивается рождением ребенка. Третий период родов начинается с рождения плода и заканчивается рождением плаценты.
Схватки Брэкстона-Хикса возникают спорадически и не увеличиваются в силе. Они нерегулярны по продолжительности, частоте и интенсивности, непредсказуемы и неритмичны и скорее неприятны, чем болезненны. Истинные роды состоят из схваток через равные промежутки времени. По мере прогрессирования родов эти сокращения становятся сильнее, а время между каждым сокращением уменьшается. Первый период родов делится на две фазы, которые определяются степенью раскрытия шейки матки. Латентная фаза наступает при раскрытии от 0 до 6 см, тогда как активная фаза начинается с 6 см до полного раскрытия шейки матки в 10 см. Второй период родов начинается с раскрытия шейки матки на 10 см и заканчивается рождением ребенка. Третий период родов начинается с рождения плода и заканчивается рождением плаценты.
Механизм
Электрофизиология сокращений
Мембранный потенциал покоя обусловлен электрохимическим градиентом, в основном создаваемым ионами калия, сконцентрированными внутри клетки, и, в меньшей степени, ионами кальция, натрия и хлорида, сконцентрированными внеклеточно.
В миоцитах матки наблюдались два типа потенциалов действия: один включает деполяризацию с последующей быстрой реполяризацией, а другой — начальную деполяризацию с устойчивым плато. Это высвобождение ионов кальция из внутриклеточных запасов, а также приток ионов кальция из внеклеточного пространства, которые инициируют потенциалы действия. Когда мембранный потенциал деполяризуется примерно до -40 мВ, кальциевые каналы L-типа, управляемые напряжением, открываются, вызывая приток ионов кальция. Са-каналы Т-типа также обнаружены в миоцитах матки и играют роль в распространении потенциалов действия. [3]
Взаимодействие маточных агонистов с GPCR, расположенным на плазматической мембране миоцита, приводит к цепочке событий, в конечном итоге вызывающих IP-IPR-опосредованное высвобождение Ca из саркоплазматического ретикулума. Это дополнительно повышало концентрацию кальция в цитозоле, а также напряжение плазматической мембраны. Другим процессом, вызывающим распространение потенциала действия, является механизм положительной обратной связи кальция, известный как кальций-индуцированное высвобождение кальция (CICR), при котором увеличение внутриклеточной концентрации кальция стимулирует открытие других кальциевых каналов.
После притока ионов кальция и их последующего связывания с кальмодулином конформационное изменение киназы легкой цепи миозина приводит к усилению фосфорилирования легкой цепи миозина по сериновому остатку 19, что вызывает присоединение миозинового поперечного мостика к актиновой нити и вызвать сокращение.
Релаксация миоцита обусловлена выходом ионов кальция из цитозоля в СР и межклеточное пространство. Са-АТФаза плазматической мембраны (PMCA) и Са-АТФаза SR/ER (SERCA) относятся к семейству Са-АТФаз Р-типа и отвечают за перемещение одного иона Са из внутриклеточного компартмента в обмен на Н+, восстанавливают покоящиеся мембранный потенциал. Другой механизм включает обменник Na/Ca (NCX) благодаря электрохимическому градиенту Na, создаваемому Na/K АТФазой. Интересно, что кальций сам по себе вызывает клиренс ионов кальция: ионы кальция ингибируют кальциевые каналы L-типа, а комплекс кальций-кальмодулин также стимулирует CaM-киназу II (CaMKII), которая ингибирует кальциевые каналы L-типа.
Другой механизм включает обменник Na/Ca (NCX) благодаря электрохимическому градиенту Na, создаваемому Na/K АТФазой. Интересно, что кальций сам по себе вызывает клиренс ионов кальция: ионы кальция ингибируют кальциевые каналы L-типа, а комплекс кальций-кальмодулин также стимулирует CaM-киназу II (CaMKII), которая ингибирует кальциевые каналы L-типа.
Сенсибилизация и десенсибилизация кальцием
Повышенная чувствительность регуляторных и сократительных белков к кальцию, которая в конечном итоге приводит к более сильному сокращению после стимуляции агонистом, известна как кальциевая сенсибилизация. Обратное верно для десенсибилизации кальция. Это устанавливается посредством сигнального пути RhoA/Rho-киназы. Активация рецепторов, связанных с G-белком (GPCR), вызывает привлечение RhoA к плазматической мембране после замены GDP на GTP. Это активирует Rho-ассоциированную киназу (ROK), которая фосфорилирует субъединицу, нацеленную на миозин (MYPT1) фосфатазы легкой цепи миозина, предотвращая дефосфорилирование легкой цепи миозина.
Рецепторы окситоцина: агонисты сократимости
Рецепторы эстрогена: агонисты сократимости
Рецепторы прогестерона: антагонисты сократимости 070
Бета2 адренорецепторы вызывают повышение уровня цАМФ, следовательно, антагонист сократимости
Альфа- адренергические рецепторы вызывают снижение уровня цАМФ, следовательно, агонисты сократительной способности
Эти рецепторы являются мишенями для многих препаратов, используемых при лечении аномальных родов, как мы увидим позже.
Точная последовательность событий, которая приводит к маточным сокращениям, до сих пор в значительной степени неизвестна. Некоторые исследования предполагают, что механическое растяжение и гормоны работают вместе, чтобы инициировать схватки при нормальных родах.[2] Однако из-за роли воспаления в преждевременных родах другие исследования предполагают, что медиаторы воспаления, такие как цитокины и простагландины, инициируют сокращения матки.[4]
Механическая растяжка
Механическое растяжение относится к натяжению клеток миометрия при растяжении матки. Физическое растяжение матки приводит к притоку ионов, а именно натрия и кальция, что изменяет потенциал действия в клетках миометрия.[5][6] Это изменение облегчает начало сокращений матки. Количество коннексинов (щелевых соединений) между клетками миометрия увеличивается непосредственно перед родами, что обеспечивает скоординированное сокращение мышц. Эти межклеточные контакты менее распространены на ранних сроках беременности, что способствует спокойствию матки. [7] Также высказывалось предположение, что перерастяжение матки вызывает «воспалительный пульс», который дополнительно активирует сократительную способность миометрия.[8]
[7] Также высказывалось предположение, что перерастяжение матки вызывает «воспалительный пульс», который дополнительно активирует сократительную способность миометрия.[8]
Медиаторы воспаления
Многие исследования показывают, что воспаление является медиатором родов.[8][9] Маркеры воспаления, в первую очередь, включают простагландины, концентрация которых увеличивается перед началом родов из-за функциональной отмены прогестерона, что приводит к увеличению отношения эстрогена к прогестерону.[10] Амнион и хорион продуцируют PGE2, а децидуальная оболочка продуцирует как PGE2, так и PGF2.
Два наиболее изученных простагландина, участвующих в сокращениях матки, включают простагландин E1 (PGE1) и простагландин E2 (PGE2). Они стимулируют сократимость миометрия, скорее всего, действуя как ионофоры кальция, что приводит к увеличению внутриклеточного кальция. Мизопростол представляет собой синтетическую версию ПГЕ1, который, хотя изначально был разработан для предотвращения пептических язв, оказывает дозозависимое действие на сократительную способность миометрия [10].
PGE2 также играет роль в сокращении матки, активируя рецепторы EP1 и EP3 на клетках миометрия.[11] Однако основным физиологическим эффектом PGE2 во время родов является активация медиаторов воспаления IL-8 и TNF-альфа, которые активируют коллагеназы и MMP, что приводит к созреванию шейки матки.
Простагландин F2 альфа (PGF2a) менее изучен, но считается, что он снижает уровень прогестерона и независимо увеличивает сократительную способность матки за счет стимуляции гладкомышечных клеток.[12]
Простагландины также играют роль в сокращении матки после родов. В это время, также известное как 3 стадия родов, плацента выделяет простагландины, которые приводят к ее отслоению от полости матки.[13] Схватки в этот период также минимизируют послеродовые кровотечения. Отсутствие схваток в этот период может возникать из-за атонии матки.
Гормоны
Основные вовлеченные гормоны включают эстроген, прогестерон и окситоцин. Окситоцин является одним из наиболее широко изученных гормонов, участвующих в сокращениях матки. Он снижает отток Ca2+ за счет ингибирования Ca2+/АТФазы клеточной мембраны миометрия, которая перекачивает кальций изнутри во внеклеточное пространство, и увеличивает приток Ca2+, а также вызывает высвобождение Ca2+ из SR через IICR. Исследования показывают, что повышенное соотношение эстрогена и прогестерона, возникающее перед началом родов, приводит к увеличению количества рецепторов окситоцина в матке.[14] Многие исследования на животных также показывают увеличение концентрации окситоцина перед родами; однако существует ограниченное количество данных об этом явлении у людей из-за технических трудностей определения уровня окситоцина у рожениц.[15]
Он снижает отток Ca2+ за счет ингибирования Ca2+/АТФазы клеточной мембраны миометрия, которая перекачивает кальций изнутри во внеклеточное пространство, и увеличивает приток Ca2+, а также вызывает высвобождение Ca2+ из SR через IICR. Исследования показывают, что повышенное соотношение эстрогена и прогестерона, возникающее перед началом родов, приводит к увеличению количества рецепторов окситоцина в матке.[14] Многие исследования на животных также показывают увеличение концентрации окситоцина перед родами; однако существует ограниченное количество данных об этом явлении у людей из-за технических трудностей определения уровня окситоцина у рожениц.[15]
Окситоцин: Процесс начинается в гипоталамусе, особенно в паравентрикулярном и супраоптическом ядрах. Эти ядра генерируют и секретируют окситоцин, основной вклад в который вносит паравентрикулярное ядро. Затем окситоцин поступает в заднюю долю гипофиза через гипоталамо-гипофизарный тракт. После того, как окситоцин поступает в заднюю долю гипофиза, он впоследствии получает доступ к системному кровоснабжению, которое доставляет молекулу окситоцина к рецепторам окситоцина на клетках миометрия.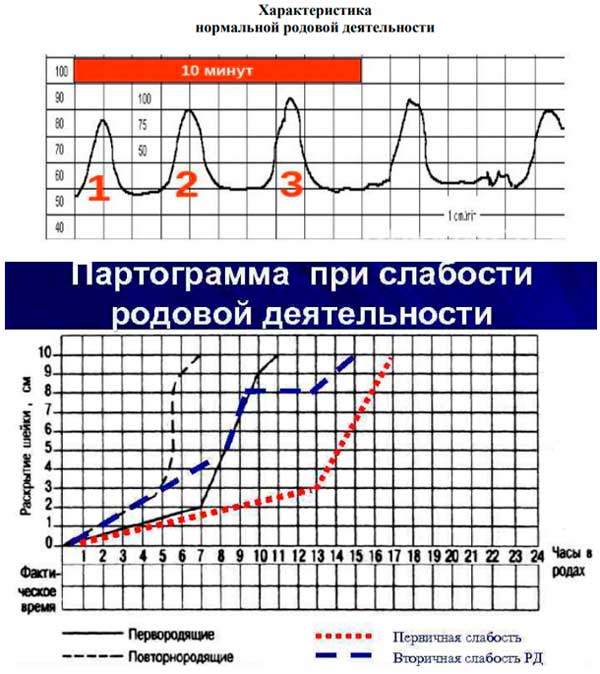 Эпителиальная выстилка матки также вырабатывает окситоцин во время беременности, где он действует как аутокринным, так и паракринным образом. Механизм положительной обратной связи окситоцина дополнительно катализирует начало родов.]. Эти рецепторы представляют собой белки родопсина класса 1 G, которые соединяются с фосфолипазой C (PLC), которая затем активирует инозитолтрифосфат (IP3) и диацилглицерол (DAG). Активированный IP3 мобилизует кальций из саркоплазматического ретикулума, который затем связывается с киназами легкой цепи миозина, что приводит к сокращение гладких мышц.[15]
Эпителиальная выстилка матки также вырабатывает окситоцин во время беременности, где он действует как аутокринным, так и паракринным образом. Механизм положительной обратной связи окситоцина дополнительно катализирует начало родов.]. Эти рецепторы представляют собой белки родопсина класса 1 G, которые соединяются с фосфолипазой C (PLC), которая затем активирует инозитолтрифосфат (IP3) и диацилглицерол (DAG). Активированный IP3 мобилизует кальций из саркоплазматического ретикулума, который затем связывается с киназами легкой цепи миозина, что приводит к сокращение гладких мышц.[15]
Прогестерон: уменьшает проницаемость для кальция, натрия и калия, а также модулирует внутриклеточное связывание кальция, что делает меньше кальция доступным для системы кальмодулин-КЛЦМ за счет увеличения скорости синтеза цАМФ. Это жизненно важно для поддержания беременности, поскольку вызывает расслабление матки на ранних сроках беременности, а его функциональная отмена приведет к увеличению соотношения эстрогена и прогестерона, что вызывает увеличение концентрации простагландинов, вызывающих роды. [20]
[20]
Сопутствующее тестирование
Основные клинические методы мониторинга активности миометрия включают использование наружных токометров и катетеров для внутриматочного давления. Хотя оба устройства позволяют визуализировать сокращения по отношению к частоте сердечных сокращений плода, только внутриматочные катетеры позволяют точно измерить силу сокращений матки. В 10-минутном окне должно быть от 3 до 5 сокращений, каждое продолжительностью от 30 до 40 секунд. Мониторинг сокращений матки должен быть постоянным во время родов.
Внешний токометр
Два датчика помещаются на живот женщины, один над дном матки, другой вблизи сердца плода. Этот подход является стандартным методом мониторинга сокращений матки у рожениц.
Катетер внутриматочного давления
Тонкий катетер вводится в матку и отслеживает изменения давления. Стандартной единицей измерения является единица Монтевидео (МВУ). Адекватными сокращениями считаются суммарные сокращения на 200 МЕ в течение 10 минут. Внутренний мониторинг имеет ограниченное применение, поскольку для его размещения требуется разрыв плодных оболочек. Он обычно используется в сочетании с электродом для скальпа плода, который контролирует частоту сердечных сокращений плода.
Внутренний мониторинг имеет ограниченное применение, поскольку для его размещения требуется разрыв плодных оболочек. Он обычно используется в сочетании с электродом для скальпа плода, который контролирует частоту сердечных сокращений плода.
Патофизиология
Хориоамнионит представляет собой острое воспаление оболочек и хориона плаценты, обычно возникающее из-за восходящей полимикробной бактериальной инфекции в условиях разрыва мембраны.[21] Это связано с повышением уровня простагландинов. Поскольку ПГ стимулирует сократимость миометрия и размягчение шейки матки, это приводит к индукции преждевременных родов.[22]
Затянувшиеся стадии родов указывают на то, что изменение шейки матки происходит медленнее, чем можно было бы ожидать, при наличии или отсутствии адекватных схваток. Арест означает полное прекращение течения родов. Его можно определить как отсутствие изменений шейки матки более 4 часов при адекватных схватках или отсутствие изменений шейки матки более 6 часов при неадекватных сокращениях. Аномальный третий период родов – это задержка плаценты более 30 минут.
Аномальный третий период родов – это задержка плаценты более 30 минут.
Клиническое значение
Понимание физиологии сокращений матки позволяет клиницистам использовать таргетную терапию как для индукции, так и для прекращения родов. Обычно используемые лекарства для индукции родов включают окситоцин, мизопростол и динопростон. Поскольку сокращения матки выполняют двойную функцию, сводя к минимуму послеродовое кровотечение, это те же лекарства, которые используются для лечения послеродового кровотечения. Карбопрост, аналог PGF2a, является дополнительным лекарственным средством, используемым для лечения послеродового кровотечения, не используемого для индукции родов.
Окситоцин обычно используется в современной акушерской практике для усиления схваток, когда родовой процесс не удался, чтобы способствовать вагинальным родам.[23]
Простагландины являются активными сократительными агентами, и их аналоги используются в сочетании с мифепристоном (антипрогестином) для опорожнения матки на очень ранних сроках и во втором триместре беременности. [24][25][24] Мизопростол дешевле гемепроста и не требует охлаждения, поэтому он является предпочтительным простагландином.
[24][25][24] Мизопростол дешевле гемепроста и не требует охлаждения, поэтому он является предпочтительным простагландином.
В 2013 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование добавок прогестерона (гидроксипрогестерона капроата) во время беременности для снижения риска повторных преждевременных родов у женщин, у которых в анамнезе как минимум один раз были спонтанные преждевременные роды.[26] Он защищает от повторных преждевременных родов, поскольку частота повторных преждевременных родов при его использовании снижается до 25-31% по сравнению с 33-47% в плацебо-контроле.[27]
Лекарства, используемые для остановки преждевременных родов, противодействуют сокращениям матки. Обычно используемые токолитики включают нифедипин, тербуталин, сульфат магния, индометацин и атозибан. На рисунке 1 обобщены препараты, используемые для индукции родов и токолиза. Из этих токолитиков бета-симпатомиметики, антагонисты рецепторов окситоцина и блокаторы кальциевых каналов имеют наиболее многообещающие данные с точки зрения эффективности [28]. Сульфат магния является слабым токолитиком, но не используется для токолиза. Его вводят для снижения риска сопутствующих неврологических заболеваний у детей, рожденных на сроке менее 32 недель беременности. Имеются данные о том, что НПВП и БКК лучше, чем магний и бета-симпатомиметики, с точки зрения неонатальных и материнских исходов и материнских осложнений.] Однако НПВП могут вызывать побочные эффекты, такие как олигогидрамнион, почечная недостаточность, некротизирующий энтероколит, внутрижелудочковое кровоизлияние и закрытие открытого артериального протока.[30] Следовательно, блокаторы кальциевых каналов являются препаратами выбора при токолизе после 32 недель беременности. БКК могут привести к материнской гипотензии и тахикардии. Токолитики не рекомендуются после 34 недель беременности , поскольку их риски перевешивают риски преждевременных родов.
Сульфат магния является слабым токолитиком, но не используется для токолиза. Его вводят для снижения риска сопутствующих неврологических заболеваний у детей, рожденных на сроке менее 32 недель беременности. Имеются данные о том, что НПВП и БКК лучше, чем магний и бета-симпатомиметики, с точки зрения неонатальных и материнских исходов и материнских осложнений.] Однако НПВП могут вызывать побочные эффекты, такие как олигогидрамнион, почечная недостаточность, некротизирующий энтероколит, внутрижелудочковое кровоизлияние и закрытие открытого артериального протока.[30] Следовательно, блокаторы кальциевых каналов являются препаратами выбора при токолизе после 32 недель беременности. БКК могут привести к материнской гипотензии и тахикардии. Токолитики не рекомендуются после 34 недель беременности , поскольку их риски перевешивают риски преждевременных родов.
Понимание нормального характера схваток также полезно для определения остановки родов, управление которой зависит от стадии. Например, остановка латентной фазы является показанием к увеличению дозы окситоцином, а остановка активной фазы является показанием к кесареву сечению. Определение истинной остановки родов требует анализа адекватности маточных сокращений, что требует использования катетера внутриматочного давления. Остановка активной фазы имеет особые требования, которые включают четыре или более часов адекватных сокращений или шесть или более часов неадекватных сокращений. Эти определения важны для клиницистов, поскольку они диктуют алгоритмы лечения.
Определение истинной остановки родов требует анализа адекватности маточных сокращений, что требует использования катетера внутриматочного давления. Остановка активной фазы имеет особые требования, которые включают четыре или более часов адекватных сокращений или шесть или более часов неадекватных сокращений. Эти определения важны для клиницистов, поскольку они диктуют алгоритмы лечения.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
В таблице приведены лекарства, используемые для лечения аномальных родов. Предоставлено Остином МакЭвоем, MS4
Ссылки
- 1.
Preller M, Manstein DJ. Структура миозина, аллостерия и механохимия. Состав. 2013 05 ноября; 21 (11): 1911-22. [В паблике: 24210227]
- 2.
Гарфилд Р.Э., Манер В.Л. Физиология и электрическая активность сокращений матки.
 Semin Cell Dev Biol. 2007 июнь; 18 (3): 289-95. [PMC free article: PMC2048588] [PubMed: 17659954]
Semin Cell Dev Biol. 2007 июнь; 18 (3): 289-95. [PMC free article: PMC2048588] [PubMed: 17659954]- 3.
Ohkubo T, Inoue Y, Kawarabayashi T, Kitamura K. Идентификация и электрофизиологические характеристики изоформ Т-типа кальциевых каналов Ca(v)3.2 выражены в матке беременного человека. Cell Physiol Biochem. 2005;16(4-6):245-54. [В паблике: 16301824]
- 4.
Ravanos K, Dagklis T, Petousis S, Margioula-Siarkou C, Prapas Y, Prapas N. Факторы, участвующие в инициации родов у человека при срочных и преждевременных родах: обзор. Гинекол Эндокринол. 2015;31(9):679-83. [PubMed: 26303116]
- 5.
Као CY, Маккалоу младший. Ионные токи в гладкой мускулатуре матки. Дж. Физиол. 1975 март; 246(1):1-36. [Бесплатная статья PMC: PMC1309402] [PubMed: 1133781]
- 6.
Рэй С., Бурдыга Т., Ноубл Д., Ноубл К., Борисова Л., Эрроусмит С. Прогресс в понимании электромеханической передачи сигналов в миометрии.
 Acta Physiol (Oxf). 2015 февраль; 213(2):417-31. [PubMed: 25439280]
Acta Physiol (Oxf). 2015 февраль; 213(2):417-31. [PubMed: 25439280]- 7.
Лефевр Д.Л., Пьерсанти М., Бай XH, Чен ZQ, Лай С.Дж. Миометриальная регуляция транскрипции гена щелевого соединения, коннексина-43. Репродукция Fertil Dev. 1995;7(3):603-11. [PubMed: 8606973]
- 8.
Адамс Уолдорф К.М., Сингх Н., Мохан А.Р., Янг Р.С., Нго Л., Дас А., Цай Дж., Бансал А., Паолелла Л., Герберт Б.Р., Сооранна С.Р., Гоф Г.М., Эстли С., Фогель К., Балдессари А.Е., Баммлер Т.К., Макдональд Дж., Граветт М.Г., Раджагопал Л., Джонсон М.Р. Перерастяжение матки вызывает преждевременные роды, опосредованные воспалением: наблюдения у беременных женщин и нечеловекообразных приматов. Am J Obstet Gynecol. 2015 Декабрь;213(6):830.e1-830.e19. [Бесплатная статья PMC: PMC4679421] [PubMed: 26284599]
- 9.
Park JS, Park CW, Lockwood CJ, Norwitz ER. Роль цитокинов в преждевременных родах. Минерва Джинеколь. 2005 г., август; 57 (4): 349–66.
 [PubMed: 16170281]
[PubMed: 16170281]- 10.
Bakker R, Pierce S, Myers D. Роль простагландинов E1 и E2, динопростона и мизопростола в созревании шейки матки и индукции родов: механистический подход. Arch Gynecol Obstet. 2017 авг; 296(2):167-179. [PubMed: 28585102]
- 11.
Кандола М.К., Сайкс Л., Ли Ю.С., Джонсон М.Р., Ханьялоглу А.С., Беннетт П.Р. Рецептор EP2 активирует двойные сигнальные пути G-белка, которые опосредуют противоположные провоспалительные и релаксационные реакции в миометрии беременных женщин. Эндокринология. 2014 г., февраль; 155(2):605-17. [PubMed: 24265450]
- 12.
Де Ренсис Ф., Салери Р., Туммарук П., Текакумпху М., Кирквуд Р.Н. Простагландин F2α и контроль воспроизводства у самок свиней: обзор. Териогенология. 2012 01 января; 77 (1): 1-11. [В паблике: 21958632]
- 13.
Husslein P. Значение окситоцина и простагландинов в механизме родов у человека. Wien Klin Wochenschr Suppl. 1984; 155:1-32.
 [PubMed: 6099005]
[PubMed: 6099005]- 14.
Иличич М., Батлер Т., Закар Т., Пол Дж.В. Экспрессия генов, участвующих в сократительной способности миометрия, изменяется во время культивирования ex situ гладкомышечной ткани беременной женщины. J гладкой мускулатуры Res. 2017;53(0):73-89. [Бесплатная статья PMC: PMC5487834] [PubMed: 28652518]
- 15.
Эроусмит С., Рэй С. Окситоцин: его механизм действия и передача сигналов рецепторов в миометрии. J Нейроэндокринол. 2014 июнь; 26 (6): 356-69. [PubMed: 24888645]
- 16.
Voltolini C, Petraglia F. Нейроэндокринология беременности и родов. Handb Clin Neurol. 2014;124:17-36. [PubMed: 25248577]
- 17.
Илиодромити З., Антонакопулос Н., Сифакис С., Цикоурас П., Данилидис А., Дафопулос К., Боцис Д., Врачнис Н. Эндокринная, паракринная и аутокринная плацента Талальные посредники в родах. Гормоны (Афины). 2012 окт-дек;11(4):397-409. [PubMed: 23422762]
- 18.

Финдли А.Л. Контроль родов. Репрод. 1972 г., сен; 4 (5): диаграмма. [PubMed: 12333036]
- 19.
Нейманн И., Дуглас А.Дж., Питтман К.Дж., Рассел Дж.А., Ландграф Р. Окситоцин, высвобождаемый в супраоптическом ядре мозга крысы посредством положительной обратной связи, участвует в событиях, связанных с родами. J Нейроэндокринол. 1996 март;8(3):227-33. [PubMed: 8730656]
- 20.
Надим Л., Шинлова О., Матысяк-Заблоки Э., Мезиано С., Донг Х., Лай С. Молекулярные доказательства функционального изъятия прогестерона в миометрии человека. Нац коммун. 2016 25 мая; 7:11565. [Бесплатная статья PMC: PMC4894948] [PubMed: 27220952]
- 21.
Тита А.Т., Эндрюс В.В. Диагностика и лечение клинического хориоамнионита. Клин Перинатол. 2010 июнь; 37(2):339-54. [Бесплатная статья PMC: PMC3008318] [PubMed: 20569811]
- 22.
ван дер Эльст CW, Лопес Берналь А., Синклер-Смит CC. Роль хориоамнионита и простагландинов в преждевременных родах.
 Акушерство Гинекол. 1991 г., май; 77 (5): 672-6. [PubMed: 1849624]
Акушерство Гинекол. 1991 г., май; 77 (5): 672-6. [PubMed: 1849624]- 23.
Кларк С.Л., Симпсон К.Р., Нокс Г.Э., Гарите Т.Дж. Окситоцин: новый взгляд на старый препарат. Am J Obstet Gynecol. 2009 г.Январь; 200(1):35.e1-6. [PubMed: 18667171]
- 24.
Быгдеман М. Применение простагландинов и их аналогов для прерывания беременности. Clin Obstet Gynaecol. 1984 г., декабрь; 11 (3): 573–84. [PubMed: 6391777]
- 25.
ДеХарт Р.М., Морхед М.С. Мифепристон. Энн Фармакотер. 2001 июнь; 35 (6): 707-19. [PubMed: 11408990]
- 26.
Norwitz ER, Caughey AB. Добавки прогестерона и профилактика преждевременных родов. Преподобный акушер-гинеколог. 2011 Лето;4(2):60-72. [Бесплатная статья PMC: PMC3218546] [PubMed: 22102929]
- 27.
Санчес-Рамос Л., Кауниц А.М., Делке И. Прогестагенные препараты для предотвращения преждевременных родов: метаанализ рандомизированных контролируемых исследований.
 Акушерство Гинекол. 2005 г., февраль; 105 (2): 273-9. [PubMed: 15684151]
Акушерство Гинекол. 2005 г., февраль; 105 (2): 273-9. [PubMed: 15684151]- 28.
Hösli I, Sperschneider C, Drack G, Zimmermann R, Surbek D, Irion O., Швейцарское общество акушерства и гинекологии. Токолиз при преждевременных родах: мнение экспертов. Arch Gynecol Obstet. 2014 Апрель; 289 (4): 903-9. [В паблике: 24385286]
- 29.
Хэнли М., Сайрес Л., Рейфф Э.С., Вуд А., Гротегут К.А., Куллер Дж.А. Токолиз: обзор литературы. Акушерство Gynecol Surv. 2019 янв; 74(1):50-55. [PubMed: 30648727]
- 30.
Абу-Ганнам Г., Уста И.М., Нассар А.Х. Индометацин при беременности: применение и безопасность. Ам Дж. Перинатол. 2012 март; 29(3):175-86. [PubMed: 21786219]
Copyright © 2023, StatPearls Publishing LLC.
Эта книга распространяется на условиях Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0)
(
http://creativecommons. org/licenses/by-nc-nd/4.0/
), что позволяет другим распространять произведение при условии, что статья не изменена и не используется в коммерческих целях. Вам не требуется получать разрешение на распространение этой статьи при условии, что вы указываете автора и журнал.
org/licenses/by-nc-nd/4.0/
), что позволяет другим распространять произведение при условии, что статья не изменена и не используется в коммерческих целях. Вам не требуется получать разрешение на распространение этой статьи при условии, что вы указываете автора и журнал.
ID книжной полки: NBK532927PMID: 30422522
Физиология, схватки при беременности — StatPearls
Книжная полка NCBI. Служба Национальной медицинской библиотеки, Национальных институтов здоровья.
StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2023 янв.
StatPearls [Интернет].
Показать подробности
Критерий поиска
Остин МакЭвой; Сара Сабир.
Информация об авторе и принадлежности
Последнее обновление: 19 сентября, 2022.
Введение
Матка представляет собой полый орган, обеспечивающий защитную и питательную поддержку яйцеклетки с момента ее оплодотворения до тех пор, пока она не превратится в хорошо развитый плод, готовый к родам. Его средний мышечный слой называется миометрием, который известен своими ритмичными сокращениями, которые приводят к «волнам эндометрия» в небеременной матке, сокращениям Брэкстона-Хикса во время беременности и настоящим родам к концу третьего триместра. Родовые схватки болезненные, регулярные, сопровождаются изменением раскрытия и/или сглаживания шейки матки.
Его средний мышечный слой называется миометрием, который известен своими ритмичными сокращениями, которые приводят к «волнам эндометрия» в небеременной матке, сокращениям Брэкстона-Хикса во время беременности и настоящим родам к концу третьего триместра. Родовые схватки болезненные, регулярные, сопровождаются изменением раскрытия и/или сглаживания шейки матки.
Вопросы, вызывающие озабоченность
Поскольку маточные сокращения всегда присутствуют в процветающей матке, они различаются по частоте, амплитуде, продолжительности и направлению распространения. Несмотря на недавние достижения в знаниях о маточных сокращениях, все еще остается огромный пробел в понимании связанной с ними физиологии на клеточном и молекулярном уровнях. Знание процесса сокращения матки, который в конечном итоге приводит к изгнанию ребенка, поможет клиницистам выявить аномалии, которые могут привести к акушерским осложнениям, таким как преждевременные роды и остановка родов. Это также поможет фармацевтам в разработке и улучшении препаратов, используемых для стимуляции родовой деятельности, индукции и токолиза. Сокращения матки также играют важную роль в минимизации послеродового кровотечения, что объясняет, почему многие препараты, используемые для лечения этого осложнения, воздействуют на пути, участвующие в сократительной способности миометрия.
Сокращения матки также играют важную роль в минимизации послеродового кровотечения, что объясняет, почему многие препараты, используемые для лечения этого осложнения, воздействуют на пути, участвующие в сократительной способности миометрия.
Сотовый уровень
Миоциты матки представляют собой гладкомышечные клетки, сильно упакованные миофиламентами, плотными телами и плотными тяжами. В этих клетках больше актина, чем миозина, в 6 раз. Плотные тельца прикрепляют актиновые филаменты друг к другу, гарантируя, что сокращение приводит к силе вдоль продольного направления миоцита. Актиновые филаменты сократительного аппарата прикреплены к цитоскелету с помощью плотных тяжей. Это приводит к передаче сил от сократительных единиц к плазматической мембране, что приводит к укорочению миоцита.
Миозин, присутствующий в этих клетках, классифицируется как MII. Это гексамерная молекула, состоящая из двух тяжелых цепей миозина (MHC) и двух пар легких цепей миозина (MLC). Он образует три основных домена. Область «головы» состоит из глобулярного N-конца MHC, который выступает латерально от филамента. Он имеет актин-связывающую область, а также сайт гидролиза АТФ, который дает энергию, необходимую для сокращения. Это преобразуется в большее движение из-за области жесткой шеи на С-концевом конце двигательной области [1]. Домен «шея» также является местом, где легкие цепи миозина связываются нековалентно. Домен «хвост» состоит из С-концевых концов тяжелых цепей миозина, которые переплетаются в α-спиральный стержень и образуют основные составляющие толстых филаментов миоцитов.
Область «головы» состоит из глобулярного N-конца MHC, который выступает латерально от филамента. Он имеет актин-связывающую область, а также сайт гидролиза АТФ, который дает энергию, необходимую для сокращения. Это преобразуется в большее движение из-за области жесткой шеи на С-концевом конце двигательной области [1]. Домен «шея» также является местом, где легкие цепи миозина связываются нековалентно. Домен «хвост» состоит из С-концевых концов тяжелых цепей миозина, которые переплетаются в α-спиральный стержень и образуют основные составляющие толстых филаментов миоцитов.
Промежуточные филаменты, присутствующие в миоцитах, не только придают форму клетке, но также помогают в передаче сигналов и пространственно-временной организации клетки, усиливая напряжение, создаваемое сократительным действием.
Клетки взаимодействуют друг с другом через соединения, называемые щелевыми соединениями, которые увеличиваются к концу беременности, чтобы способствовать синхронным сокращениям. Количество актина и миозина, присутствующих в миоцитах, увеличивается во время беременности по мере гипертрофии матки. Отложения фосфокреатина, гликогена и жирных кислот увеличиваются, чтобы обеспечить энергию для сокращений. Приток крови к матке во время беременности увеличивается синхронно с растущей потребностью в перфузии, но позже к концу беременности отстает.
Количество актина и миозина, присутствующих в миоцитах, увеличивается во время беременности по мере гипертрофии матки. Отложения фосфокреатина, гликогена и жирных кислот увеличиваются, чтобы обеспечить энергию для сокращений. Приток крови к матке во время беременности увеличивается синхронно с растущей потребностью в перфузии, но позже к концу беременности отстает.
Развитие
Миометрий состоит из двух слоев. Кольцевой слой тоньше и присутствует на самой внутренней стороне мышечных волокон и происходит от парамезонефральных/мюллеровых протоков. Это называется субэндометриальным или соединительным эндометрием. Наружный продольный слой состоит из переплетенных мышечных пучков, встроенных во внеклеточный матрикс из коллагеновых волокон, который сильно васкуляризирован. Это помогает создать интенсивное давление, необходимое для сокращений. Продольный слой происходит из немюллеровой ткани. Оба слоя работают вместе, чтобы вытолкнуть плод из полости матки. В некоторых исследованиях было высказано предположение, что клетки миометрия обладают способностями «водителей ритма», например, присутствующими в кишечнике и уретре, которые способствуют синхронным сокращениям матки, хотя доказательства этого противоречивы.
Функция
Основной функцией сокращений матки является изгнание плода из полости матки. Однако схватки также играют важную роль в минимизации послеродового кровотечения. Знание нормальной физиологии маточных сокращений также позволяет клиницистам лучше различать истинное начало родов и продромальные роды, также известные как схватки Брэкстона-Хикса. Схватки Брэкстона-Хикса возникают спорадически и не увеличиваются в силе. Они нерегулярны по продолжительности, частоте и интенсивности, непредсказуемы и неритмичны и скорее неприятны, чем болезненны. Истинные роды состоят из схваток через равные промежутки времени. По мере прогрессирования родов эти сокращения становятся сильнее, а время между каждым сокращением уменьшается. Первый период родов делится на две фазы, которые определяются степенью раскрытия шейки матки. Латентная фаза наступает при раскрытии от 0 до 6 см, тогда как активная фаза начинается с 6 см до полного раскрытия шейки матки в 10 см. Второй период родов начинается с раскрытия шейки матки на 10 см и заканчивается рождением ребенка. Третий период родов начинается с рождения плода и заканчивается рождением плаценты.
Третий период родов начинается с рождения плода и заканчивается рождением плаценты.
Механизм
Электрофизиология сокращений
Мембранный потенциал покоя обусловлен электрохимическим градиентом, в основном создаваемым ионами калия, сконцентрированными внутри клетки, и, в меньшей степени, ионами кальция, натрия и хлорида, сконцентрированными внеклеточно.
В миоцитах матки наблюдались два типа потенциалов действия: один включает деполяризацию с последующей быстрой реполяризацией, а другой — начальную деполяризацию с устойчивым плато. Это высвобождение ионов кальция из внутриклеточных запасов, а также приток ионов кальция из внеклеточного пространства, которые инициируют потенциалы действия. Когда мембранный потенциал деполяризуется примерно до -40 мВ, кальциевые каналы L-типа, управляемые напряжением, открываются, вызывая приток ионов кальция. Са-каналы Т-типа также обнаружены в миоцитах матки и играют роль в распространении потенциалов действия. [3]
[3]
Взаимодействие маточных агонистов с GPCR, расположенным на плазматической мембране миоцита, приводит к цепочке событий, в конечном итоге вызывающих IP-IPR-опосредованное высвобождение Ca из саркоплазматического ретикулума. Это дополнительно повышало концентрацию кальция в цитозоле, а также напряжение плазматической мембраны. Другим процессом, вызывающим распространение потенциала действия, является механизм положительной обратной связи кальция, известный как кальций-индуцированное высвобождение кальция (CICR), при котором увеличение внутриклеточной концентрации кальция стимулирует открытие других кальциевых каналов. Возможно, наиболее плохо изученным является путь входа Ca , управляемый депо (SOCE). Когда внутриклеточные запасы Ca в SR опустошаются, высвобождается «фактор притока кальция» (CIF), который заставляет плазматическую мембрану обеспечивать приток внеклеточного Ca. Липидные рафты, называемые «кавеолами», которые стабилизированы каркасным белком, кавеолином, присутствующим на плазматической мембране миоцитов, также участвуют в передаче сигнала и возбудимости миоцитов.
После притока ионов кальция и их последующего связывания с кальмодулином конформационное изменение киназы легкой цепи миозина приводит к усилению фосфорилирования легкой цепи миозина по сериновому остатку 19, что вызывает присоединение миозинового поперечного мостика к актиновой нити и вызвать сокращение.
Релаксация миоцита обусловлена выходом ионов кальция из цитозоля в СР и межклеточное пространство. Са-АТФаза плазматической мембраны (PMCA) и Са-АТФаза SR/ER (SERCA) относятся к семейству Са-АТФаз Р-типа и отвечают за перемещение одного иона Са из внутриклеточного компартмента в обмен на Н+, восстанавливают покоящиеся мембранный потенциал. Другой механизм включает обменник Na/Ca (NCX) благодаря электрохимическому градиенту Na, создаваемому Na/K АТФазой. Интересно, что кальций сам по себе вызывает клиренс ионов кальция: ионы кальция ингибируют кальциевые каналы L-типа, а комплекс кальций-кальмодулин также стимулирует CaM-киназу II (CaMKII), которая ингибирует кальциевые каналы L-типа.
Сенсибилизация и десенсибилизация кальцием
Повышенная чувствительность регуляторных и сократительных белков к кальцию, которая в конечном итоге приводит к более сильному сокращению после стимуляции агонистом, известна как кальциевая сенсибилизация. Обратное верно для десенсибилизации кальция. Это устанавливается посредством сигнального пути RhoA/Rho-киназы. Активация рецепторов, связанных с G-белком (GPCR), вызывает привлечение RhoA к плазматической мембране после замены GDP на GTP. Это активирует Rho-ассоциированную киназу (ROK), которая фосфорилирует субъединицу, нацеленную на миозин (MYPT1) фосфатазы легкой цепи миозина, предотвращая дефосфорилирование легкой цепи миозина. мРНК для RhoA, ROK-1 и ROK-2 присутствуют в небеременной матке и увеличиваются во время беременности. Ингибирование ROK препятствует развитию силы и способствует расслаблению без изменения уровня [Ca] при спонтанных и стимулированных агонистами сокращениях. Точно так же цАМФ вызывает фосфорилирование самой КЛЦМ с помощью цАМФ-зависимой протеинкиназы, которая снижает ферментативную активность за счет уменьшения сродства КЛЦМ к комплексу кальмодулин-кальций. На поверхности клеток миометрия обнаружено несколько рецепторов, влияющих на сократительную способность. К ним относятся:
На поверхности клеток миометрия обнаружено несколько рецепторов, влияющих на сократительную способность. К ним относятся:
Рецепторы окситоцина: агонисты сократимости
Рецепторы эстрогена: агонисты сократимости
Рецепторы прогестерона: антагонисты сократимости 070
Бета2 адренорецепторы вызывают повышение уровня цАМФ, следовательно, антагонист сократимости
Альфа- адренергические рецепторы вызывают снижение уровня цАМФ, следовательно, агонисты сократительной способности
Эти рецепторы являются мишенями для многих препаратов, используемых при лечении аномальных родов, как мы увидим позже.
Точная последовательность событий, которая приводит к маточным сокращениям, до сих пор в значительной степени неизвестна. Некоторые исследования предполагают, что механическое растяжение и гормоны работают вместе, чтобы инициировать схватки при нормальных родах.[2] Однако из-за роли воспаления в преждевременных родах другие исследования предполагают, что медиаторы воспаления, такие как цитокины и простагландины, инициируют сокращения матки. [4]
[4]
Механическая растяжка
Механическое растяжение относится к натяжению клеток миометрия при растяжении матки. Физическое растяжение матки приводит к притоку ионов, а именно натрия и кальция, что изменяет потенциал действия в клетках миометрия.[5][6] Это изменение облегчает начало сокращений матки. Количество коннексинов (щелевых соединений) между клетками миометрия увеличивается непосредственно перед родами, что обеспечивает скоординированное сокращение мышц. Эти межклеточные контакты менее распространены на ранних сроках беременности, что способствует спокойствию матки.[7] Также высказывалось предположение, что перерастяжение матки вызывает «воспалительный пульс», который дополнительно активирует сократительную способность миометрия.[8]
Медиаторы воспаления
Многие исследования показывают, что воспаление является медиатором родов.[8][9] Маркеры воспаления, в первую очередь, включают простагландины, концентрация которых увеличивается перед началом родов из-за функциональной отмены прогестерона, что приводит к увеличению отношения эстрогена к прогестерону. [10] Амнион и хорион продуцируют PGE2, а децидуальная оболочка продуцирует как PGE2, так и PGF2.
[10] Амнион и хорион продуцируют PGE2, а децидуальная оболочка продуцирует как PGE2, так и PGF2.
Два наиболее изученных простагландина, участвующих в сокращениях матки, включают простагландин E1 (PGE1) и простагландин E2 (PGE2). Они стимулируют сократимость миометрия, скорее всего, действуя как ионофоры кальция, что приводит к увеличению внутриклеточного кальция. Мизопростол представляет собой синтетическую версию ПГЕ1, который, хотя изначально был разработан для предотвращения пептических язв, оказывает дозозависимое действие на сократительную способность миометрия [10].
PGE2 также играет роль в сокращении матки, активируя рецепторы EP1 и EP3 на клетках миометрия.[11] Однако основным физиологическим эффектом PGE2 во время родов является активация медиаторов воспаления IL-8 и TNF-альфа, которые активируют коллагеназы и MMP, что приводит к созреванию шейки матки.
Простагландин F2 альфа (PGF2a) менее изучен, но считается, что он снижает уровень прогестерона и независимо увеличивает сократительную способность матки за счет стимуляции гладкомышечных клеток. [12]
[12]
Простагландины также играют роль в сокращении матки после родов. В это время, также известное как 3 стадия родов, плацента выделяет простагландины, которые приводят к ее отслоению от полости матки.[13] Схватки в этот период также минимизируют послеродовые кровотечения. Отсутствие схваток в этот период может возникать из-за атонии матки.
Гормоны
Основные вовлеченные гормоны включают эстроген, прогестерон и окситоцин. Окситоцин является одним из наиболее широко изученных гормонов, участвующих в сокращениях матки. Он снижает отток Ca2+ за счет ингибирования Ca2+/АТФазы клеточной мембраны миометрия, которая перекачивает кальций изнутри во внеклеточное пространство, и увеличивает приток Ca2+, а также вызывает высвобождение Ca2+ из SR через IICR. Исследования показывают, что повышенное соотношение эстрогена и прогестерона, возникающее перед началом родов, приводит к увеличению количества рецепторов окситоцина в матке.[14] Многие исследования на животных также показывают увеличение концентрации окситоцина перед родами; однако существует ограниченное количество данных об этом явлении у людей из-за технических трудностей определения уровня окситоцина у рожениц. [15]
[15]
Окситоцин: Процесс начинается в гипоталамусе, особенно в паравентрикулярном и супраоптическом ядрах. Эти ядра генерируют и секретируют окситоцин, основной вклад в который вносит паравентрикулярное ядро. Затем окситоцин поступает в заднюю долю гипофиза через гипоталамо-гипофизарный тракт. После того, как окситоцин поступает в заднюю долю гипофиза, он впоследствии получает доступ к системному кровоснабжению, которое доставляет молекулу окситоцина к рецепторам окситоцина на клетках миометрия. Эпителиальная выстилка матки также вырабатывает окситоцин во время беременности, где он действует как аутокринным, так и паракринным образом. Механизм положительной обратной связи окситоцина дополнительно катализирует начало родов.]. Эти рецепторы представляют собой белки родопсина класса 1 G, которые соединяются с фосфолипазой C (PLC), которая затем активирует инозитолтрифосфат (IP3) и диацилглицерол (DAG). Активированный IP3 мобилизует кальций из саркоплазматического ретикулума, который затем связывается с киназами легкой цепи миозина, что приводит к сокращение гладких мышц. [15]
[15]
Прогестерон: уменьшает проницаемость для кальция, натрия и калия, а также модулирует внутриклеточное связывание кальция, что делает меньше кальция доступным для системы кальмодулин-КЛЦМ за счет увеличения скорости синтеза цАМФ. Это жизненно важно для поддержания беременности, поскольку вызывает расслабление матки на ранних сроках беременности, а его функциональная отмена приведет к увеличению соотношения эстрогена и прогестерона, что вызывает увеличение концентрации простагландинов, вызывающих роды.[20]
Сопутствующее тестирование
Основные клинические методы мониторинга активности миометрия включают использование наружных токометров и катетеров для внутриматочного давления. Хотя оба устройства позволяют визуализировать сокращения по отношению к частоте сердечных сокращений плода, только внутриматочные катетеры позволяют точно измерить силу сокращений матки. В 10-минутном окне должно быть от 3 до 5 сокращений, каждое продолжительностью от 30 до 40 секунд. Мониторинг сокращений матки должен быть постоянным во время родов.
Мониторинг сокращений матки должен быть постоянным во время родов.
Внешний токометр
Два датчика помещаются на живот женщины, один над дном матки, другой вблизи сердца плода. Этот подход является стандартным методом мониторинга сокращений матки у рожениц.
Катетер внутриматочного давления
Тонкий катетер вводится в матку и отслеживает изменения давления. Стандартной единицей измерения является единица Монтевидео (МВУ). Адекватными сокращениями считаются суммарные сокращения на 200 МЕ в течение 10 минут. Внутренний мониторинг имеет ограниченное применение, поскольку для его размещения требуется разрыв плодных оболочек. Он обычно используется в сочетании с электродом для скальпа плода, который контролирует частоту сердечных сокращений плода.
Патофизиология
Хориоамнионит представляет собой острое воспаление оболочек и хориона плаценты, обычно возникающее из-за восходящей полимикробной бактериальной инфекции в условиях разрыва мембраны. [21] Это связано с повышением уровня простагландинов. Поскольку ПГ стимулирует сократимость миометрия и размягчение шейки матки, это приводит к индукции преждевременных родов.[22]
[21] Это связано с повышением уровня простагландинов. Поскольку ПГ стимулирует сократимость миометрия и размягчение шейки матки, это приводит к индукции преждевременных родов.[22]
Затянувшиеся стадии родов указывают на то, что изменение шейки матки происходит медленнее, чем можно было бы ожидать, при наличии или отсутствии адекватных схваток. Арест означает полное прекращение течения родов. Его можно определить как отсутствие изменений шейки матки более 4 часов при адекватных схватках или отсутствие изменений шейки матки более 6 часов при неадекватных сокращениях. Аномальный третий период родов – это задержка плаценты более 30 минут.
Клиническое значение
Понимание физиологии сокращений матки позволяет клиницистам использовать таргетную терапию как для индукции, так и для прекращения родов. Обычно используемые лекарства для индукции родов включают окситоцин, мизопростол и динопростон. Поскольку сокращения матки выполняют двойную функцию, сводя к минимуму послеродовое кровотечение, это те же лекарства, которые используются для лечения послеродового кровотечения. Карбопрост, аналог PGF2a, является дополнительным лекарственным средством, используемым для лечения послеродового кровотечения, не используемого для индукции родов.
Карбопрост, аналог PGF2a, является дополнительным лекарственным средством, используемым для лечения послеродового кровотечения, не используемого для индукции родов.
Окситоцин обычно используется в современной акушерской практике для усиления схваток, когда родовой процесс не удался, чтобы способствовать вагинальным родам.[23]
Простагландины являются активными сократительными агентами, и их аналоги используются в сочетании с мифепристоном (антипрогестином) для опорожнения матки на очень ранних сроках и во втором триместре беременности.[24][25][24] Мизопростол дешевле гемепроста и не требует охлаждения, поэтому он является предпочтительным простагландином.
В 2013 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило использование добавок прогестерона (гидроксипрогестерона капроата) во время беременности для снижения риска повторных преждевременных родов у женщин, у которых в анамнезе как минимум один раз были спонтанные преждевременные роды. [26] Он защищает от повторных преждевременных родов, поскольку частота повторных преждевременных родов при его использовании снижается до 25-31% по сравнению с 33-47% в плацебо-контроле.[27]
[26] Он защищает от повторных преждевременных родов, поскольку частота повторных преждевременных родов при его использовании снижается до 25-31% по сравнению с 33-47% в плацебо-контроле.[27]
Лекарства, используемые для остановки преждевременных родов, противодействуют сокращениям матки. Обычно используемые токолитики включают нифедипин, тербуталин, сульфат магния, индометацин и атозибан. На рисунке 1 обобщены препараты, используемые для индукции родов и токолиза. Из этих токолитиков бета-симпатомиметики, антагонисты рецепторов окситоцина и блокаторы кальциевых каналов имеют наиболее многообещающие данные с точки зрения эффективности [28]. Сульфат магния является слабым токолитиком, но не используется для токолиза. Его вводят для снижения риска сопутствующих неврологических заболеваний у детей, рожденных на сроке менее 32 недель беременности. Имеются данные о том, что НПВП и БКК лучше, чем магний и бета-симпатомиметики, с точки зрения неонатальных и материнских исходов и материнских осложнений. ] Однако НПВП могут вызывать побочные эффекты, такие как олигогидрамнион, почечная недостаточность, некротизирующий энтероколит, внутрижелудочковое кровоизлияние и закрытие открытого артериального протока.[30] Следовательно, блокаторы кальциевых каналов являются препаратами выбора при токолизе после 32 недель беременности. БКК могут привести к материнской гипотензии и тахикардии. Токолитики не рекомендуются после 34 недель беременности , поскольку их риски перевешивают риски преждевременных родов.
] Однако НПВП могут вызывать побочные эффекты, такие как олигогидрамнион, почечная недостаточность, некротизирующий энтероколит, внутрижелудочковое кровоизлияние и закрытие открытого артериального протока.[30] Следовательно, блокаторы кальциевых каналов являются препаратами выбора при токолизе после 32 недель беременности. БКК могут привести к материнской гипотензии и тахикардии. Токолитики не рекомендуются после 34 недель беременности , поскольку их риски перевешивают риски преждевременных родов.
Понимание нормального характера схваток также полезно для определения остановки родов, управление которой зависит от стадии. Например, остановка латентной фазы является показанием к увеличению дозы окситоцином, а остановка активной фазы является показанием к кесареву сечению. Определение истинной остановки родов требует анализа адекватности маточных сокращений, что требует использования катетера внутриматочного давления. Остановка активной фазы имеет особые требования, которые включают четыре или более часов адекватных сокращений или шесть или более часов неадекватных сокращений. Эти определения важны для клиницистов, поскольку они диктуют алгоритмы лечения.
Эти определения важны для клиницистов, поскольку они диктуют алгоритмы лечения.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Рисунок
В таблице приведены лекарства, используемые для лечения аномальных родов. Предоставлено Остином МакЭвоем, MS4
Ссылки
- 1.
Preller M, Manstein DJ. Структура миозина, аллостерия и механохимия. Состав. 2013 05 ноября; 21 (11): 1911-22. [В паблике: 24210227]
- 2.
Гарфилд Р.Э., Манер В.Л. Физиология и электрическая активность сокращений матки. Semin Cell Dev Biol. 2007 июнь; 18 (3): 289-95. [PMC free article: PMC2048588] [PubMed: 17659954]
- 3.
Ohkubo T, Inoue Y, Kawarabayashi T, Kitamura K. Идентификация и электрофизиологические характеристики изоформ Т-типа кальциевых каналов Ca(v)3.2 выражены в матке беременного человека.
 Cell Physiol Biochem. 2005;16(4-6):245-54. [В паблике: 16301824]
Cell Physiol Biochem. 2005;16(4-6):245-54. [В паблике: 16301824]- 4.
Ravanos K, Dagklis T, Petousis S, Margioula-Siarkou C, Prapas Y, Prapas N. Факторы, участвующие в инициации родов у человека при срочных и преждевременных родах: обзор. Гинекол Эндокринол. 2015;31(9):679-83. [PubMed: 26303116]
- 5.
Као CY, Маккалоу младший. Ионные токи в гладкой мускулатуре матки. Дж. Физиол. 1975 март; 246(1):1-36. [Бесплатная статья PMC: PMC1309402] [PubMed: 1133781]
- 6.
Рэй С., Бурдыга Т., Ноубл Д., Ноубл К., Борисова Л., Эрроусмит С. Прогресс в понимании электромеханической передачи сигналов в миометрии. Acta Physiol (Oxf). 2015 февраль; 213(2):417-31. [PubMed: 25439280]
- 7.
Лефевр Д.Л., Пьерсанти М., Бай XH, Чен ZQ, Лай С.Дж. Миометриальная регуляция транскрипции гена щелевого соединения, коннексина-43. Репродукция Fertil Dev. 1995;7(3):603-11. [PubMed: 8606973]
- 8.

Адамс Уолдорф К.М., Сингх Н., Мохан А.Р., Янг Р.С., Нго Л., Дас А., Цай Дж., Бансал А., Паолелла Л., Герберт Б.Р., Сооранна С.Р., Гоф Г.М., Эстли С., Фогель К., Балдессари А.Е., Баммлер Т.К., Макдональд Дж., Граветт М.Г., Раджагопал Л., Джонсон М.Р. Перерастяжение матки вызывает преждевременные роды, опосредованные воспалением: наблюдения у беременных женщин и нечеловекообразных приматов. Am J Obstet Gynecol. 2015 Декабрь;213(6):830.e1-830.e19. [Бесплатная статья PMC: PMC4679421] [PubMed: 26284599]
- 9.
Park JS, Park CW, Lockwood CJ, Norwitz ER. Роль цитокинов в преждевременных родах. Минерва Джинеколь. 2005 г., август; 57 (4): 349–66. [PubMed: 16170281]
- 10.
Bakker R, Pierce S, Myers D. Роль простагландинов E1 и E2, динопростона и мизопростола в созревании шейки матки и индукции родов: механистический подход. Arch Gynecol Obstet. 2017 авг; 296(2):167-179. [PubMed: 28585102]
- 11.
Кандола М.
 К., Сайкс Л., Ли Ю.С., Джонсон М.Р., Ханьялоглу А.С., Беннетт П.Р. Рецептор EP2 активирует двойные сигнальные пути G-белка, которые опосредуют противоположные провоспалительные и релаксационные реакции в миометрии беременных женщин. Эндокринология. 2014 г., февраль; 155(2):605-17. [PubMed: 24265450]
К., Сайкс Л., Ли Ю.С., Джонсон М.Р., Ханьялоглу А.С., Беннетт П.Р. Рецептор EP2 активирует двойные сигнальные пути G-белка, которые опосредуют противоположные провоспалительные и релаксационные реакции в миометрии беременных женщин. Эндокринология. 2014 г., февраль; 155(2):605-17. [PubMed: 24265450]- 12.
Де Ренсис Ф., Салери Р., Туммарук П., Текакумпху М., Кирквуд Р.Н. Простагландин F2α и контроль воспроизводства у самок свиней: обзор. Териогенология. 2012 01 января; 77 (1): 1-11. [В паблике: 21958632]
- 13.
Husslein P. Значение окситоцина и простагландинов в механизме родов у человека. Wien Klin Wochenschr Suppl. 1984; 155:1-32. [PubMed: 6099005]
- 14.
Иличич М., Батлер Т., Закар Т., Пол Дж.В. Экспрессия генов, участвующих в сократительной способности миометрия, изменяется во время культивирования ex situ гладкомышечной ткани беременной женщины. J гладкой мускулатуры Res. 2017;53(0):73-89. [Бесплатная статья PMC: PMC5487834] [PubMed: 28652518]
- 15.

Эроусмит С., Рэй С. Окситоцин: его механизм действия и передача сигналов рецепторов в миометрии. J Нейроэндокринол. 2014 июнь; 26 (6): 356-69. [PubMed: 24888645]
- 16.
Voltolini C, Petraglia F. Нейроэндокринология беременности и родов. Handb Clin Neurol. 2014;124:17-36. [PubMed: 25248577]
- 17.
Илиодромити З., Антонакопулос Н., Сифакис С., Цикоурас П., Данилидис А., Дафопулос К., Боцис Д., Врачнис Н. Эндокринная, паракринная и аутокринная плацента Талальные посредники в родах. Гормоны (Афины). 2012 окт-дек;11(4):397-409. [PubMed: 23422762]
- 18.
Финдли А.Л. Контроль родов. Репрод. 1972 г., сен; 4 (5): диаграмма. [PubMed: 12333036]
- 19.
Нейманн И., Дуглас А.Дж., Питтман К.Дж., Рассел Дж.А., Ландграф Р. Окситоцин, высвобождаемый в супраоптическом ядре мозга крысы посредством положительной обратной связи, участвует в событиях, связанных с родами. J Нейроэндокринол.
 1996 март;8(3):227-33. [PubMed: 8730656]
1996 март;8(3):227-33. [PubMed: 8730656]- 20.
Надим Л., Шинлова О., Матысяк-Заблоки Э., Мезиано С., Донг Х., Лай С. Молекулярные доказательства функционального изъятия прогестерона в миометрии человека. Нац коммун. 2016 25 мая; 7:11565. [Бесплатная статья PMC: PMC4894948] [PubMed: 27220952]
- 21.
Тита А.Т., Эндрюс В.В. Диагностика и лечение клинического хориоамнионита. Клин Перинатол. 2010 июнь; 37(2):339-54. [Бесплатная статья PMC: PMC3008318] [PubMed: 20569811]
- 22.
ван дер Эльст CW, Лопес Берналь А., Синклер-Смит CC. Роль хориоамнионита и простагландинов в преждевременных родах. Акушерство Гинекол. 1991 г., май; 77 (5): 672-6. [PubMed: 1849624]
- 23.
Кларк С.Л., Симпсон К.Р., Нокс Г.Э., Гарите Т.Дж. Окситоцин: новый взгляд на старый препарат. Am J Obstet Gynecol. 2009 г.Январь; 200(1):35.e1-6. [PubMed: 18667171]
- 24.
Быгдеман М. Применение простагландинов и их аналогов для прерывания беременности.
 Clin Obstet Gynaecol. 1984 г., декабрь; 11 (3): 573–84. [PubMed: 6391777]
Clin Obstet Gynaecol. 1984 г., декабрь; 11 (3): 573–84. [PubMed: 6391777]- 25.
ДеХарт Р.М., Морхед М.С. Мифепристон. Энн Фармакотер. 2001 июнь; 35 (6): 707-19. [PubMed: 11408990]
- 26.
Norwitz ER, Caughey AB. Добавки прогестерона и профилактика преждевременных родов. Преподобный акушер-гинеколог. 2011 Лето;4(2):60-72. [Бесплатная статья PMC: PMC3218546] [PubMed: 22102929]
- 27.
Санчес-Рамос Л., Кауниц А.М., Делке И. Прогестагенные препараты для предотвращения преждевременных родов: метаанализ рандомизированных контролируемых исследований. Акушерство Гинекол. 2005 г., февраль; 105 (2): 273-9. [PubMed: 15684151]
- 28.
Hösli I, Sperschneider C, Drack G, Zimmermann R, Surbek D, Irion O., Швейцарское общество акушерства и гинекологии. Токолиз при преждевременных родах: мнение экспертов. Arch Gynecol Obstet. 2014 Апрель; 289 (4): 903-9. [В паблике: 24385286]
- 29.

