Содержание
Стволовые клетки и их применение
В настоящее время, в связи со сложностями, связанными с организацией лечения в Турции, Швейцарии, Южной Корее и Индии, мы приостановили обработку заявок по этим направлениям.
Если вас интересует организация лечения в Германии, оставьте, пожалуйста, заявку, и наши специалисты свяжутся с вами в ближайшее время.
Если вам нужна информация о лечении стволовыми клетками или стоимости лечения, вы можете найти ее здесь
О лечении Стоимость лечения
Стволовые клетки представляют собой незрелые (недифференцированные) структуры. Из стволовых клеток в процессе дозревания могут формироваться более зрелые клетки различных тканей. Это зависит от того, какие биологически активные соединения (факторы роста) оказывают на них влияние, а также от наличия рядом других органов и тканей. Эти особенности стволовых клеток дали возможность их использования в медицине. Наиболее широкое распространение они получили в трансплантологии.
Наиболее широкое распространение они получили в трансплантологии.
Содержание
- Свойства стволовых клеток
- Виды стволовых клеток
- Основные направления применения стволовых клеток
- В каких клиниках можно пройти курс лечения стволовыми клетками?
- Организация лечения за границей
Свойства стволовых клеток
За счет того, что стволовые клетки являются недифференцированными структурами, они обладают рядом определенных свойств, к которым относятся:
- Полипотентность – основное свойство данных клеток, благодаря которому они получили широкое применение в практической медицине. Данное свойство обуславливает возможность дифференцировки стволовых клеток в практически любую ткань, что зависит от их окружения.
- Неограниченная пролиферация – стволовые клетки обладают способностью к делению на искусственных питательных средах без дозревания. Это позволяет искусственно увеличивать их количество в лабораторных условиях.
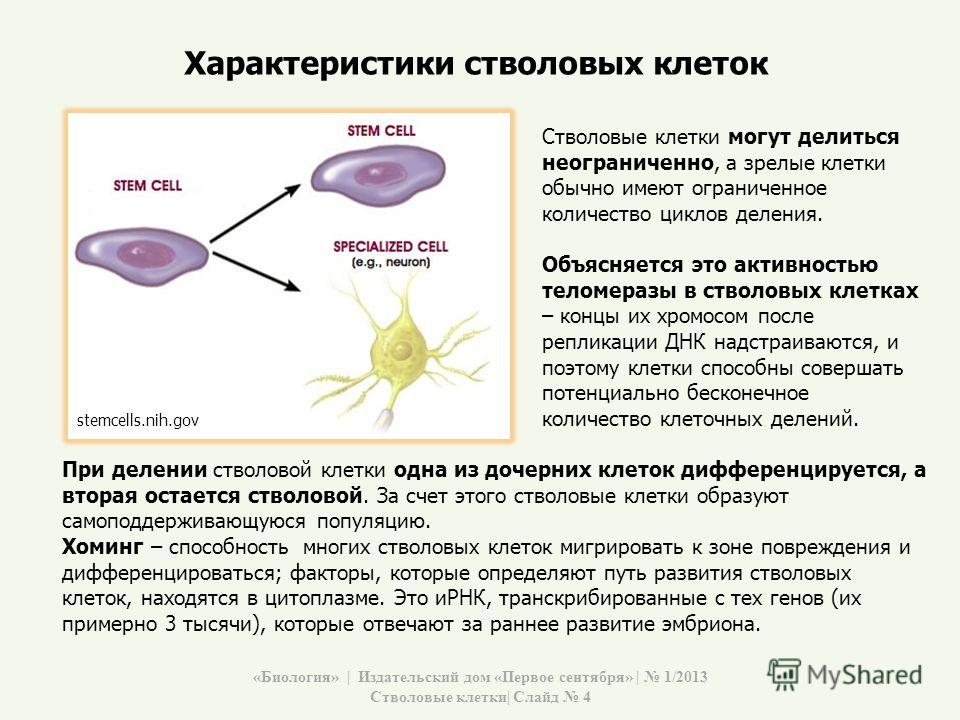
- Длительный период жизни –клетки могут длительный период времени сохранять свою жизнеспособность.
Все эти свойства стволовых клеток дают возможность активно применять их в трансплантологии для получения тканей, подлежащих пересадке.
Виды стволовых клеток
В зависимости от того, где стволовые клетки были взяты, а также от степени их зрелости, выделяют несколько их типов:
- Эмбриональные клетки – берутся из эмбриобласта зародыша еще до имплантации эмбриона в слизистую оболочку матки. Они обладают наименьшей зрелостью, поэтому могут давать начало любой ткани организма человека.
- Фетальные клетки – находятся в организме плода, их получают после выполненного по медицинским показаниям аборта или из пуповинной крови. Они обладают меньшей потентностью, поэтому могут дифференцироваться не во все ткани.
- Постанатальные клетки – данные структуры находятся в организме человека после рождения.
 В зависимости от их локализации выделяются гемопоэтические (дают начало клеткам крови), стромальные (предшественники соединительной ткани) и тканеспецифические (обладают наименьшей потентностью, находятся практически во всех тканях организма человека) клетки.
В зависимости от их локализации выделяются гемопоэтические (дают начало клеткам крови), стромальные (предшественники соединительной ткани) и тканеспецифические (обладают наименьшей потентностью, находятся практически во всех тканях организма человека) клетки.
В трансплантологии могут использоваться различные типы стволовых клеток, что зависит от тканей или органа, которые требуют пересадки.
Основные направления применения стволовых клеток
Основной целью использования стволовых клеток в различных областях медицины является замещение поврежденных тканей (трансплантация), которая включает несколько направлений:
- Трансплантация красного костного мозга
- Матриксиндуцированный хондрогенез для восстановления хрящей суставной поверхности
- Получение («выращивание») сетчатки глаза для имплантации в офтальмологии
- Восстановление нервов
- Трансплантация сосудов
- Получение структур бронхолегочной системы на специальном матриксе с последующей имплантацией
Перспективными являются направления трансплантации «выращенных» частей почек и других органов мочевыделительной системы, а также желез внутренней секреции.
Трансплантация стволовых клеток. Использование стволовых клеток является одной из эффективнейших методик лечения лейкоза и некоторых других заболеваний системы кроветворения. Для этого используются гемопоэтические клетки. После их взятия у донора проводится накопление (культивация) в лабораторных условиях, после чего они вводятся в красный костный мозг. При этом достигается основной терапевтический эффект – нормализация формирования и дозревания клеток всех ростков кроветворения.
Матриксиндуцированный хондрогенез. Медицинские специалисты в области ортопедии и травматологии часто сталкиваются с патологическими состояниями, характеризующимися дегенерацией (разрушением) хрящевых компонентов на фоне их ухудшенного питания или длительного воспалительного процесса. Восстановление хрящевой ткани при помощи обычных методик консервативной терапии является невозможным. Поэтому единственной возможностью провести восстановление является имплантация. При помощи современных технологий в специальный матрикс, представляющий собой межклеточное вещество хрящевой ткани, вводятся стволовые клетки, из которых формируются полноценные хондроциты (основные клетки хрящевой ткани). Затем «выращенная» хрящевая ткань имплантируется в сустав.
Затем «выращенная» хрящевая ткань имплантируется в сустав.
«Выращивание» сетчатки. Сетчатка глаза представляет собой сложную структуру, которая после травматических повреждений или патологического процесса не восстанавливается. Единственным способом вернуть пациенту нормальное зрение является пересадка данной структуры. При помощи современных технологий с использованием стволовых клеток на специальном матриксе выполняется «наращивание» зрелых клеток сетчатки с последующей ее имплантацией.
Трансплантация сосудов. Современные технологии применения стволовых клеток в медицине включают «выращивание» участка артериального сосуда, с последующей его имплантацией. Преимущественно данная технология используется для «замены» артерий, пораженных атеросклерозом: в сердце, головном мозге и других органах.
Перспективными являются методики использования эмбриональных стволовых клеток для «выращивания» структур бронхолегочной, мочевыделительной и эндокринной системы.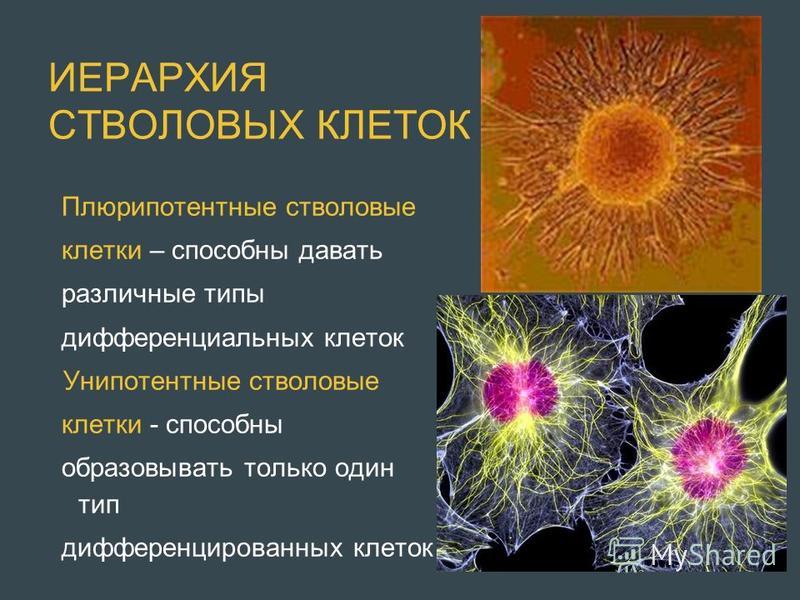 Основным преимуществом данных технологий является то, что эмбриональные клетки на поверхности не содержат антигенов тканевой совместимости, поэтому полученные из них ткани после имплантации не отторгаются организмом пациента.
Основным преимуществом данных технологий является то, что эмбриональные клетки на поверхности не содержат антигенов тканевой совместимости, поэтому полученные из них ткани после имплантации не отторгаются организмом пациента.
Подобрать профильную клинику и лечение
В каких клиниках можно пройти курс лечения стволовыми клетками?
В большинстве развивающихся стран новейшие методики клеточной терапии не используются. Поэтому пациентам приходится выезжать за границу для получения высокотехнологичной медицинской помощи. Одним из популярных направлений для медицинского туризма стала Германия. Здесь давно и успешно применяются стволовые клетки для лечения различных патологий.
Вот некоторые клиники, где применяется клеточная терапия:
- Университетская клиника Ульма. В данном медучреждении функционирует Отделение гематологии, онкологии и паллиативной медицины. Здесь проводится трансплантация как аутологичных (собственных), так и аллогенных (от донора) стволовых клеток.
 При помощи этой методики специалисты клиники успешно лечат лейкозы, апластические и миелодиспластические синдромы.
При помощи этой методики специалисты клиники успешно лечат лейкозы, апластические и миелодиспластические синдромы. - Ортопедический центр Мюнхен Ост. Здесь применяется клеточная терапия для восстановления хрящей. Их выращивают из стволовых клеток и пересаживают пациенту. Это один из наиболее эффективных малоинвазивных методов лечения артроза. Он позволяет отсрочить или избежать эндопротезирования (установки искусственного сустава).
- Клиника расширенной биологической медицины в Франкфурте-на-Майне. Здесь практикуются методики интегративной медицины, и стволовые клетки используются для лечения многих хронических заболеваний: рассеянного склероза, кардиомиопатий, болезни Альцгеймера, болезни Паркинсона, болезни Лайма, атрофии зрительного нерва, сахарного диабета и его осложнений, аутизма, иммунодефицитных состояний и других патологий.
Организация лечения за границей
Если вы ищете подходящую клинику, где применяются инновационные методы лечения различных заболеваний, в том числе при помощи стволовых клеток, вы можете воспользоваться помощью специалистов Booking Health. Все что нужно сделать – подать заявку. В течение 24 часов мы подберем для вас лучшую лечебную программу за границей. После этого медицинский консультант свяжется с вами для уточнения запроса и согласования клиники для прохождения терапии.
В дальнейшем вы можете воспользоваться услугами компании BookingHealth по организации лечения за рубежом. Это позволит вам:
- Сэкономить до 70% от стоимости лечебной программы
- Получить страховку, которая покроет все незапланированные расходы на медицинские услуги (например, в случае развития осложнений, потребности в дополнительных диагностических процедурах и т.д.)
- Воспользоваться сервисными услугами (письменный и устный перевод, общение с администрацией клиники, помощь в оформлении визы)
Отправьте запрос, чтобы наш медицинский специалист связался с вами в течение ближайших нескольких часов.
Обратиться в Booking Health
Выбирайте лечение за рубежом и Вы, несомненно, получите отличный результат!
Trustpilot
Авторы:
Статья составлена под редакцией экспертов в области медицины, врачей-специалистов Доктор Надежда Иванисова и Доктор Валерия Кружилина. Для лечения состояний, о которых идет речь в статье, необходимо обратиться к врачу; информация в статье не предназначена для самолечения!
Источники:
National Center for Biotechnology
Healthline
Centers for Disease Control and Prevention
Читайте:
Почему Booking Health – Вопросы и ответы
Как не ошибиться в выборе клиники и специалиста
7 причин доверять рейтингу клиник на сайте Booking Health
Booking Health – Стандарты качества
Отправить запрос на лечение
Booking Health GmbH | Диагностика и лечение |
Учёные показали сходство репрограммированных и эмбриональных стволовых клеток
В научной работе, выполненной сотрудниками Института общей генетики, Федерального научного центра физико-химической медицины(ФНКЦ ФХМ), при участии сотрудников МФТИ, было доказано, что стволовые клетки, полученные из обычных клеток организма, отличаются от “эталонных” стволовых вовсе не в результате процесса репрограммирования. Результаты исследования опубликованы журналом Cell Cycle.
Результаты исследования опубликованы журналом Cell Cycle.
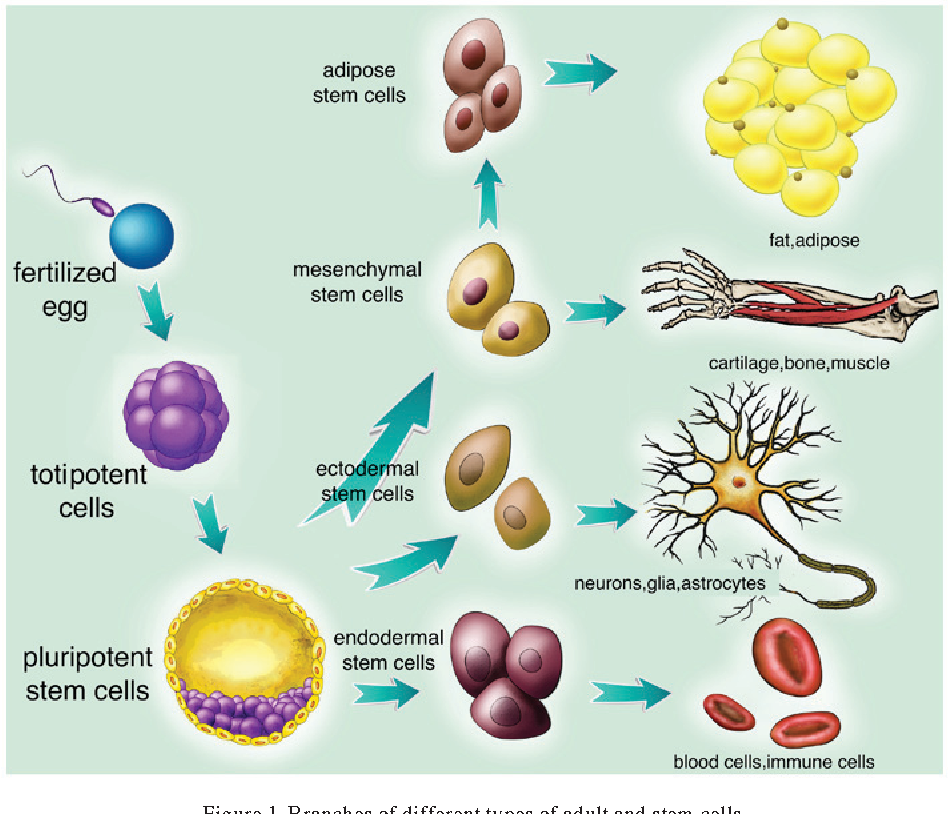
Стволовые клетки — это клетки, которые могут неограниченно делиться.Они имеют чёткую специализацию, но также могут превращаться в клетки других типов. Именно стволовые клетки обеспечивают восстановление тканей и органов, именно из них берутся новые клетки взамен утраченных (рис.1). Медики и учёные выделяют несколько типов стволовых клеток в зависимости от их универсальности. Те клетки, которые могут превратиться в любую иную клетку, называются плюрипотентными. Во взрослом организме плюрипотентных стволовых клеток нет, это состояние характерно только для клеток первых дней эмбрионального развития.
Рис 1. Особенности плюрипотентных стволовых клеток. Источник: пресс-служба МФТИ
Плюрипотентные клетки можно получить двумя способами. Первый — это взять их из ранних эмбрионов человека, невостребованных для процедуры ЭКО (экстракорпорального оплодотворения), поскольку тело эмбриона формируется из этих клеток.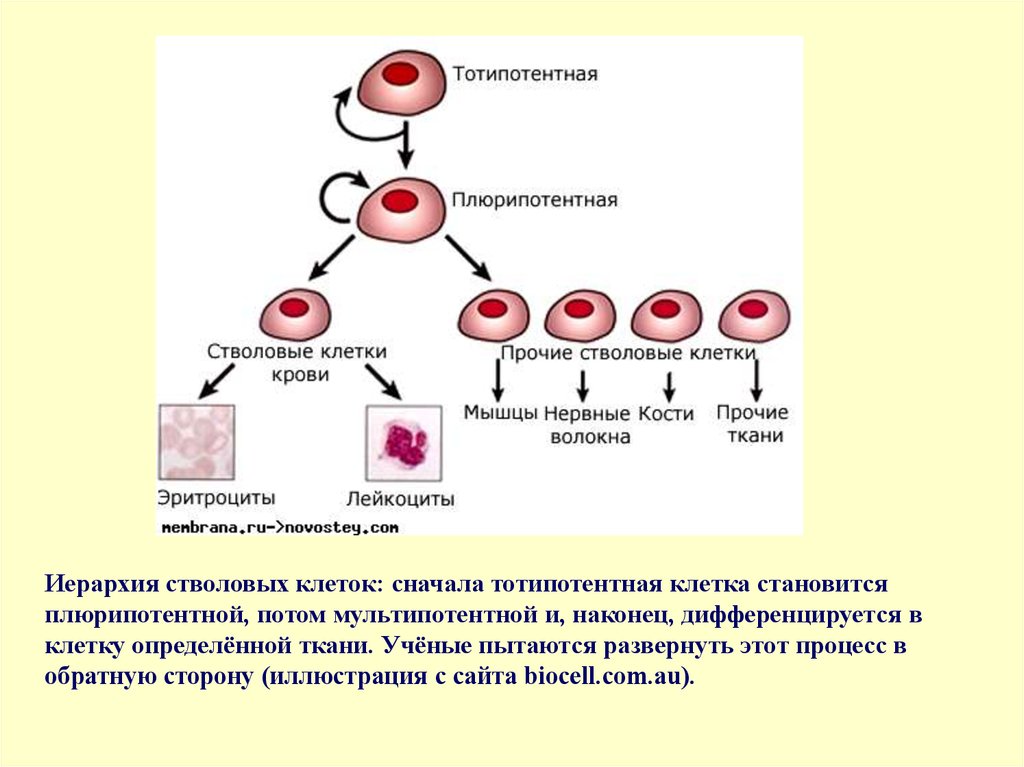 Этот способ имеет очевидные ограничения как этического, так и технического характера, поэтому исследователи с самого начала искали ему альтернативу: ей стало репрограммирование обычных клеток в стволовые.
Этот способ имеет очевидные ограничения как этического, так и технического характера, поэтому исследователи с самого начала искали ему альтернативу: ей стало репрограммирование обычных клеток в стволовые.
Репрограммирование — это серия операций, которая призвана “включить” те гены, что активны в стволовой клетке и “выключить” те, которые обеспечивают клеточную специализацию. Осуществляется репрограммирование методом внесения в клетку генов четырех белков, которые в норме очень важны при раннем эмбриональном развитии. За определение набора этих генов и генетическое репрограммирование японский исследователь Шинья Яманака получил в 2012 году Нобелевскую премию по медицине (рис 2).
Рис.2 Получение ИПСК (индуцированных плюрипотентных стволовых клеток )
Уникальные способности стволовых клеток к длительной пролиферации (размножению клеток) и к дифференцировке (превращению в другие виды клеток) делают их перспективным инструментом для клеточной терапии. Из стволовых клеток уже удавалось пересаживать пациентам клетки пигментного эпителия сетчатки глаза, и клетки спинного мозга, а в опытах на мышах стволовые клетки продемонстрировали способность восстанавливать утраченные зубы.
Из стволовых клеток уже удавалось пересаживать пациентам клетки пигментного эпителия сетчатки глаза, и клетки спинного мозга, а в опытах на мышах стволовые клетки продемонстрировали способность восстанавливать утраченные зубы.
Теоретически, стволовые клетки могут восстановить практически любой орган, поэтому неудивительно, что это направление активно развивают по всему миру. Понятен и интерес к репрограммированным, или, как ещё их называют, индуцированным плюрипотентным стволовым клеткам (ИПСК) — они не только избавляют от необходимости использовать эмбрионы, их можно получать непосредственно из клеток самих пациентов.
Проблема современной медицины стволовых клеток заключается в том, что степень схожести между репрограммированными стволовыми клетками и «золотым стандартом» плюрипотентности, то есть эмбриональными стволовыми клетками, до сих пор не ясна. Предыдущие исследования показали, что между ними есть серьезные различия — однако эти опыты были проведены на ограниченном количестве клеток различного происхождения.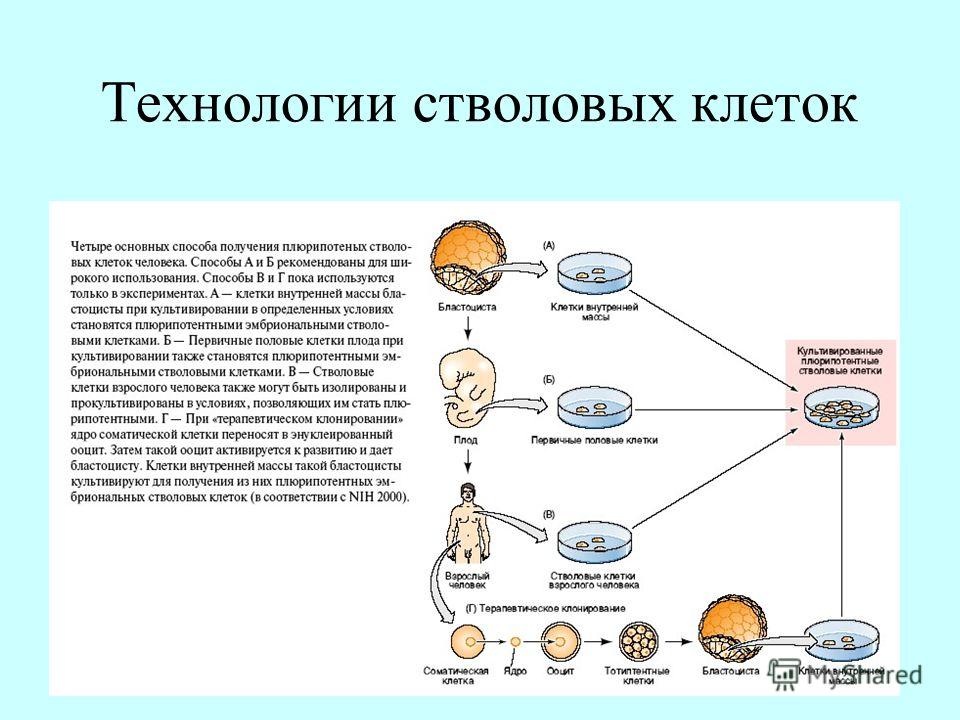 Исследователи решили сравнить между собой эмбриональные стволовые клетки, три разных типа полученных из них обычных клеток и три типа стволовых клеток, которые получились из тех клеток, что образовались из обычных путём перепрограммирования. Все эти клетки были изогенными — то есть содержали один и тот же набор генов. Транскрипция — процесс синтеза продукта (РНК), кодируемого фрагментом ДНК, то есть геном. Метилирование — химическая реакция с присоединением к какой-либо молекуле метильной группы, Ch4. Эпителий — слой клеток, формирующий поверхность органа. Вся информация о том, как синтезировать белки, хранится в ДНК клетки. Сравнение включало в себя анализ транскриптома, то есть перечисление всех закодированных в ДНК клетки и при этом активно синтезируемых продуктов. Кроме того, авторы новой публикации выявили то, какие участки ДНК метилированы: метилирование играет ключевую роль в задании “профессии” клетки.
Исследователи решили сравнить между собой эмбриональные стволовые клетки, три разных типа полученных из них обычных клеток и три типа стволовых клеток, которые получились из тех клеток, что образовались из обычных путём перепрограммирования. Все эти клетки были изогенными — то есть содержали один и тот же набор генов. Транскрипция — процесс синтеза продукта (РНК), кодируемого фрагментом ДНК, то есть геном. Метилирование — химическая реакция с присоединением к какой-либо молекуле метильной группы, Ch4. Эпителий — слой клеток, формирующий поверхность органа. Вся информация о том, как синтезировать белки, хранится в ДНК клетки. Сравнение включало в себя анализ транскриптома, то есть перечисление всех закодированных в ДНК клетки и при этом активно синтезируемых продуктов. Кроме того, авторы новой публикации выявили то, какие участки ДНК метилированы: метилирование играет ключевую роль в задании “профессии” клетки.
Детальное изучение изменений в тонком механизме регуляции активности генов привело исследователей как к выводу о сходстве эмбриональных клеток с репрограммированными, так и к перечню из 275 ключевых генов, активность которых позволяет корректно представить результаты репрограммирования.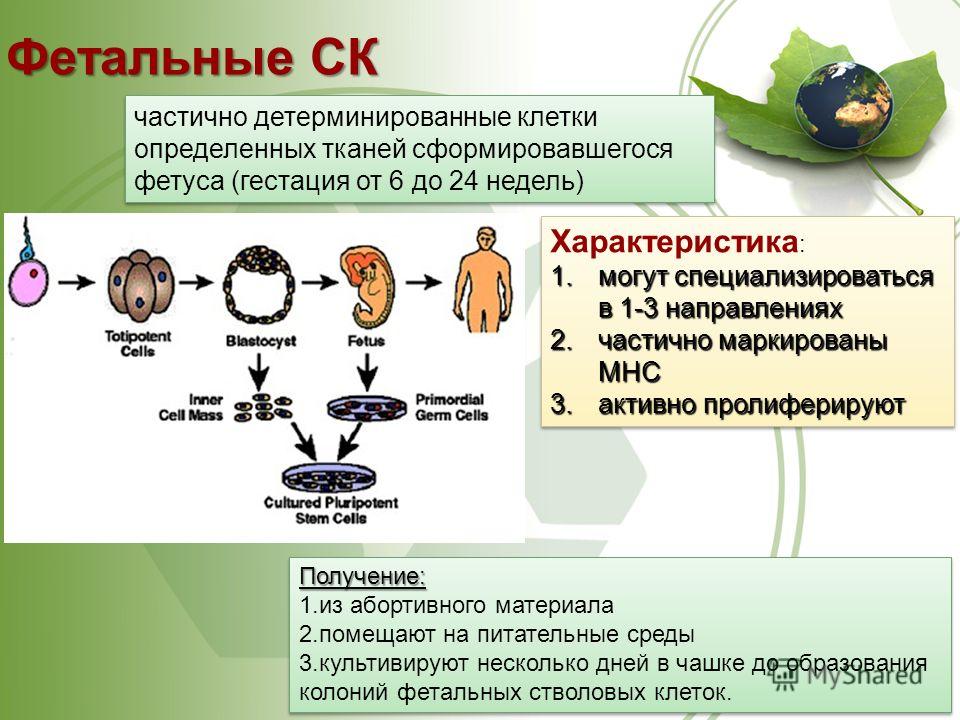
Наблюдавшиеся различия между разными клетками исследователи связали с воздействием случайных факторов. «В ходе исследования мы сформулировали концепцию наилучшей линии индуцированных плюрипотентных клеток: при наличии пяти клонов таких клеток можно с 95% вероятностью отобрать фактически неотличимый от «золотого стандарта»» — говорит Дмитрий Ищенко, аспирант МФТИ и научный сотрудник ФНКЦ ФХМ.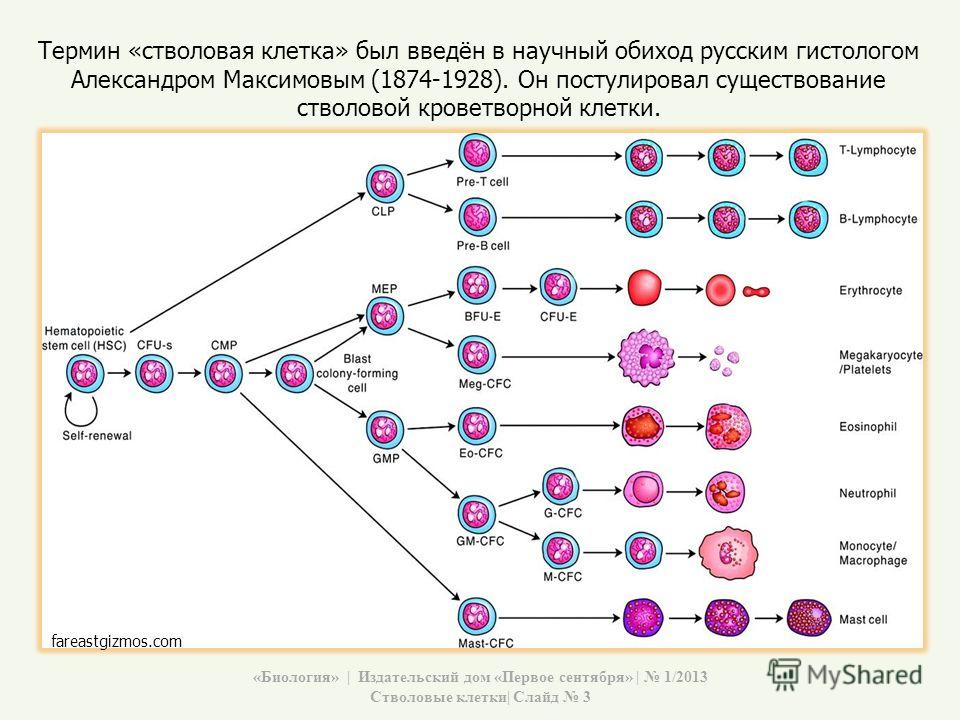
Под словом “клон” подразумеваются клетки, получившиеся при делении какой-то одной. Если сначала взять эмбриональную стволовую клетку, потом дать ей превратиться в пять разных специализированных, потом эти специализированные репрограммировать в стволовые и получить пять разных наборов (линий) клеток — в этом случае с вероятностью 95% хотя бы одна линия окажется такой же, как исходные эмбриональные клетки. На практике, конечно, никто не станет при наличии эмбриональных стволовых клеток превращать их сначала в нейроны или фибробласты, а затем снова перепрограммировать — это долго и дорого. Но такой опыт смоделировал ситуацию, когда клетки пациентов (они ведь когда-то получились именно из эмбриональных!) репрограммируют в индуцированные плюрипотентные для дальнейшего применения в медицинских целях. Новое исследование, хотя и не открывает немедленной возможности выращивать органы в пробирке, является важным шагом в этом направлении.
Кроме регенеративной медицины, понимание сходства и различия эмбриональных/индуцированных стволовых клеток важно и с теоретической точки зрения. Знания механизмов регуляции клеточного роста вкупе с тонкой настройкой клеточной специализации важны и для изучения развития организма, и, возможно, для исследования превращения обычных клеток в раковые.
Знания механизмов регуляции клеточного роста вкупе с тонкой настройкой клеточной специализации важны и для изучения развития организма, и, возможно, для исследования превращения обычных клеток в раковые.
Эмбриональные стволовые клетки – стволовые клетки и будущее регенеративной медицины
E Эмбриональные стволовые клетки (ЭСК) обнаруживаются во внутренней клеточной массе бластоцисты человека, ранней стадии развития эмбриона, начиная с 4 с по 7 день после оплодотворения. При нормальном эмбриональном развитии они исчезают после 7 дней и начинают формировать три слоя эмбриональной ткани. Однако ЭСК, выделенные из внутренней клеточной массы на стадии бластоцисты, можно культивировать в лаборатории, и при правильных условиях они будут размножаться бесконечно. ЭСК, растущие в этом недифференцированном состоянии, сохраняют способность дифференцироваться в клетки всех трех слоев эмбриональной ткани. Исследования с участием ЭСК человека находятся в центре этических дебатов об использовании и потенциале стволовых клеток в регенеративной медицине.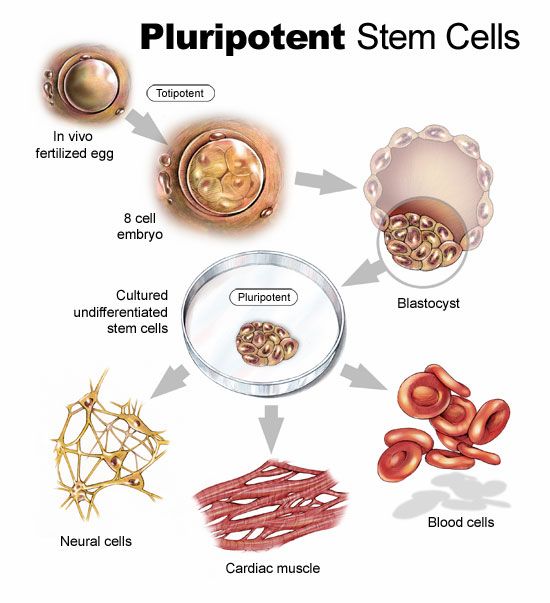 Эмбрионы, из которых выделяют ЭСК, при этом разрушаются.
Эмбрионы, из которых выделяют ЭСК, при этом разрушаются.
Несколько научных вопросов важны при рассмотрении потенциала стволовых клеток для использования в регенеративной медицине, а также возникающих политических и этических вопросов:
Какие свойства ЭСК перспективны для регенеративной медицины?
Какие прямые доказательства подтверждают эффективность использования ЭСК в регенеративной медицине?
Какие препятствия и риски связаны с использованием ЭСК в регенеративной медицине?
СВОЙСТВА ЭСК, ВАЖНЫЕ ДЛЯ РЕГЕНЕРАТИВНОЙ МЕДИЦИНЫ
ЭСК человека впервые были успешно выращены в лаборатории в 1998 г. (Thompson et al., 1998). В соответствующих условиях культивирования ЭСК продемонстрировали замечательную способность к непрерывному самообновлению, т. е. к продукции большего количества мультипотентных клеток, подобных им самим. Как было указано на семинаре Томасом Окармой и Роном Маккеем, было продемонстрировано, что линии ЭСК, созданные из одиночных клеток, размножаются в течение 300-400 циклов удвоения популяции.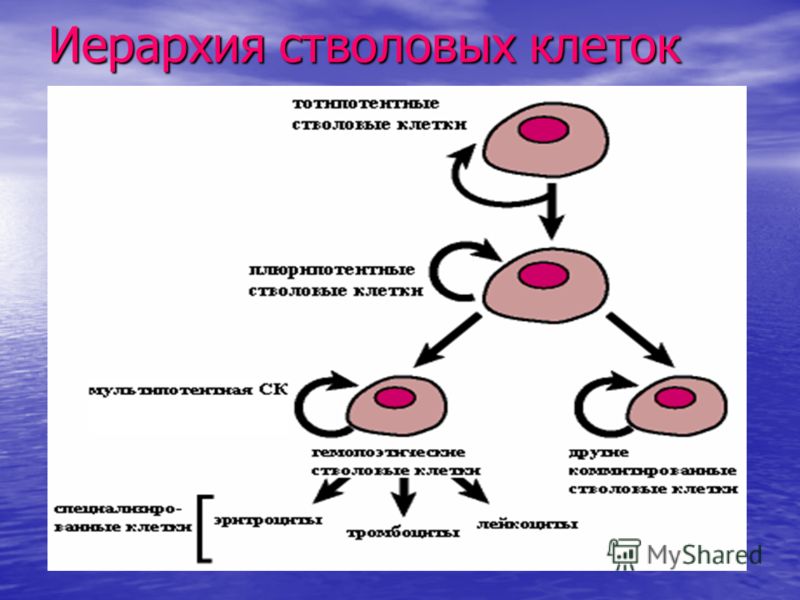 ЭСК человека, которые размножались более 2 лет, также демонстрируют стабильный и нормальный набор хромосом, в отличие от нестабильного и аномального набора клеточных линий эмбрионального рака, которые использовались в прошлом для изучения ранних стадий эмбрионального развития. Тщательный мониторинг стареющих линий ЭСК будет необходим для оценки значимости генетических изменений, которые, как ожидается, произойдут с течением времени.
ЭСК человека, которые размножались более 2 лет, также демонстрируют стабильный и нормальный набор хромосом, в отличие от нестабильного и аномального набора клеточных линий эмбрионального рака, которые использовались в прошлом для изучения ранних стадий эмбрионального развития. Тщательный мониторинг стареющих линий ЭСК будет необходим для оценки значимости генетических изменений, которые, как ожидается, произойдут с течением времени.
Поскольку ЭСК человека только недавно стали доступны для исследований, большая часть того, что известно об ЭСК, получено из исследований на мышах, которые, как отмечалось в главе 2, нельзя считать окончательными доказательствами возможностей клеток человека.
Тем не менее, ЭСК, полученные из мышиных бластоцист, изучались в течение 2 десятилетий и обеспечили критическую основу знаний о биологии и культивировании этих клеток (Torres, 1998; Wobus and Boheler, 1999). Активно исследуются факторы, которые позволяют мышиным ESC продолжать репликацию в лаборатории без дифференцировки, и методы запуска дифференцировки в различные типы клеток, которые проявляют нормальную функцию.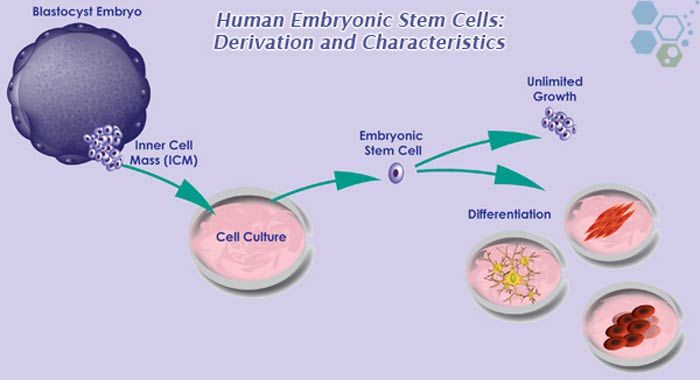 К типам клеток, полученных из культивируемых ЭСК мыши, относятся жировые клетки, различные клетки мозга и нервной системы, инсулинпродуцирующие клетки поджелудочной железы, костные клетки, гемопоэтические клетки, клетки желточного мешка, эндотелиальные клетки, примитивные эндодермальные клетки, клетки гладкой и поперечно-полосатой мускулатуры. клетки, в том числе кардиомиоциты – клетки сердечной мышцы (Odorico et al., 2001).
К типам клеток, полученных из культивируемых ЭСК мыши, относятся жировые клетки, различные клетки мозга и нервной системы, инсулинпродуцирующие клетки поджелудочной железы, костные клетки, гемопоэтические клетки, клетки желточного мешка, эндотелиальные клетки, примитивные эндодермальные клетки, клетки гладкой и поперечно-полосатой мускулатуры. клетки, в том числе кардиомиоциты – клетки сердечной мышцы (Odorico et al., 2001).
Опыт работы с ЭСК мыши дал ключ к разгадке методов культивирования ЭСК человека и их дифференцировки. ЭСК мыши будут пролиферировать в недифференцированном состоянии в присутствии биохимического вещества, называемого ингибирующим лейкемию фактором (LIF), но условия культивирования, необходимые для предотвращения дифференцировки ЭСК человека, включают их выращивание в чашках Петри на слое мышиных эмбриональных фибробластов (называемых «фидерные клетки») в среде, содержащей сыворотку крови коров. Питающие клетки инактивированы, поэтому они не делятся и не расширяются, но продуцируют факторы роста, поддерживающие ЭСК. Механизм того, как фидерные клетки поддерживают пролиферацию недифференцированных ЭСК, неизвестен. Такое культивирование in vitro представляет определенные теоретические опасности для использования стволовых клеток в регенеративной медицине, такие как распространение вирусов и других инфекционных агентов, обычно не встречающихся у людей. При извлечении из фидерных клеток и выращивании в суспензии (в жидкости) ЭСК человека образуют агрегированные шарики клеток, называемые «эмбриональными тельцами», которые, как сообщается, дают множество типов клеток, представляющих все три уровня развития эмбриональной ткани (Ицковиц). -Элдор и др., 2000; Рубинофф и др., 2000; Шульдинер и др., 2000). Доказательства дифференцировки в культуре включают обнаружение продуктов генов, связанных с разными типами клеток, а в некоторых случаях и по характерным формам, свойственным разным типам клеток. Клетки, полученные из эмбриональных тел человека, включают «ритмически сокращающиеся кардиомиоциты, пигментированные и непигментированные эпителиальные клетки и нервные клетки, демонстрирующие обильный рост аксонов и дендритов» (Odorico et al.
Механизм того, как фидерные клетки поддерживают пролиферацию недифференцированных ЭСК, неизвестен. Такое культивирование in vitro представляет определенные теоретические опасности для использования стволовых клеток в регенеративной медицине, такие как распространение вирусов и других инфекционных агентов, обычно не встречающихся у людей. При извлечении из фидерных клеток и выращивании в суспензии (в жидкости) ЭСК человека образуют агрегированные шарики клеток, называемые «эмбриональными тельцами», которые, как сообщается, дают множество типов клеток, представляющих все три уровня развития эмбриональной ткани (Ицковиц). -Элдор и др., 2000; Рубинофф и др., 2000; Шульдинер и др., 2000). Доказательства дифференцировки в культуре включают обнаружение продуктов генов, связанных с разными типами клеток, а в некоторых случаях и по характерным формам, свойственным разным типам клеток. Клетки, полученные из эмбриональных тел человека, включают «ритмически сокращающиеся кардиомиоциты, пигментированные и непигментированные эпителиальные клетки и нервные клетки, демонстрирующие обильный рост аксонов и дендритов» (Odorico et al.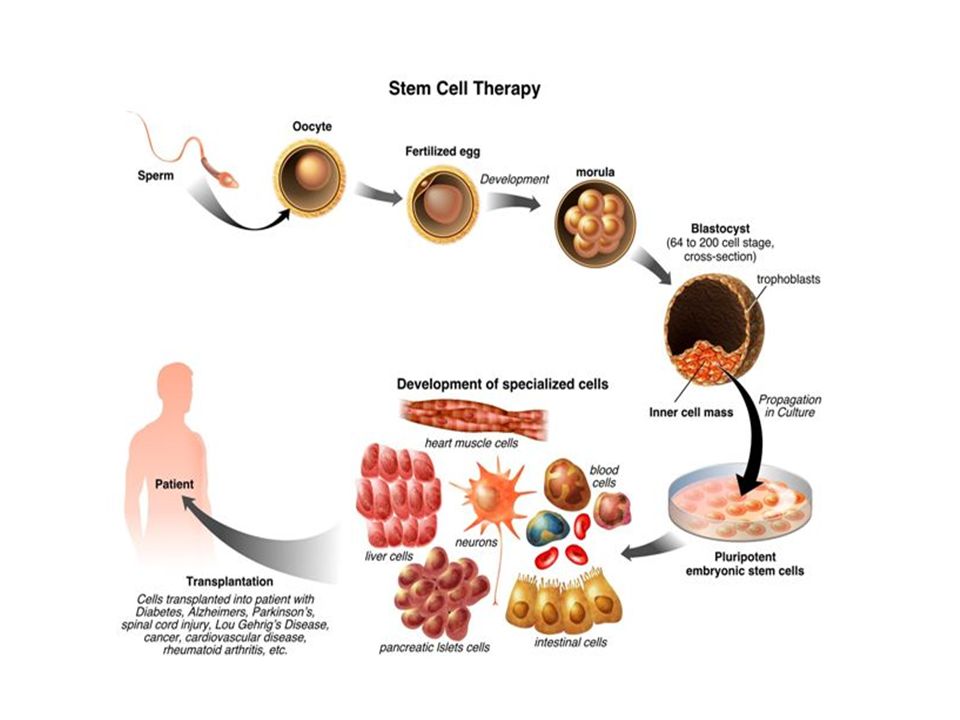 , 2001). В других экспериментах сообщалось, что клетки, происходящие из ЭСК человека, экспрессируют гены, связанные с функцией печени и поджелудочной железы (Schuldiner et al., 2000). Сообщалось, что ЭСК человека, выращенные в сокультуре со стромальными клетками костного мозга мыши, продуцируют колонии гемопоэтических предшественников человека и, в конечном счете, клетки крови (Kaufman et al., 19).99).
, 2001). В других экспериментах сообщалось, что клетки, происходящие из ЭСК человека, экспрессируют гены, связанные с функцией печени и поджелудочной железы (Schuldiner et al., 2000). Сообщалось, что ЭСК человека, выращенные в сокультуре со стромальными клетками костного мозга мыши, продуцируют колонии гемопоэтических предшественников человека и, в конечном счете, клетки крови (Kaufman et al., 19).99).
Дополнительные доказательства мультипотентной способности ЭСК человека основаны на исследованиях в условиях in vivo. ЭСК человека, введенные мышам, образуют тип доброкачественной опухоли, называемой тератомой, которая состоит из тканей всех трех эмбриональных слоев. Ткани, возникающие в опухоли, часто развиты, организованы и сложны и включают зубы, кишечник, волосяные фолликулы, кожу, эпителий, мышцы, кости, хрящи, легочную ткань и нервные клетки (Thompson et al., 1998). Эксперименты показали способность ЭСК производить различные ткани, но результаты также подчеркивают сложность биологической «программы» развития тканей, которая может разворачиваться в различных биологических средах.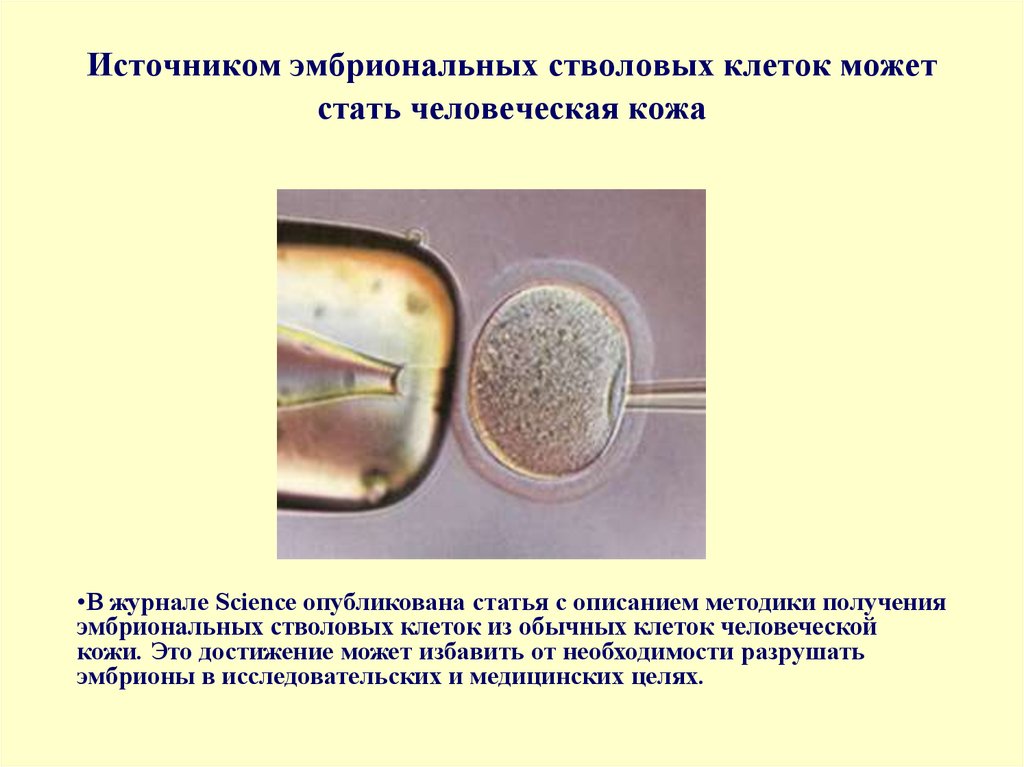 Эти результаты также подчеркивают аномальный, потенциально неопластический потенциал ЭСК при помещении в неестественную среду.
Эти результаты также подчеркивают аномальный, потенциально неопластический потенциал ЭСК при помещении в неестественную среду.
Остаются открытыми основные вопросы о генетических факторах или факторах окружающей среды в организме, которые контролируют судьбу ЭСК, и о важности различных факторов на различных стадиях клеточной дифференцировки. Однако даже на основании ограниченных данных возможность выращивать ЭСК человека in vitro и дифференцировать их в лаборатории делает их важным и уникальным инструментом для проведения фундаментальных исследований, имеющих решающее значение для основы будущих регенеративных технологий. терапии. Например, удалось создать линию мышиных ЭСК, которые генерируют предшественники нервных клеток (Li et al., 19).98). Исследования включения и выключения генов по мере того, как клетки начинают дифференцироваться, которые уже проводятся с ЭСК, позволят лучше понять генетический контроль, важный для дифференцировки тканей (Duncan et al., 1998). Исследования ЭСК in vitro также дают возможность изучить роль биохимических веществ, продуцируемых в нормальной клеточной среде, которые индуцируют дифференцировку стволовых клеток, миграцию в места, требующие репарации, и ассимиляцию в тканях (Schuldiner et al. , 2000).
, 2000).
ДОКАЗАТЕЛЬСТВА, ПОДТВЕРЖДАЮЩИЕ ПОТЕНЦИАЛ ЭСКС ДЛЯ ИСПОЛЬЗОВАНИЯ В РЕГЕНЕРАТИВНОЙ МЕДИЦИНЕ
На семинаре Джеймс Томсон и Томас Окарма предположили, что когда-нибудь человеческие ЭСК станут потенциально неограниченным источником клеток, дифференцированных in vitro , для трансплантационной терапии, затрагивающей печень , нервной системы и поджелудочной железы. Ирвинг Вайсман упомянул о возможном использовании ЭСК для повышения эффективности трансплантации целых органов. Если бы ГСК, полученные из ЭСК человека, можно было бы успешно трансплантировать в систему крови реципиента трансплантата (с помощью иммунодепрессантов), любая дополнительная ткань имплантата (скажем, почка или поджелудочная железа), полученная с использованием тех же ЭСК, теоретически не была бы отторгнута организмом. реципиента, потому что иммунные клетки, продуцируемые в крови реципиента ГСК, будут воспринимать ткань имплантата как «свою».
Но до этого еще далеко, как заметил Маркус Громпе, поскольку еще никто не продемонстрировал восстановление функции органа in vivo ни у людей, ни у экспериментальных животных клетками, полученными из ЭСК человека. Более того, ЭСК в тканевой культуре дают смесь всех типов клеток одновременно, и биохимические, тканевые и молекулярно-биологические методы контроля и ограничения дифференцировки требуют дальнейшего изучения.
Более того, ЭСК в тканевой культуре дают смесь всех типов клеток одновременно, и биохимические, тканевые и молекулярно-биологические методы контроля и ограничения дифференцировки требуют дальнейшего изучения.
Поскольку ЭСК человека стали доступны для исследований только недавно, а государственное финансирование таких исследований было ограниченным, исследования того, насколько хорошо ЭСК или их дифференцированные ткани выполняют физиологические функции, в основном проводились на моделях мышей. Рон Маккей описал прогресс, достигнутый в стимуляции дифференцировки ЭСК человека in vitro в клетки, продуцирующие инсулин, которые могут быть полезны при лечении диабета, но он также отметил, что уже были проведены исследования с аналогичными клетками мыши, трансплантированными мышам, страдающим диабетом, и что частичное наблюдалось восстановление регуляции инсулина (Lumelsky et al., 2001). Другие исследования показали, что ЭСК мыши можно успешно трансплантировать грызунам с симптомами болезни Паркинсона и частично облегчить эти симптомы (Studer et al.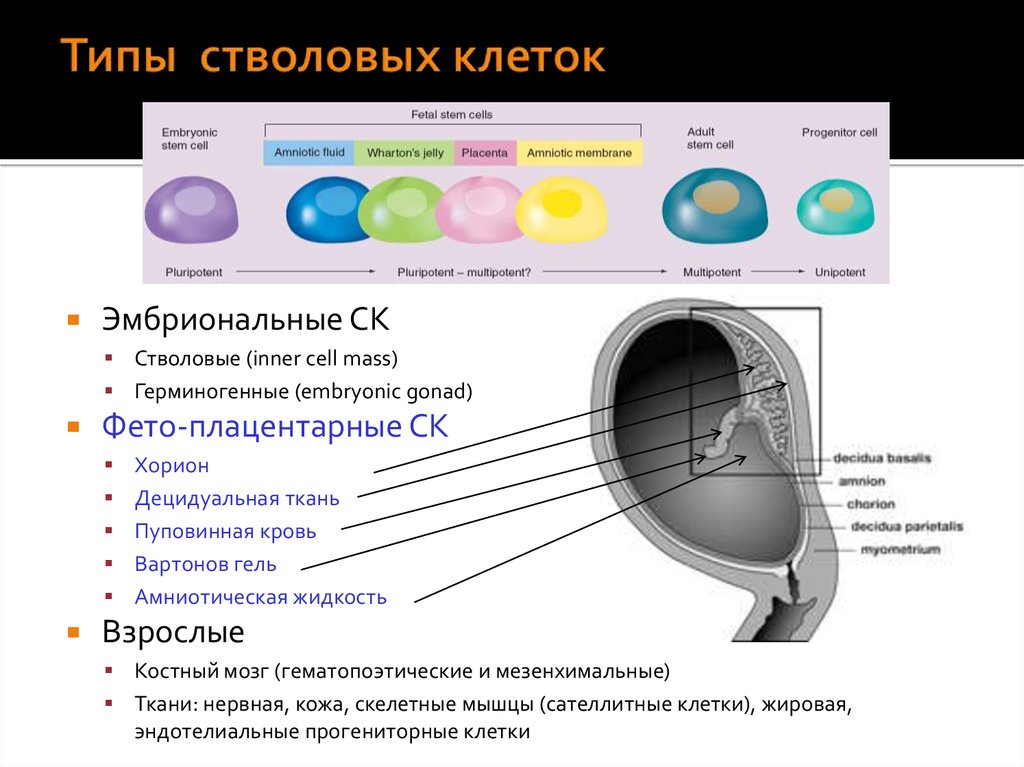 , 19).98). Сходным образом исследования предполагают, что ЭСК мышей можно трансплантировать животным с повреждениями спинного мозга и частично восстановить нервную функцию (McDonald et al., 1999).
, 19).98). Сходным образом исследования предполагают, что ЭСК мышей можно трансплантировать животным с повреждениями спинного мозга и частично восстановить нервную функцию (McDonald et al., 1999).
Эти исследования обещают, но не являются окончательными доказательствами того, что аналогичные методы лечения могут быть эффективными для людей. Человеческие ЭСК необходимо будет протестировать на моделях приматов, таких как модели болезни Паркинсона и сахарного диабета у макак-резусов. Необходимо разработать методы трансплантации ЭСК, а также способы установления того, правильно ли развиваются и функционируют клетки после трансплантации. В некоторых случаях будет важно убедиться, что трансплантированные клетки или ткани включены и правильно расположены относительно существующих тканей, например, в сердце и нервной ткани; трехмерные межклеточные взаимодействия будут играть важную роль в функционировании органа. Другие клетки, такие как островковые клетки поджелудочной железы или гемопоэтические клетки, потребуют менее сложного включения.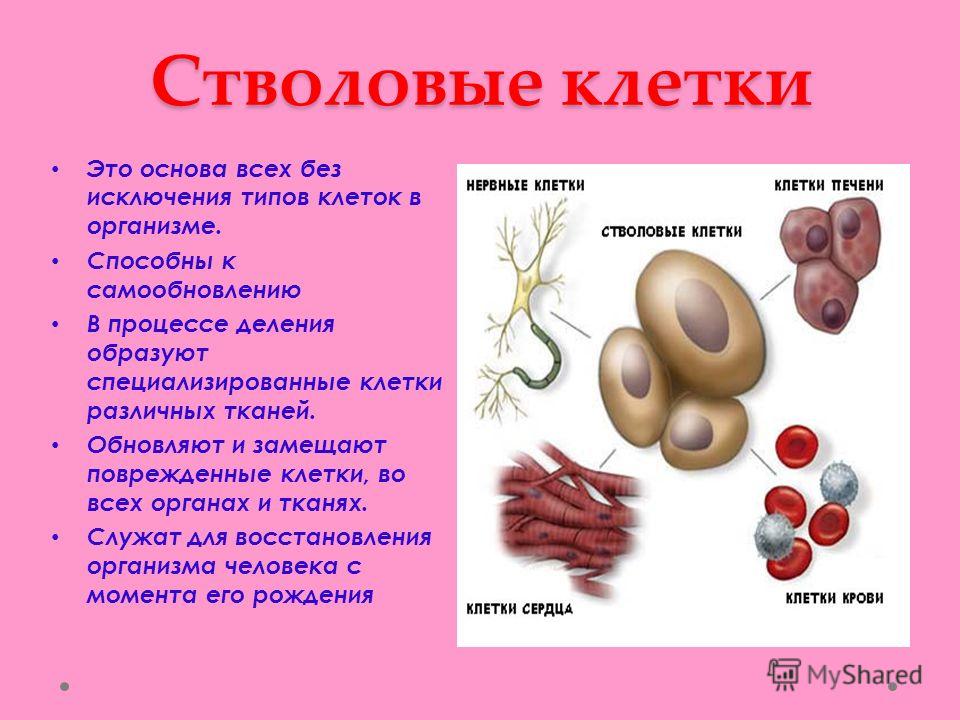
Кроме того, крупномасштабное размножение ЭСК человека в культуре потребует, чтобы их можно было выращивать без фидерных клеток (Odorico et al., 2001). Необходимы исследования, чтобы выяснить механизмы подавления дифференцировки фидерными клетками и найти им альтернативы, в то же время исключив возможность переноса вируса животных из фидерных клеток в ЭСК.
Наконец, ранее было отмечено, что хромосомы ЭСК человека оказались стабильными в культуре тканей. Однако это не означает, что линии ЭСК не будут подвержены случайным мутациям, которые затрагивают все клеточные линии по мере их старения. В клетках человека и других животных при каждом делении клетки происходит примерно одна мутация. Таким образом, можно ожидать, что клетка, которая делилась 200 раз в культуре, содержит около 200 различных мутаций (Kunkel and Bebeneck, 2000). До сих пор не было опубликовано исследований об изменениях, которые могли произойти в существующих линиях стволовых клеток. Тщательный мониторинг целостности существующих клеточных линий необходим для понимания влияния долгосрочного культивирования, и в будущем может потребоваться разработка новых линий стволовых клеток.
Препятствия и риски, связанные с использованием ЭСК
В дополнение к демонстрации функциональной эффективности трансплантатов ЭСК необходимо выявить и свести к минимуму или устранить риски, которые могут представлять ЭСК. Двумя идентифицируемыми рисками являются образование опухоли и иммунное отторжение. Как отмечалось ранее, ЭСК человека, введенные мышам, могут вызывать доброкачественную опухоль, состоящую из различных тканей; считается, что этот ответ связан с мультипотентностью недифференцированных клеток в среде in vivo. Однако, в небольшом количестве краткосрочных исследований на мышах, ЭСК человека, которым позволили начать процесс дифференцировки перед трансплантацией, не привели к значительному образованию опухоли (Odorico et al., 2001). Очевидно, что это критическая проблема для понимания и контроля.
Поэтому пока рано говорить о целесообразности использования человеческих ЭСК непосредственно в регенеративной медицине. Очевидно, необходимо выяснить, как организм контролирует дифференцировку стволовых клеток, и это еще предстоит надежно воспроизвести in vitro.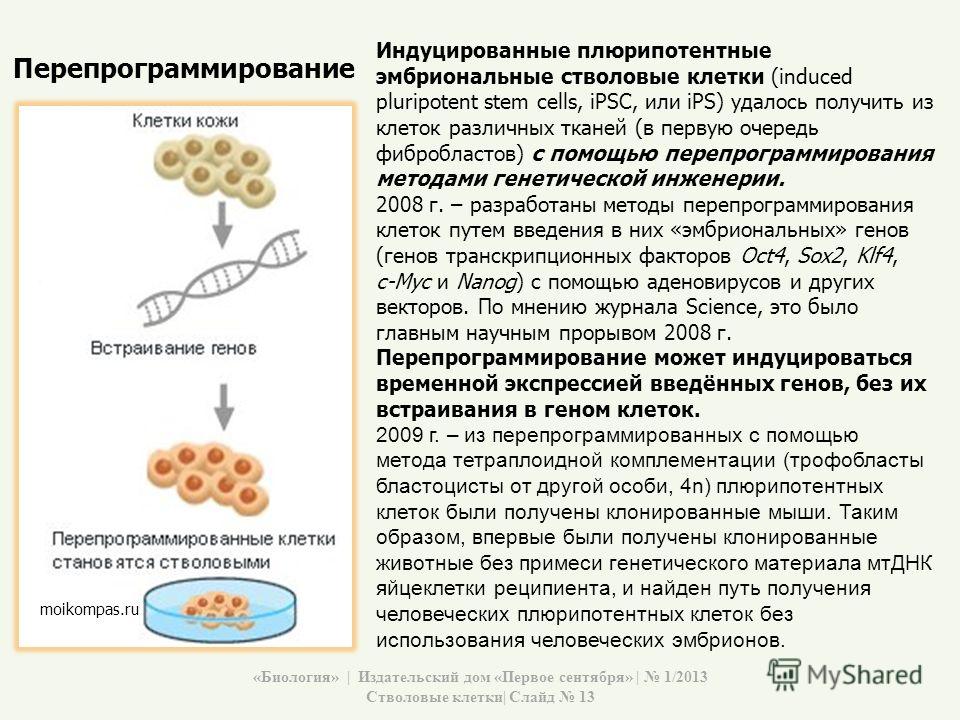 Кроме того, недостаточно изучено поведение ЭСК, имплантированных в конкретный орган. Когда-нибудь можно будет добавить факторы роста к трансплантату, чтобы стимулировать производство определенного типа клеток или нескольких типов клеток. «Ткани-индукторы», которые взаимодействуют со стволовыми клетками, могут быть котрансплантированы с ЭСК для достижения аналогичного результата. Эти возможности все еще находятся в стадии экспериментального исследования.
Кроме того, недостаточно изучено поведение ЭСК, имплантированных в конкретный орган. Когда-нибудь можно будет добавить факторы роста к трансплантату, чтобы стимулировать производство определенного типа клеток или нескольких типов клеток. «Ткани-индукторы», которые взаимодействуют со стволовыми клетками, могут быть котрансплантированы с ЭСК для достижения аналогичного результата. Эти возможности все еще находятся в стадии экспериментального исследования.
С другой стороны, возможные проблемы, связанные с трансплантацией ЭСК, являются общими для всех трансплантаций, например, риск инфицирования и риск отторжения ткани. Как обсуждалось в главе 2, отторжение является серьезным препятствием для успешной трансплантации стволовых клеток и полученных из них тканей. Было высказано предположение, что ЭСК вызывают меньшую иммунную реакцию, чем трансплантация целого органа, но неясно, будет ли это верно для регенерированных тканей, полученных из ЭСК. Некоторые типы клеток (такие как дендритные клетки, клетки иммунной системы и эндотелиальные клетки сосудов) несут больше антигенов гистосовместимости, вызывающих иммунные реакции, чем другие клетки. Эти типы присутствуют в тканях целых органов; они соединяют орган с кровотоком и нервной системой. Однако ткань, полученная in vitro из ЭСК, такая как ткань печени, не будет содержать таких клеток и, следовательно, теоретически вызовет более мягкий иммунный ответ; это предполагает, что будут доступны методы контроля дифференцировки ЭСК. Кроме того, клетки печени, вероятно, не будут лишены всех поверхностных антигенов, и, таким образом, при отсутствии других методов снижения отторжения трансплантата все равно придется использовать иммунодепрессанты с сопутствующими рисками инфекции и токсичности.
Эти типы присутствуют в тканях целых органов; они соединяют орган с кровотоком и нервной системой. Однако ткань, полученная in vitro из ЭСК, такая как ткань печени, не будет содержать таких клеток и, следовательно, теоретически вызовет более мягкий иммунный ответ; это предполагает, что будут доступны методы контроля дифференцировки ЭСК. Кроме того, клетки печени, вероятно, не будут лишены всех поверхностных антигенов, и, таким образом, при отсутствии других методов снижения отторжения трансплантата все равно придется использовать иммунодепрессанты с сопутствующими рисками инфекции и токсичности.
Хотя это трудно себе представить, создание очень большого количества линий ЭСК может быть одним из способов получения разнообразия клеток, что теоретически может увеличить шансы на совпадение антигенов гистосовместимости реципиента трансплантата. Также было высказано предположение, что ЭСК можно сделать менее реактивными, используя генную инженерию для устранения или введения на них присутствия поверхностных антигенов (Odorico, 2001). Точное генетическое совпадение между реципиентом трансплантата и тканью, полученной из ЭСК, также теоретически может быть достигнуто с помощью переноса ядер соматических клеток для создания гистосовместимых ЭСК (14). Клетки, созданные с помощью этой техники, преодолеют проблему иммунного отторжения. Однако трансплантировать такие клетки человеку с генетически обусловленным заболеванием может быть нецелесообразно, поскольку клетки будут нести одинаковую генетическую информацию. В любом случае, понимание того, как предотвратить отторжение трансплантированных клеток, имеет основополагающее значение для того, чтобы они стали полезными для регенеративной медицины, и представляет собой одну из самых больших проблем для исследований в этой области.
Точное генетическое совпадение между реципиентом трансплантата и тканью, полученной из ЭСК, также теоретически может быть достигнуто с помощью переноса ядер соматических клеток для создания гистосовместимых ЭСК (14). Клетки, созданные с помощью этой техники, преодолеют проблему иммунного отторжения. Однако трансплантировать такие клетки человеку с генетически обусловленным заболеванием может быть нецелесообразно, поскольку клетки будут нести одинаковую генетическую информацию. В любом случае, понимание того, как предотвратить отторжение трансплантированных клеток, имеет основополагающее значение для того, чтобы они стали полезными для регенеративной медицины, и представляет собой одну из самых больших проблем для исследований в этой области.
РИСУНОК 4
Пересадка ядер соматических клеток (SCNT)
Приобретение эмбриональных стволовых клеток | AcceGen
Главная > Продукция > Эмбриональные стволовые (ЭС) клетки >
ЭС клетки человека
ЭС клетки животных
Эмбриональные стволовые клетки представляют собой тип клеток, выделенных из ранних эмбрионов или примитивных гонад.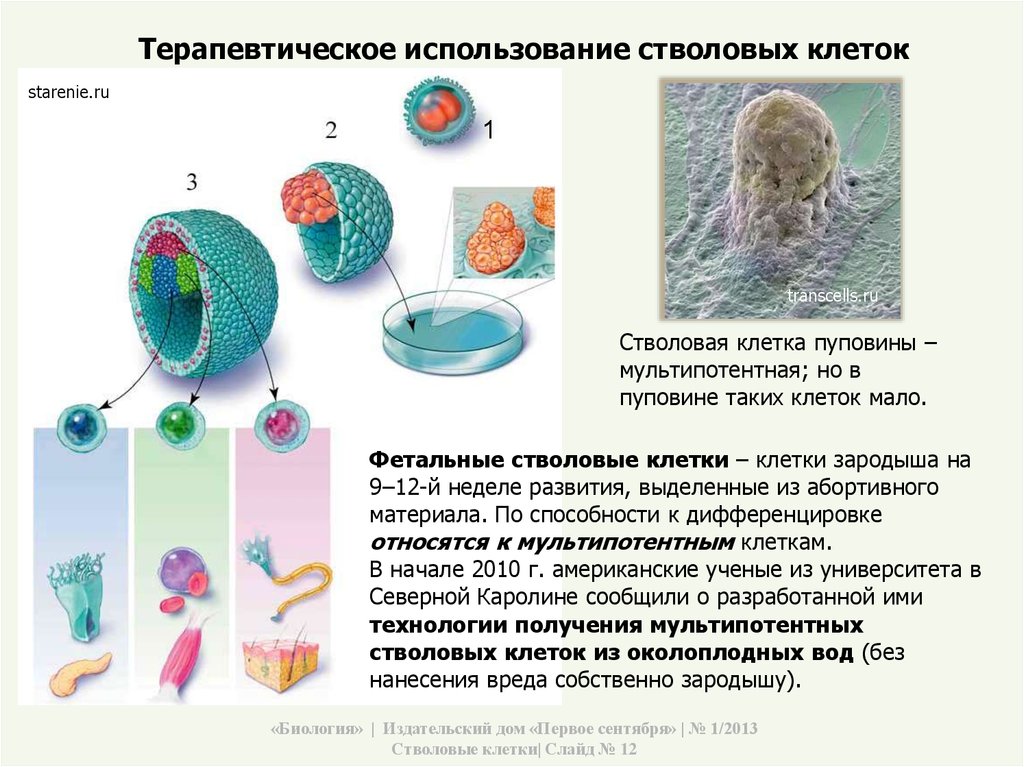
AcceGen Эмбриональные стволовые клетки человека и эмбриональные стволовые клетки животных обладают хорошей тотипотентностью, они хорошо сохраняются при недифференцированном переходе.
Искать в разделе Эмбриональные стволовые (ЭС) клетки
Кат. № № | Имя | Описание | Цена |
|---|---|---|---|
ABC-SC0144 | Эмбриональная стволовая клетка мыши HighQC™, полученная из мыши C57BL/6N | Эмбриональные стволовые клетки мыши C57BL/6N из бластоцист; Доступны замороженные флаконы и клетки с покрытием. C…подробнее | +запрос |
ABC-SC0143 | Эмбриональная стволовая клетка мыши HighQC™, из мыши 129/S6 | Эмбриональная стволовая клетка мыши 129/S6 от самца, линия мышей 129/S6/SvEv; Замороженные флаконы и клетки с покрытием.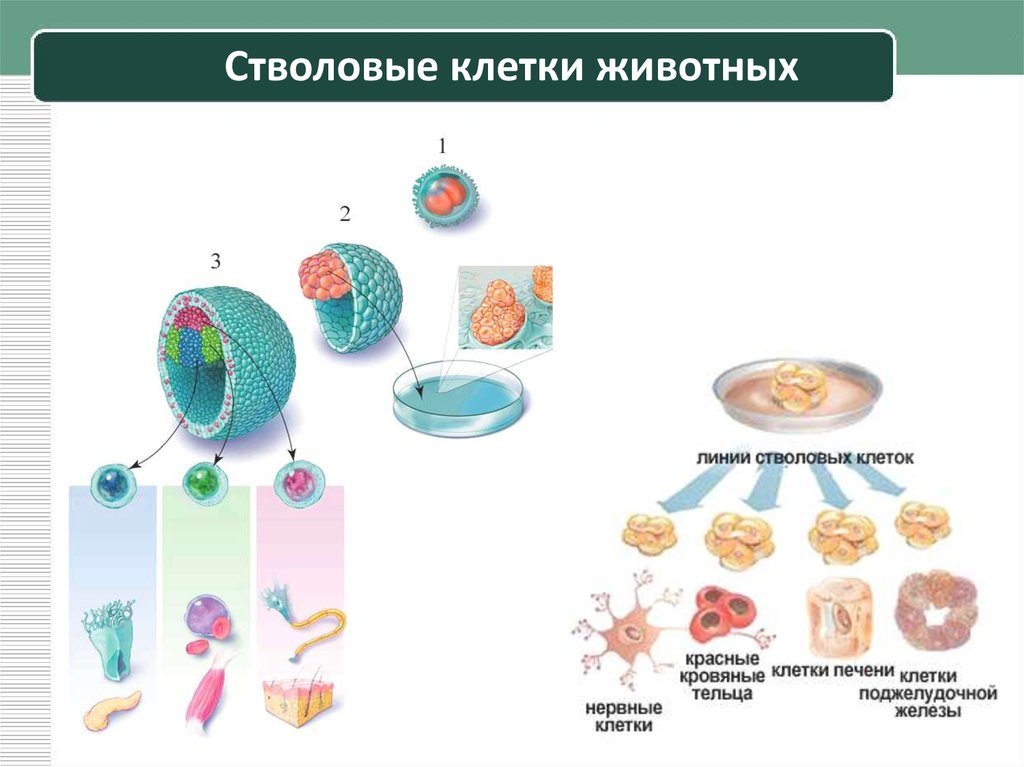 ..подробнее ..подробнее | +запрос |
ABC-SC2117 | HighQC™ CGR8 | Компетентная клеточная линия зародышевой линии CGR8 была получена из внутренней клеточной массы 3,5-дневного самца…подробнее | +запрос |
ABC-SC2114 | HighQC™ HES-3 | ЭС человека;здоровый;женщина
. ..более ..более | +запрос |
ABC-SC2067 | HighQC™ MESC-трансгенная мышь ES | ТРАНСГЕННАЯ МЫШЬ ES; Подколлекция: Животные Коллекция стволовых клеток; Затронуто: нет данных; Клетки только …подробнее | +запрос |
АБК-СК0121Т | Эмбриональные фибробласты крыс HighQC™, полученные из IPSC | Крысиные эмбриональные фибробласты (REF) используются для поддержки роста плюрипотентных стволовых клеток крысы и человека. ..подробнее ..подробнее | +запрос |
АБК-СК0120Т | Эмбриональные фибробласты мышей HighQC™, полученные из IPSC | Эмбриональные фибробласты мыши (MEF) — это высококачественные фидерные клетки, используемые для поддержки роста и размножения. | +запрос |
АБК-SC0119T | Эмбриональная стволовая клетка HighQC™ UMB6JD7 | Эмбриональные стволовые клетки UMB6JD7 были получены из внутренней клеточной массы бластоцисты мышей C57BL/6J и могут . ..подробнее ..подробнее | +запрос |
АБК-СК0118Т | Эмбриональная стволовая клетка HighQC™ Pat5 | Эмбриональные стволовые клетки Pat5 были получены из эмбрионов мыши 129X1/SvJ и могут быть использованы для введения…больше | +запрос |
АБК-СК0111Т | Штамм HighQC™ C57BL/6 Эмбриональная стволовая клетка мыши | Получен из внутренней клеточной массы бластоцисты мыши штамма C57BL/6 (через 3,5 дня после полового акта) и. ..подробнее ..подробнее | +запрос |
АБК-СК0110Т | Эмбриональная стволовая клетка мыши HighQC™ Strain 129 | Получен из внутренней клеточной массы бластоцисты мыши штамма 129 (через 3,5 дня после полового акта) и культивирован…подробнее | +запрос |
АБК-СК0103Т | Нокаутные мышиные эмбриональные фибробласты HighQC™ Nox2/Gp-91Phox | Мышиные эмбриональные фибробласты от AcceGen выделяют из тканей лабораторных мышей, свободных от патогенов.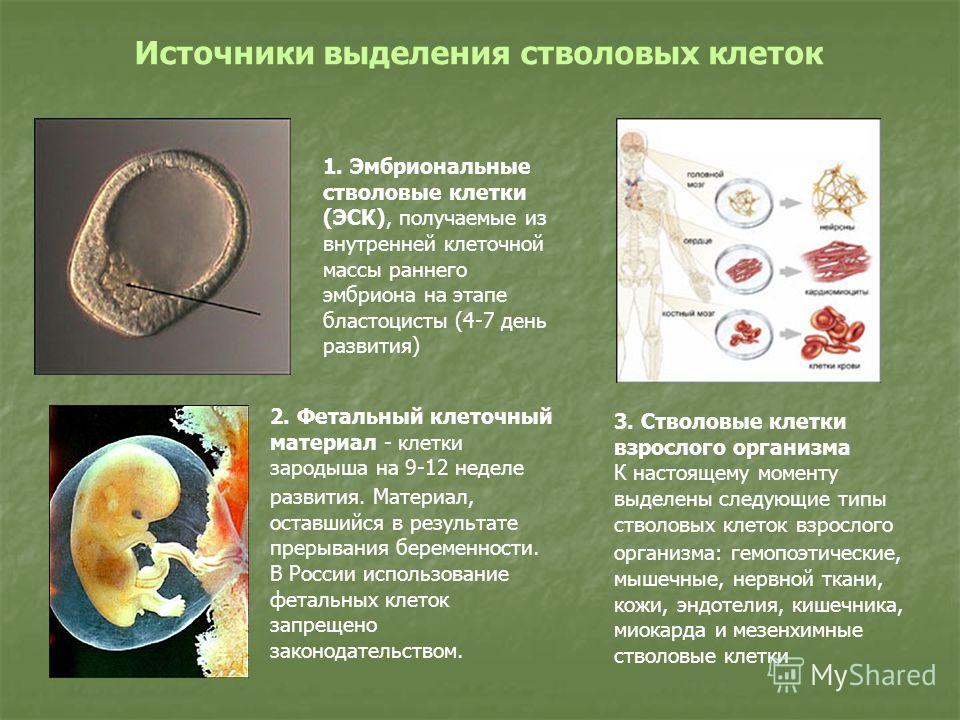 …более …более | +запрос |
АБК-СК0102Т | Нокаутные эмбриональные фибробласты мышей HighQC™ INOS | Мышиные эмбриональные фибробласты от AcceGen выделяют из тканей лабораторных мышей, свободных от патогенов. …более | +запрос |
АБК-СК0101Т | Эмбриональные фибробласты мышей HighQC™ C57BL/6 | Эмбриональные фибробласты мыши C57BL/6 от AcceGen выделены из ткани свободной от патогенов лаборатории. ..подробнее ..подробнее | +запрос |
ABC-SC0283 | Эмбриональные стволовые клетки человека HighQC™ от здорового донора | Эмбриональные стволовые клетки; Доступны замороженные флаконы и клетки с покрытием. Ячейки гарантируются только с пур…подробнее | +запрос |
ABC-SC0106 | Эмбриональная гемопоэтическая стволовая клетка человека HighQC™ | Эмбриональные гемопоэтические стволовые клетки человека; Доступны замороженные флаконы и клетки с покрытием.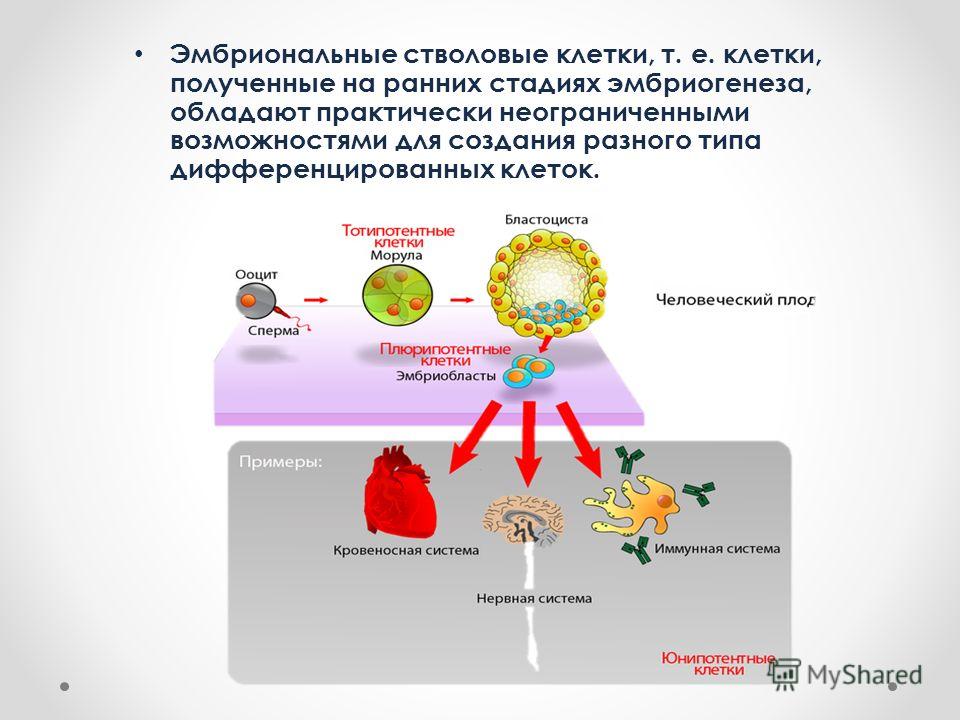 Клетки только… больше Клетки только… больше | +запрос |
ABC-SC0105 | Эмбриональные стволовые клетки человека HighQC™, полученные из морулы | Стволовые клетки, полученные на стадии эмбриональной морулы человека; Доступны замороженные флаконы и клетки с покрытием. Клетки а…подробнее | +запрос |
ABC-SC0104 | Эмбриональные стволовые клетки человека HighQC™ | Эмбриональная стволовая клетка человека; Доступны замороженные флаконы и клетки с покрытием. |
