Содержание
Частота встречаемости экстрагенитальной патологии у беременных женщин :: ТРУДНЫЙ ПАЦИЕНТ
М.Г.Ногаева, С.А.Тулеутаева
Казахский национальный медицинский университет им. С.Д.Асфендиярова кафедра амбулаторно-поликлинической терапии (Городская поликлиника №5), Алматы, Республика Казахстан
По данным нашего исследования, в условиях реальной клинической практики, в пределах одного из крупных районов города Алматы (Казахстан) выявлено, что практически у каждой беременной женщины диагностируется патология внутренних органов, со значительным преобладанием железодефицитной анемии и заболеваний желудочно-кишечного тракта, со значительным прогрессированием во втором триместре беременности. На уровне первичной медико-санитарной помощи получен положительный эффект от своевременной терапии беременных женщин с экстрагенитальной патологией (ЭГП). Немаловажное значение в лечении имеет охранительный режим и коррекция питания c применением препаратов растительного происхождения, подобранным индивидуально для каждой беременной. Раннее обращение беременной в женскую консультацию, способствует резкому снижению ЭГП и предотвращению всевозможных осложнений у плода.
Раннее обращение беременной в женскую консультацию, способствует резкому снижению ЭГП и предотвращению всевозможных осложнений у плода.
Ключевые слова: экстрагенитальная патология, железодефицитная анемия, беременность.
Frequency of occurrence of extragenital pathology in pregnancy
M.G.Nogaeva, S.A.Tuleutaeva
National Kazakh Medical University named by S.D.Asfendiyarov, Almaty, Republic of Kazakhstan
In real clinical practice within one of the biggest districts of Almaty (Kazakhstan) almost in every pregnant women pathology of internal organs was revealed. In most cases it was iron-deficiency anemia and gastrointestinal disturbance that markedly worsened during the second trimester. Timely therapy of extragenital pathology out of hospital was successful. Protective regimen and correction of nutrition had a considerable value. Individual selection of vegetative medications was useful. Early observation in antenatal clinic promote marked decrease of extragenital pathology and prevention of fetal complications.
Key words: extragenital pathology, iron-deficiency anemia, pregnancy.
Сведения об авторах:
Ногаева Марал Газизовна – к.м.н. ассистент кафедры амбулаторно-поликлинической терапии Казахского национального медицинского университета им. С.Д. Асфендиярова
Тулеутаева Светлана Александровна – ассистент кафедры амбулаторно-поликлинической терапии Казахского национального медицинского университета им. С.Д. Асфендиярова
Адрес для корреспонденции: [email protected]
На сегодняшний день в Казахстане индекс здоровья беременных женщин не превышает 30% (Б.И.Абдыкалыкова, 2009 г.). По данным российских исследований, в 40% случаях все женщины вынашивают беременность без осложнений, то есть без токсикозов и без экстрагенитальных патологий (ЭГП). Углубленный анализ течения беременности позволяет утверждать, что без осложнений протекает беременность только в 20% и наличия ЭГП – в 30-40% случаев. Угроза прерывания беременности в 12% несомненно влияет на внутриутробное развитие плода и его дальнейшее развитие. Но следует помнить и о наследственной детерминации ряда заболеваний, так как сегодня 60% всех заболеваний считаются наследственно детерминированными (А.Л.Верткин, 2010).
Но следует помнить и о наследственной детерминации ряда заболеваний, так как сегодня 60% всех заболеваний считаются наследственно детерминированными (А.Л.Верткин, 2010).
На фоне снижения рождаемости проблемы ведения беременности у женщин с ЭГП приобретают актуальное значение и остаются, по-прежнему, одной из важнейших проблем. Среди беременных, наряду с железодефицитной анемией (ЖДА), одними из самых распространенных являются заболевания сердечно-сосудистой системы (ССС), желудочно-кишечного тракта (ЖКТ), эндокринной, мочеполовой и дыхательной системы. По данным Всемирной организации здравоохранения (ВОЗ), отмечается возрастание частоты возникновения ЭГП у беременных на 28,3%. Во многом это объясняется увеличением за последние 5 лет общей заболеваемости взрослого населения [1].
В подавляющем большинстве случаев во время беременности течение уже имеющихся хронических заболеваний ухудшается и в дальнейшем прогрессирует. Это связано, во-первых, с иммунной перестройкой реактивности женского организма и депрессией иммунной реактивности. В связи с этим активизируются воспалительные заболевания внутренних органов. Во-вторых, во время беременности меняется эндокринная регуляция, что приводит к ухудшению течения артериальной гипертензии, заболеваниям щитовидной железы и надпочечников. В-третьих, во время беременности увеличивается потребление железа, что приводит к появлению или усугублению анемий. ЖДА страдают почти 65% беременных (Н.М.Касабулатов, 2010). У 14-32% беременных женщин ЭГП являются причиной осложненного течения беременности и родов [2].
В связи с этим активизируются воспалительные заболевания внутренних органов. Во-вторых, во время беременности меняется эндокринная регуляция, что приводит к ухудшению течения артериальной гипертензии, заболеваниям щитовидной железы и надпочечников. В-третьих, во время беременности увеличивается потребление железа, что приводит к появлению или усугублению анемий. ЖДА страдают почти 65% беременных (Н.М.Касабулатов, 2010). У 14-32% беременных женщин ЭГП являются причиной осложненного течения беременности и родов [2].
По данным нашего исследования, здоровые беременные составили 13,6%, что на 16,4% ниже среднего уровня индекса здоровья беременных по Казахстану (К.Тулебаев, 2005), так как 60% обследованных нами беременных женщин проживают в экологически неблагоприятной зоне г. Алматы. Эти данные послужили основанием для проведения данного исследования.
Цель работы: изучить частоту выявления ЭГП у беременных женщин в зависимости от возраста и срока беременности, проанализировать лечение наиболее часто встречающихся заболеваний внутренних органов и предложить наиболее приемлемое решение для снижения ЭГП у беременных в условиях реальной клинической практики на уровне первичной медико-санитарной помощи.
Материал и методы
В исследование были включены 500 беременных женщин, прикрепленных к женской консультации при городской поликлинике (ГП) №5 Алмалинского района, в возрасте от 19 до 42 лет (средний возраст – 26,01±0,86). Наблюдаемые женщины были информированы о целях, методах, а также неудобствах, которые могут быть с ним связаны.
Все женщины были распределены по возрасту (до 20 лет – 13,2%, 21 – 29 лет – 61,4%, 30 – 39 лет – 25%, 40 лет и старше – 0,4%) и по сроку беременности:
І триместр – 182 (36,4%), ІІ триместр – 153 (30,6%),
ІІІ триместр – 165 (33%). Практически здоровыми беременными являлись 68 (13,6%) женщин.
Всем беременным женщинам, помимо общего осмотра, проводились лабораторно-инструментальные исследования, которые включены в стандарты обследования при беременности: общий анализ крови (ОАК), общий анализ мочи (ОАМ), биохимический анализ крови: общий белок, сахар, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), креатинин, мочевина, электрокардиография, ЭхоКГ, УЗИ органов брюшной полости и почек (по показаниям).
Результаты и обсуждение
По данным нашего исследования, следует, что практически у каждой беременной женщины диагностируется та или иная патология внутренних органов (табл. 1).
Как, следует из табл. 1, ЖДА первой степени выявлена у 186 (37,2%), второй степени – 37 (7,4%), третьей степени – у 1 (0,2%) беременной.
Болезни мочеполовой системы, в частности хронический пиелонефрит и его обострение – у 86 (17,2%), мочекаменная болезнь (МКБ) встречалась у 10 (2%) беременных.
Третье место занимают заболевания ССС – 8,6%, затем заболевания ЖКТ – 6,6% и болезни органов дыхания – 4,8%.
Как следует из табл. 2 в возрасте от 20 до 29 лет в основном преобладают такие заболевания как ЖДА первой степени – 80 (31,1%), болезни МПС – у 72 (28%), ЖКТ – 33 (13%) и ССЗ – у 41 (15,9%) беременной женщины.
Как следует из табл. 3, в зависимости от срока беременности ЭГП в основном преобладали во ІІ триместре – ЖДА первой степени – 34,5%, второй степени – 13,1%, болезни мочеполовой системы, в частности пиелонефрит – 23,2%, болезни ЖКТ – 7,7%,
ССЗ – 14,7%.
Лечебная тактика при ЖДА беременных включает белковую диету, витамины, и препараты железа. Было рекомендовано полноценное питание, содержащее достаточное количество железа и белка. Особенно полезны мясные продукты, молочные продукты (сыр, творог, кефир), овощи и фрукты – около 800 г/сут, часть из которых нужно съедать в сыром виде (морковь, капуста, яблоки) [3, 4].
Лечение ЖДА проводилось в основном комплексными препаратами железа (удобство применения, лучшая переносимость) перорально – ферровит (Fe2+ и аскорбиновая кислота 60 мг), 100 мг, по 1 таблетке 2 раза в день.
При ЖДА II и III степени к железосодержащим препаратам дополнительно назначалось фолиевая кислота и цианокобаламин (витамин В12).
Повышение уровня гемоглобина у беременных женщин отмечалось через 3 нед, что клинически проявлялось в виде нормализации числа сердечных сокращений (ЧСС), снижении выпадения волос, уменьшения головных болей, головокружения, слабости, сухости кожных покровов.
Беременным женщинам с сопутствующей патологией почек назначался канефрон – комбинированный препарат растительного происхождения, оказывающий противомикробное, спазмолитическое и противовоспалительное действие – по 2 драже
3 раза в сутки в течение одного месяца с последующим переходом на почечный чай и растительные уросептики (лист брусники, траву толокнянки, клюквенный морс) в течение 10 дней каждого месяца. Клинически у беременных отмечалось улучшение общего состояния, в анализах мочи уменьшение лейкоцитурии, количества солей.
Клинически у беременных отмечалось улучшение общего состояния, в анализах мочи уменьшение лейкоцитурии, количества солей.
При лечении артериальной гипертензии (АГ) беременным женщинам назначался допегит – антигипертензивный препарат центрального действия по 250 мг/сут при I степени АГ и II степени 500 мг/сут. Учитывая оценку безопасности снижения АД в плане уменьшения маточно-плацентарного кровотока и нарушения оксигенации плода, регулярно проводился контроль АД беременных (ведение дневника беременной). На фоне терапии отмечалась нормализация артериального давления (АД), уменьшение головных болей.
При лечении болезней ЖКТ (бескаменный холецистит, дискинезия желчевыводящих путей, хронический панкреатит) беременным назначался хофитол по 2 таблетки 3 раза в день (3 нед) – препарат растительного происхождения, оказывающий желчегонное, гепатопротекторное и диуретическое действие [5]. Содержащиеся в артишоке аскорбиновая кислота, каротин, витамины В1 и В2, инулин способствуют нормализации обмена веществ в организме, оказывают влияние на метаболизм липидов и кетоновых тел. Препарат обладает детоксицирующим действием на паренхиму печени и почек, является мощным антиоксидантом и антигипоксантом.
Препарат обладает детоксицирующим действием на паренхиму печени и почек, является мощным антиоксидантом и антигипоксантом.
При рефлюксах с выраженной изжогой – антацидные препараты. Основным методом в лечении заболеваний ЖКТ остается диета №5 по Певзнеру. Клинически проявлялось улучшением самочувствия, уменьшением болевого синдрома, тошноты и изжоги. Таким образом, учитывая неблагоприятные факторы (загазованность, невысокий социальный уровень) изучаемого района г. Алматы, необходимо проводить всем женщинам фертильного возраста медицинские осмотры, диспансеризацию и своевременное лечение выявленной патологии для предупреждения прогрессирования ЭГП во время беременности.
Организовать школы для женщин, планирующих беременность, возможность врачам выезжать в образовательные учреждения с целью проведения минилекций о планировании семьи, методах контрацепции и здоровом образе жизни.
Выводы
1. Наиболее распространенной патологией беременных женщин является ЖДА, преимущественно первой степени (59,4%).
2. ЭГП преобладали в возрасте от 21-29 лет (60%).
3. ЭГП, в основном, преобладали во II триместре беременности, что составило 60%
4. Применение ферровита в дозе 200 мг/сут явилось эффективной дозой в коррекции ЖДА.
5. На всем протяжении беременности контролировался ОАМ, и при минимальных отклонениях от нормы женщины получали курсы растительных уроантисептиков (лист брусники, траву толокнянки, почечный чай и пр.) в течение 10 дней каждого месяца.
6. Допегит является препаратом выбора у беременных женщин с АГ в индивидуально подобранных дозах после тщательного мониторинга АД.
7. Основные нарушения со стороны ЖКТ – заболевания желчевыводящих путей, рефлюксы с выраженной изжогой; безопасным препаратом в этих случаях был растительный препарат хофитол, а при гастоэзофагиальном рефлюксе – антациды (ренни, маалокс).
8. Болезни органов дыхания, в основном, проявлялись в виде бронхитов и трахеобронхитов, как осложнения ОРВИ, для их терапии применялся муколитический препарат секразол (амброксола гидрохлорид), который оказывает разжижающий эффект на секрет дыхательного тракта, снижает вязкость мукозного секрета, что способствует улучшению функции цилиарного эпителия, выведению секрета и облегчает дыхание.
Литература
1. Кривцова Е.В., Верткин А.Л. Некоторые вопросы плановой и экстренной терапии экстрагенитальных заболеваний у беременных. Акушерство и гинекология. М.: 2010; 4: 37-40.
2. Шехтман М.М. Руководство по экстрагенитальной патологии у беременных. Издание четвертое. М.: «Триада-Х», 2007; 816.
3. Казакова Л.М. Железодефицитная анемия у беременных. Медицинская помощь. 2003; 1: 15-17.
4. Бурлев В.А., Коноводова Е.Н., Мурашко Л.Е. Коррекции железодефицитных состояний у беременных с гестозом. Проблемы репродукции. 2002; 2: 30-34.
5. Внутренние болезни и беременность: тактика применения лекарств: учебное пособие / О.П.Алексеева, З.Д.Михайлова. Н.Новгород: Издательство Нижегородской госмедакадемии, 2008; 288.
Ведение беременности у женщин с патологией — записаться в Москве
Ведение беременности у женщин с экстрагенитальной патологией требует высокой квалификации и точнейшей превентивной диагностики. Подобные исследования не ограничиваются лабораторными анализами и УЗИ.
Очень важны беседы с будущими мамочками, регулярный опрос по возможным симптомам и своевременное обнаружение патологий. Квалифицировать проявление первичной или вторичной патологии может только профессионал высокого уровня, акушер-гинеколог с большим опытом работы с беременными женщинами с экстрагенитальной патологией.
Специалисты сети платных клиник «Диамед» — это врачи высшего уровня квалификации, которые в течение многих лет эффективно диагностируют и лечат любые патологии у женщин, в том числе экстрагенитальную патологию беременных.
Речь идет о совокупности состояний и заболеваний негинекологического характера, которые развиваются в период беременности. К ним не относятся осложнения при родах. Таким образом, в эту группу входят болезни и синдромы, лечением и коррекцией которых занимаются профильные специалисты.
Медицинские центры «Диамед» оснащены современным сертифицированным оборудованием, а возможность проведения исследований в собственной лаборатории дает гарантию получения максимально точных результатов, и тем самым, постановки правильного диагноза.
На основании данных анамнеза, клинических и лабораторных исследований врач выбирает соответствующую тактику лечения и вносит корректировки в тактику ведения беременности. Благодаря эффективному лечению патологий, сопровождающих беременность, исключается их отрицательное влияние на нормальное развитие плода.
В большинстве случаев беременность провоцирует обострение заболеваний, что может ухудшить состояние организма, как матери, так и будущего малыша. С целью сохранения беременности, здоровья женщины и рождения полноценного ребенка пациентка должна находиться под постоянным наблюдением опытного врача и пройти курс лечения.
В зависимости от того, насколько значительно влияет то или иное заболевание на частоту осложнений, возникающих в период беременности, при родоразрешении и в послеродовой период, ЭГП подразделяются на малозначимые и значимые виды.
Экстрагенитальная патология беременных — значимые виды
- Первичная патология — синдромы, состояния и болезни, которые развиваются или обостряются вне зависимости от наступления беременности.
 Различают острый и хронический вид первичной ЭГП. К первым относятся инфекционные и хирургические болезни, новообразования и воспаление легких. К хроническим ЭГП — нарушения таких систем, как сердечно-сосудистая, дыхательная, и мочевыделительная, а также патологии эндокринных желез.
Различают острый и хронический вид первичной ЭГП. К первым относятся инфекционные и хирургические болезни, новообразования и воспаление легких. К хроническим ЭГП — нарушения таких систем, как сердечно-сосудистая, дыхательная, и мочевыделительная, а также патологии эндокринных желез. - Вторичная — синдромы, состояния и болезни, которые связаны с наступлением беременности. Сюда можно отнести сахарный и несахарный диабет, пиелонефрит и острую жировую дистрофию печени, анемию и тромбоцитопению, гипертиреоз и дерматоз, глюкозурию, гингивит, послеродовой тиреоидит, инфаркт гипофиза и др.
Главная задача врача акушера-гинеколога при диагностировании той или иной патологии — оценить степень риска для здоровья и жизни будущей матери и плода и обеспечить максимально физиологическое протекание беременности на фоне постоянной коррекции ЭГП.
При грамотном и профессиональном ведении беременности женщины, страдающей экстрагенитальной патологией, в медицинских центрах «Диамед» вам не придется волноваться о благополучном протекании беременности и рождении крепкого, здорового ребенка.
Памятка пациентам
Часто беременность провоцирует обострение заболеваний, что влечет за собой ухудшение состояния будущей мамы и малыша. Но бывает так называемый вторичный синдром, когда заболевание наступает с беременностью. Важно вовремя диагностировать проявление синдрома и предупредить осложнения, связанные с различными его проявлениями.
Стратегия «Контроля резистентности крови» у беременных с риском массивных акушерских кровотечений Выводы Ссылки
Исследовательская статья | Открытый доступ 2023|Том 1|Выпуск 1| https://doi.org/10.37191/Mapsci-JGCORM-1(1)-002
A Strategy of «Resistance Blood Management» in Pregnant Women at Risk of Massive Obstetric Hemorrhage
| Received Jun 3, 2022 | Revised Jun 15, 2022 | Accepted июнь 20, 2022 | Опубликовано июля 4, 2022 |
Аннотация
Цель исследования: для определения эффективности обработки с интуитивной линейностью. комплекс сахарозы (Суфер) у беременных с патологической плацентацией, как первый этап «крововедения пациентки» перед родами. Наши исследования были ограничены изучением эффективности добавок железа для лечения анемии.
комплекс сахарозы (Суфер) у беременных с патологической плацентацией, как первый этап «крововедения пациентки» перед родами. Наши исследования были ограничены изучением эффективности добавок железа для лечения анемии.
Методы: Среди 86 беременных с патологией плаценты 58 (70,7%) имели анемию. Тяжелая анемия с уровнем гемоглобина <70 г/л была у 13 (22,4%), а умеренная анемия с уровнем гемоглобина <90 г/л - у 19 (32,8%). В первую группу вошли 18 (31,1%) беременных с предлежанием плаценты с периодическими кровопотерями во время беременности. Вторую группу составили 40 (68,9%) беременных с прорастанием плаценты. Срок беременности у всех женщин составил 33+6 недель. Анемию лечили внутривенным введением железа Суфер 3 раза в неделю (5-7 инъекций).
Результат: Основным фактором, приведшим к патологической плацентации, был рубец на матке. У беременных второй группы с прорастанием плаценты рубец на матке был у 38 (95%) женщин. Тяжелая анемия имела место у 2 (11,1%) беременных с предлежанием плаценты и в 2,4 раза чаще у беременных с прорастанием плаценты-11 (27,5%). Умеренная анемия была у 4 (22,2%) женщин в первой группе и у 15 (37,5%) во второй группе. У беременных с тяжелой анемией после 5-7 инъекций препарата Суфер достоверно повышался уровень гемоглобина на 30 г/л, увеличивалось число эритроцитов до 2,8х1012/л, повышалось сывороточное железо в 2 раза, уровень ферритина увеличилось до 190,6 мкг/л и снижение содержания трансферрина. Беременным с анемией средней степени тяжести для нормализации показателей было достаточно 3-5 инъекций препарата. Нормализация показателей крови позволила снизить риск кровотечения, количество гемотрансфузий и улучшить результаты лечения.
Умеренная анемия была у 4 (22,2%) женщин в первой группе и у 15 (37,5%) во второй группе. У беременных с тяжелой анемией после 5-7 инъекций препарата Суфер достоверно повышался уровень гемоглобина на 30 г/л, увеличивалось число эритроцитов до 2,8х1012/л, повышалось сывороточное железо в 2 раза, уровень ферритина увеличилось до 190,6 мкг/л и снижение содержания трансферрина. Беременным с анемией средней степени тяжести для нормализации показателей было достаточно 3-5 инъекций препарата. Нормализация показателей крови позволила снизить риск кровотечения, количество гемотрансфузий и улучшить результаты лечения.
Заключение: Своевременная диагностика железодефицитной анемии у беременных с патологией плаценты является важным средством профилактики массивной кровопотери и уменьшения количества гемотрансфузий, как первый этап стратегии «кровообеспечение больного». Внутривенное введение железа (III) комплексного гидроксида сахарозы (Суфер) показало высокую клиническую эффективность при лечении железодефицитной анемии у беременных с плацентарной патологией и может быть рекомендовано для широкого применения в практической медицине.
Ключевые слова
Беременность, Плацентарная патология, Железодефицитная анемия, Управление кровью пациента, Железо (III) комплекс гидроксида сахарозы (Sufer) , что составляет 27,1% материнской смертности во всем мире, от 8% в развитых районах до 32% в Восточной Африке[1]. Критические и изнурительные осложнения, такие как геморрагический шок, острый респираторный дистресс-синдром, диссеминированное внутрисосудистое свертывание крови, желудочно-кишечная недостаточность, потеря фертильности, некроз гипофиза (синдром Шихана) и даже материнская смерть могут быть вызваны запоздалой диагностикой заболевания у матери и адекватным медицинская помощь [2].
В настоящее время управление кровью пациента (PBM) представляет собой своевременное применение доказательных медицинских и хирургических концепций, направленных на поддержание уровня гемоглобина, оптимизацию гемостаза и минимизацию кровопотери для улучшения результатов лечения [3,4].
Беременные женщины с аномалиями плаценты, такими как предлежание плаценты или инвазивная плацента, подвержены риску массивных акушерских кровотечений во время беременности и родов. У значительного процента таких беременных имеется железодефицитная анемия. Лечение анемии имеет большое значение при подготовке к оперативному родоразрешению, что позволит снизить потребность в гемотрансфузиях и улучшить результаты лечения [5-7]. Тяжелая пренатальная анемия является важным прогностическим фактором нежелательных явлений, требующих интенсивного лечения во время беременности.
У значительного процента таких беременных имеется железодефицитная анемия. Лечение анемии имеет большое значение при подготовке к оперативному родоразрешению, что позволит снизить потребность в гемотрансфузиях и улучшить результаты лечения [5-7]. Тяжелая пренатальная анемия является важным прогностическим фактором нежелательных явлений, требующих интенсивного лечения во время беременности.
Всемирная организация здравоохранения (ВОЗ) сообщает, что более 40 процентов беременных женщин во всем мире страдают от анемии. Так, 13 недавних исследований, изучающих взаимосвязь между пренатальной анемией и риском массивного акушерского кровотечения, показали, что тяжелая пренатальная анемия увеличивает риск MAC (HS = 3,54; 95% ДИ: 1,20, 10,4, p-значение = 0,020) [8]. ]. Исследование ВОЗ показало, что тяжелая антенатальная или постнатальная анемия (любого типа) у матери была связана с повышенным риском материнской смертности (HI 2,36;9).5% ДИ 1,60-3,48) [9].
Дефицит железа является наиболее распространенной причиной материнской анемии из-за недостаточных запасов железа на ранних сроках беременности, повышенных потребностей в железе, связанных с беременностью, и потери железа из-за кровопотери во время родов. Во время беременности концентрация ферритина в сыворотке <30 мкг/л означает недостаточные или пустые запасы железа и, следовательно, повышенный риск развития железодефицитной анемии. Значение ферритина в сыворотке <12 мкг/л свидетельствует об установленном дефиците железа с пустыми запасами железа на всех сроках беременности [10-12].
Во время беременности концентрация ферритина в сыворотке <30 мкг/л означает недостаточные или пустые запасы железа и, следовательно, повышенный риск развития железодефицитной анемии. Значение ферритина в сыворотке <12 мкг/л свидетельствует об установленном дефиците железа с пустыми запасами железа на всех сроках беременности [10-12].
Три метаанализа, опубликованные в 2018–2019 гг., оценивали преимущества и риски перорального и внутривенного введения железа на основе рандомизированных исследований с участием беременных или родильниц с дефицитом железа. Эти анализы показали, что добавки железа любым способом (перорально или внутривенно) повышают уровень гемоглобина и ферритина; по сравнению с пероральным железом, внутривенное введение железа было связано с более высоким уровнем гемоглобина после терапии [11,12].
Внутривенное железо, вероятно, лучше, чем пероральное, в содействии быстрой коррекции анемии и дефицита железа, что может стать более важным по мере развития беременности, а также в обеспечении дефицита железа у развивающегося плода.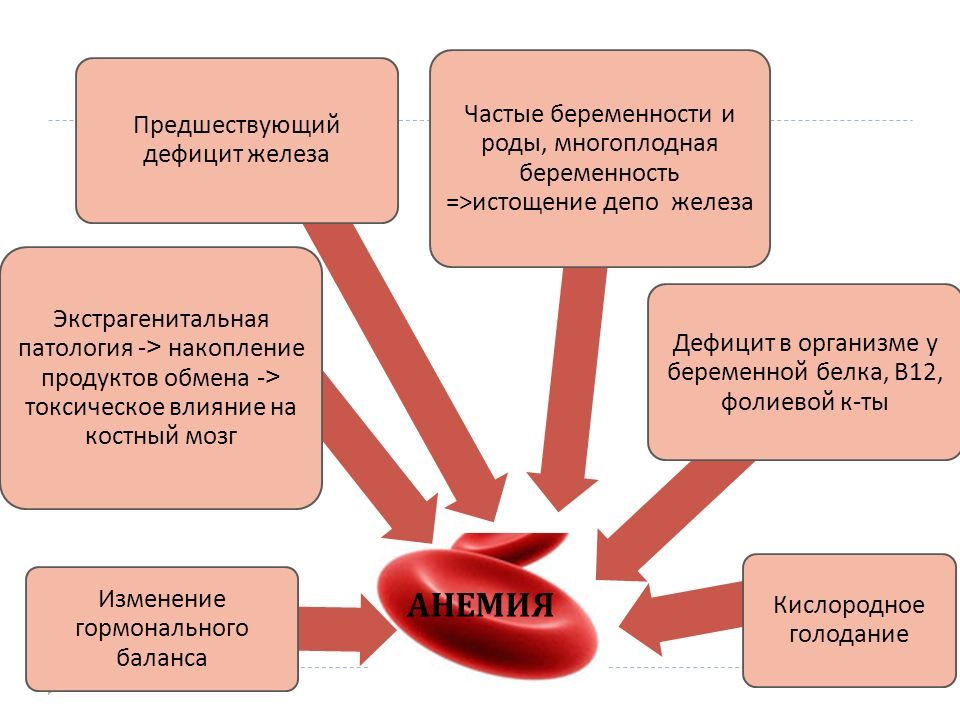 Ни у одного из новорожденных не была диагностирована железодефицитная анемия у женщин, получавших внутривенные препараты железа. Исследования показали лучшую эффективность в повышении уровня гемоглобина и ферритина и благоприятный профиль безопасности с меньшим количеством побочных эффектов при использовании внутривенных добавок железа [12,13]. Своевременная диагностика и адекватное лечение железодефицитной анемии у беременных позволяют предотвратить развитие значительного числа осложнений во время беременности и родов, улучшить самочувствие беременных [11-13].
Ни у одного из новорожденных не была диагностирована железодефицитная анемия у женщин, получавших внутривенные препараты железа. Исследования показали лучшую эффективность в повышении уровня гемоглобина и ферритина и благоприятный профиль безопасности с меньшим количеством побочных эффектов при использовании внутривенных добавок железа [12,13]. Своевременная диагностика и адекватное лечение железодефицитной анемии у беременных позволяют предотвратить развитие значительного числа осложнений во время беременности и родов, улучшить самочувствие беременных [11-13].
Для пациенток с предлежанием плаценты и прорастанием плаценты квалифицированный дородовой уход и предоперационная подготовка включают коррекцию железодефицитной анемии. Анемия является контролируемым фактором риска — своевременное обследование и лечение анемии в антенатальном периоде является важнейшим средством профилактики тяжелых акушерских осложнений.
Целью нашего исследования было определение эффективности лечения анемии внутривенным введением железа (III) сахарозного комплекса гидроксида (Sufer) у беременных с патологической плацентацией, как первого этапа «крововедения больного», для подготовки к хирургическому вмешательству. доставка.
доставка.
Материалы и методы
В клиническое проспективное исследование, проведенное в региональном перитонеальном центре, включены 86 беременных с плацентарной патологией. Среди них 58 (70,7%) имели анемию. Тяжелая анемия с уровнем гемоглобина <70 г/л была у 13 (22,4%), среднетяжелая анемия с уровнем гемоглобина <90 г/л - у 19 (32,8%), легкая анемия с уровнем гемоглобина <105 г/л была у 26 (44,8%) беременных. Первую группу составили 18 (31,1%) беременных с предлежанием плаценты с рецидивирующей кровопотерей во время беременности. Во вторую группу вошли 40 (68,9%) беременных с инвазивной плацентой. Срок беременности у всех женщин составил 33+6 недель. Беременным с анемией тяжелой и средней степени тяжести назначали внутривенное введение железа (III) гидроксида сахарозы (Суфер).
Sufer был разработан для обеспечения контролируемого усвоения железа для транспорта железа и хранения белков в организме (трансферрин и ферритин соответственно). После внутривенного введения железо из комплекса всасывается преимущественно печенью, селезенкой и костным мозгом. На втором этапе железо используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов или запасается в печени в виде ферритина.
На втором этапе железо используется для синтеза гемоглобина, миоглобина и других железосодержащих ферментов или запасается в печени в виде ферритина.
Средняя терапевтическая доза составила 150-200 мг в зависимости от уровня гемоглобина, кратность введения 3 раза в неделю в зависимости от уровня гемоглобина. Эффективность терапии оценивали еженедельно по субъективной оценке улучшения самочувствия и лабораторным показателям периферической крови.
У каждого больного до начала приема Суфера и еженедельно в процессе лечения определяли следующие показатели: содержание гемоглобина, количество эритроцитов, среднее содержание гемоглобина в эритроците, сывороточное железо, трансферрин, ферритин.
Исследования, результаты и обсуждение
Средний возраст пациентов составил 31±2,3 года. 38 (65,5%) женщин были сельскими жителями. Более 90% женщин не работали. Каждая пятая женщина имеет вредную привычку курить. Хронический алкоголизм был у 2 беременных. Первородящих женщин было всего 6 (10,3%). Сопутствующая экстрагенитальная патология помимо анемии имела место у 28 (48,3%) беременных обеих групп. Выявлены следующие заболевания: врожденный порок сердца у 2(7,1%), артериальная гипертензия у 5(17,8), хронический пиелонефрит у 3(10,5%), хронический гломерулонефрит у 1(3,5%), заболевания мочевыводящих путей у 2(7,1%), предгестационная сахарный диабет 1(3,5%), эпилепсия 1(3,5%), хронический панкреатит 1(3,5%), хронический гепатит 2 7,1%), цирроз печени у 1(3,5%), бронхоэктазы у 1(3,5%), хронический бронхит у 3 (10,7%), ВИЧ-инфекция у 5 (17,8%), варикоз у 8 (28,5%). Статистической разницы между группами не было. Сочетание анемии с сопутствующими экстрагенитальными заболеваниями является важным фактором риска осложнений беременности и акушерских кровотечений.
Первородящих женщин было всего 6 (10,3%). Сопутствующая экстрагенитальная патология помимо анемии имела место у 28 (48,3%) беременных обеих групп. Выявлены следующие заболевания: врожденный порок сердца у 2(7,1%), артериальная гипертензия у 5(17,8), хронический пиелонефрит у 3(10,5%), хронический гломерулонефрит у 1(3,5%), заболевания мочевыводящих путей у 2(7,1%), предгестационная сахарный диабет 1(3,5%), эпилепсия 1(3,5%), хронический панкреатит 1(3,5%), хронический гепатит 2 7,1%), цирроз печени у 1(3,5%), бронхоэктазы у 1(3,5%), хронический бронхит у 3 (10,7%), ВИЧ-инфекция у 5 (17,8%), варикоз у 8 (28,5%). Статистической разницы между группами не было. Сочетание анемии с сопутствующими экстрагенитальными заболеваниями является важным фактором риска осложнений беременности и акушерских кровотечений.
| Акушерский анамнез/беременность Первая группа | Первая группа n=18абс.ч. (%) | Другая группа n=40абс.ч. (%) (%) | |
| История искусственных абортов | 2 (11,1%) | 4 (10%) | |
| Более 3 | |||
| Более 3 | |||
| Более 3 | |||
| Самопроизвольные выкидыши | 1(5.5%) | 3(7.5%) | |
| Infertility | 2(11.1%) | 2(5%) | |
| IVF | 2(11.1 %) | 1(2.5%) | |
| Inflammatory diseases of the pelvic organs | 4(22.2%) | 4(10%) | |
| Uterine fibroids | 1(5.5 %) | 2(5%) | |
| The threat of abortion | | | |
| in the first trimester | 2(11. 1%) 1%) | 5(12.5%) | |
| in the second trimester | 3 (16,6%) | 4 (10%) | |
| В третьем триместре | 3 (16,6%) | 6 (15%) | 6 (15%) | 6 (15%) | 6 (15%) | 6 (15%) | 6 (15%)0027 | 4 (22,2%) | 8 (20%) |
| Преэклампсия — это зрелости | — | 1 (2,5%) | 1 (2,5%) | 1 (2,5%) | 1 (2,5%) | 1 (2,5%) | 1 (2,5%). ) | 12(30%) |
| Cesarean section in the anamnesis | | | |
| 1 | 2(11.1%) | 8(20%) | |
| 2 | 2(11. 1%) 1%) | 15(37.5%) | |
| 3 | — | 10(25%) | |
| 4 | — | при преждевременной отслойке плаценты
анамнез 1(5,5%) | 3(7,5%) |
| Myomectomy in the anamnesis | 1(5.5%) | 2(5%) | |
| Complicated postoperative period | 2(11.1%) | 4(10%) | |
| История переливания крови | 2 (11,1%) | 5 (12,5%) | |
| . смерть | 1(11,1%) | 1(2,5%) |
Таблица 1: Акушерский анамнез и течение беременности.
По данным нашего исследования, основным фактором, приведшим к патологической плацентации, был рубец на матке. В первой группе беременных с предлежанием плаценты рубец на матке был у 7 (38,8%). У беременных второй группы с инвазией плаценты рубец на матке составил 38(95%), что в 2,5 раза больше. Послеоперационный период осложнился у 11,1% женщин первой группы и у 10% женщин второй группы. Переливание крови выполнено 12,5% женщин второй группы. Только половина женщин (кровотечение и анемия) смогли объяснить причину переливания крови.
У беременных второй группы с инвазией плаценты рубец на матке составил 38(95%), что в 2,5 раза больше. Послеоперационный период осложнился у 11,1% женщин первой группы и у 10% женщин второй группы. Переливание крови выполнено 12,5% женщин второй группы. Только половина женщин (кровотечение и анемия) смогли объяснить причину переливания крови.
В предоперационной подготовке к оперативным родам важное значение имеет лечение анемии с целью уменьшения кровотечения и показаний к переливанию крови.
Среди обследованных беременных 2 (11,1%) беременных с предлежанием плаценты имели тяжелую анемию и 11 (27,5%) беременных с прорастанием плаценты в 2,4 раза чаще. Умеренная анемия была у 4 (22,2%) женщин первой группы и у 15 (37,5%) женщин второй группы. В общей сложности анемия тяжелой и средней степени тяжести имела место у 6 (33,3%) беременных первой группы и у 26 (65%) беременных второй группы, получавших внутривенный препарат железа суфер 3 раза в неделю, 5-7 раз в зависимости от результаты лечения).
| Indicators | Severe anemia | | Moderate anemia | | |||||||||||||||||||
| | n=13 | | n=19 | | |||||||||||||||||||
| | До лечения | После лечения | До лечения0054 | After treatment | |||||||||||||||||||
| Hemoglobin g/l | 65±3.5 | 95±5.2 * | 88±3.8 | 110±4.5 * | |||||||||||||||||||
| Erythrocytes 10 12 /l | 1. 8±0.05 8±0.05 | 2.8±0.2 * | 2.5±0.1 | 3.2±0.3 * | |||||||||||||||||||
| Color indicator | 0.8 | 0.9 | 0.9 | 1 | |||||||||||||||||||
| Morphological changes of erythrocytes | Anisocytosis, poikilocytosis | No | Anisocytosis | No | |||||||||||||||||||
| Serum iron мкмоль/л | 10,5 ± 0,2 | 20,6 ± 0,6 * | 12,5 ± 0,4 | 25,8 ± 0,8 * | 25,8 ± 0,8 * | 25,8 ± 0,8 * | 25,8 ± 0,8 * | 25,8 ± 0,8 .0046| Ferritin | | | | | mcg/l | 11.5±0.3 | 19.6±0.8 * | 15. |  2±0.5 2±0.5 28.5± 0.9 * | Transferrin g/l | 3.8±0.02 | 3.2±0.04 | 3.6±0.01 | 3.1±0.02 | |
Таблица 2: Основные лабораторные показатели до и после лечения Суфером. Примечание: *Вероятность различия р<0,05.
Результаты лечения железодефицитной анемии внутривенным введением Suffer были положительными. Существенных побочных эффектов препарата не было. У беременных с тяжелой анемией после 5-7 инъекций Суфера достоверно повышался гемоглобин на 30 г/л, увеличивалось количество эритроцитов до 2,8х1012/л, повышалось сывороточное железо в 2 раза, ферритин повышался до 190,6 мкг/л и снижение содержания трансферрина. У беременных с анемией средней степени тяжести для нормализации показателей было достаточно 3-5 инъекций препарата. До оперативного родоразрешения у всех беременных были удовлетворительные результаты, что позволило снизить риск кровотечения, количество гемотрансфузий и улучшить результаты лечения.
Выводы
1. Беременные с предлежанием плаценты и прорастанием плаценты относятся к группе риска по массивным акушерским кровотечениям во время беременности и родов.
2. Своевременная диагностика железодефицитной анемии у беременных с плацентарной патологией является важным средством профилактики массивной кровопотери и уменьшения количества гемотрансфузий, как первый этап стратегии «кровообеспечение больного».
3. Внутривенный препарат железа (III) сахароза гидроксид комплекс Суфер показал высокую клиническую эффективность при лечении железодефицитной анемии у беременных с плацентарной патологией и может быть рекомендован для широкого применения в практической медицине
Ссылки
1. Liu CN, Yu FB, Xu YZ, Li JS, Guan ZH, Sun MN, et al. Распространенность и факторы риска тяжелого послеродового кровотечения: ретроспективное когортное исследование. BMC Беременность Роды. 2021;21(1):1–8. ПабМед | CrossRef
2. Daru J, Zamora J, Fernández-Félix BM, Vogel J, Oladapo OT, Morisaki N, et al. Риск материнской смертности у женщин с тяжелой анемией во время беременности и после родов: многоуровневый анализ. Ланцет Глоб Здоровье. 2018;6(5):e548-54. ПабМед | Перекрёстная ссылка
Daru J, Zamora J, Fernández-Félix BM, Vogel J, Oladapo OT, Morisaki N, et al. Риск материнской смертности у женщин с тяжелой анемией во время беременности и после родов: многоуровневый анализ. Ланцет Глоб Здоровье. 2018;6(5):e548-54. ПабМед | Перекрёстная ссылка
3. Ван Х., Руан Х., Ли И., Ченг Дж., Муек А.О. Показатели окислительного стресса у китайских женщин с СПКЯ и корреляция с особенностями метаболического синдрома и зависимостью от липидных паттернов. Arch Gynecol Obstet. 2019;300(5):1413-21. ПабМед | CrossRef
4. Ярмила А. Зданович, Даниэль Сурбек. Менеджмент крови пациента в акушерстве – обзор. TransfusApher Sci. 2019;58(4):412-15.PubMed | CrossRef
5. Американский колледж акушеров и гинекологов, Общество медицины матери и плода. Консенсус по акушерской помощи №. 7: спектр приращения плаценты. Акушерство Гинекол. 2018;132(6):e259-75. ПабМед | CrossRef
6. Collins SL, Alemdar B, van Beekhuizen HJ, Bertholdt C, Braun T, Calda P, et al. Основанные на фактических данных рекомендации по лечению аномально инвазивной плаценты: рекомендации Международного общества аномально инвазивной плаценты. Am J Obstet Gynecol. 2019;220(6):511-26. ПабМед | CrossRef
Am J Obstet Gynecol. 2019;220(6):511-26. ПабМед | CrossRef
7. Schwickert A, van Beekhuizen HJ, Bertholdt C, Fox KA, Kayem G, Morel O, et al. Ассоциация перинатального ведения и высокой материнской кровопотери при кесаревом сечении для спектра приращения плаценты (PAS): исследование многонациональной базы данных. Acta ObstetGynecol Scand. 2021;100:29-40.ПабМед | CrossRef
8. Эредиа М., Тениас Х.М., Росио Р., Ампаро Ф., Каллеха М.А., Валенсуэла Х.К. Качество жизни и прогностические факторы у пациентов, подвергающихся вспомогательным репродуктивным технологиям. Eur J ObstetGynecolReprod Biol. 2013;167(2):176-80. CrossRef
9. Harrison RK, Lauhon SR, Colvin ZA, McIntosh JJ. Материнская анемия и тяжелая материнская заболеваемость в когорте США. Am J ObstetGynecol MFM. 2021;3(5):100395. ПабМед | CrossRef
10. Омотайо М.О., Абиой А.И., Куеби М., Эке А.С. Пренатальная анемия и риск послеродового кровотечения: систематический обзор и метаанализ. J ObstetGynaecol Res. 2021;47(8):2565-76. ПабМед | Перекрёстная ссылка
2021;47(8):2565-76. ПабМед | Перекрёстная ссылка
11. Маркова В., Норгаард А., Йоргенсен К.Ю., Лангхофф-Роос Дж. Лечение женщин с послеродовой железодефицитной анемией. Кокрановская система базы данных, ред. 2015(8). ПабМед | CrossRef
12. Pavord S, Daru J, Prasannan N, Robinson S, Stanworth S, Girling J, BSH Committee. Рекомендации Великобритании по лечению дефицита железа во время беременности. Бр Дж Гематол. 2020. ПабМед | CrossRef
13. Shin HW, Go DY, Lee SW, Choi YJ, Ko EJ, You HS, et al. Сравнительная эффективность и безопасность внутривенного введения карбоксимальтозы железа и сахарозы железа при железодефицитной анемии у акушерских и гинекологических пациентов: систематический обзор и метаанализ медицины (Балтимор). 2021;100(20). ПабМед | Перекрёстная ссылка
Posokhova Svetlana Petrovna 1* , Ryazantsev Igor Ivanovich 2 , Bailo Nadezhda Valeryevna 2 and Feshchenko Igor Valentinovich 2
1 Department of Obstetrics and Gynecology, Odessa National Medical University, 65000 Odessa , Валиховский переулок, 2, Украина
2 Одесская областная клиническая больница. Одесский областной перинатальный центр 65025, г. Одесса, ул. Заболотного, 26, Украина
Одесский областной перинатальный центр 65025, г. Одесса, ул. Заболотного, 26, Украина
* Автор, ответственный за переписку: Посохова Светлана Петровна, кафедра акушерства и гинекологии, Одесский национальный медицинский университет, 65000 г. Одесса, пер. Валиховский, 2, Украина.
Copyright© 2022 Посохова С.П. и др. Все права защищены. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Посохова С.П., Рязанцев И.И., Байло Н.В., Фетченко И.В. Стратегия «управления резистентностью крови» у беременных женщин с риском массивного акушерского кровотечения. J Gynecol Clin ObstetReprod Med. 2022;1(1):1-7. DOI: https://doi.org/10.37191/Mapsci-JGCORM-1(1)-002
picture_as_pdfСкачать PDF
file_downloadРоль пренатальной диагностики аномально инвазивной плаценты в исходе беременности | Ungiadze
1. Jauniaux E., Chantraine F., Silver R.M., Langhoff-Roos J.; Группа экспертов FIGO Placenta Accreta по диагностике и лечению. Консенсусные рекомендации FIGO по нарушениям спектра приращения плаценты: эпидемиология. Int J Gynecol Obstet. 2018; 140(3)265–73. DOI: 10.1002/ijgo.12407.
Jauniaux E., Chantraine F., Silver R.M., Langhoff-Roos J.; Группа экспертов FIGO Placenta Accreta по диагностике и лечению. Консенсусные рекомендации FIGO по нарушениям спектра приращения плаценты: эпидемиология. Int J Gynecol Obstet. 2018; 140(3)265–73. DOI: 10.1002/ijgo.12407.
2. Жонио Э., Коллинз С., Бертон Г.Дж. Приращение плаценты: патофизиология и доказательная анатомия для пренатальной ультразвуковой визуализации. Am J Obstet Gynecol. 2018;218(1):75–87. DOI: 10.1016/j.ajog.2017.05.067.
3. Jauniaux E., Jurkovic D. Placenta accreta: Патогенез ятрогенной болезни матки 20-го века. Плацента. 2012;33(4):244–51. DOI: 10.1016/j.placenta.2011.11.010.
4. Parra-Herran C., Djordjevic B. Гистопатология плаценты: интрузия ворсин хориона в сосудистые пространства миометрия и пролиферация экстравиллустрофобластов являются частыми и специфическими находками, имеющими значение для диагностики и патогенеза. Int J GynecolPathol. 2016;35(6):497–508. DOI: 10.1097/PGP.0000000000000250.
5. Фитцпатрик К., Селлерс С., Спарк П. и др. Ведение и исходы приращения, приращения и перкреты плаценты в Великобритании: популяционное описательное исследование. БЖОГ. 2014; 121(1):62–70; обсуждение 70–1. DOI: 10.1111/1471-0528.12405.
6. Thurn L., Lindqvist P.G., Jakobsson M. et al. Распространенность аномально инвазивной плаценты, факторы риска и антенатальное подозрение: результаты крупного популяционного когортного исследования беременных в странах Северной Европы. БЖОГ. 2016; 123(8):1348–55.DOI: 10.1111/1471-0528.13547.
7. Ву С., Кочергинский М., Хиббард Ю.Ю. Аномальная плацентация: двадцатилетний анализ. Am J Obstet Gynecol. 2005;192(5):1458–61. DOI: 10.1016/j.ajog.2004.12.074.
8. Сентильес Л., Мерло Б., Мадар Х. и др. Послеродовое кровотечение: профилактика и лечение. Эксперт преподобный Гематол. 2016;9(11):1043–61. DOI: 10.1080/17474086.2016.1245135.
9. Сильвер Р.М., Лэндон М.Б., Роуз Д.Дж. и другие.; Сеть отделений медицины матери и плода Национального института здоровья ребенка и человеческого развития.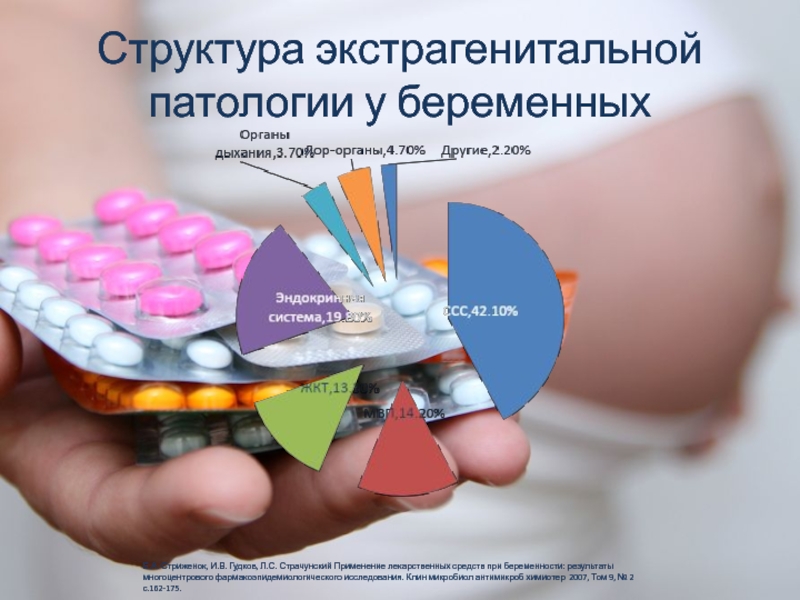 Материнская заболеваемость, связанная с многократными повторными кесаревыми сечениями. Акушерство Гинекол. 2006;107(6):1226–32. ДОИ: 10.1097/01.АОГ.0000219750.79480.84.
Материнская заболеваемость, связанная с многократными повторными кесаревыми сечениями. Акушерство Гинекол. 2006;107(6):1226–32. ДОИ: 10.1097/01.АОГ.0000219750.79480.84.
10. Крянгэ А.А., Бейтман Б.Т., Бутвик А.Дж. и другие. Заболеваемость, связанная с кесаревым сечением в Соединенных Штатах: становится ли приращение плаценты все более важным фактором? Am J Obstet Gynecol. 2015;213(3):384.e1–e11. DOI: 10.1016/j.ajog.2015.05.002.
11. Jauniaux E., Jurkovic D. Отдаленные осложнения после кесарева сечения. В: Учебник кесарева сечения. ред. Э. Жонио, В. Гробман. Оксфорд: Издательство Оксфордского университета, 2016. 129–44.
12. Жонио Э., Бертон Г.Дж. Патофизиология нарушений спектра приращения плаценты: обзор текущих данных. Клин Обстет Гинекол. 2018;61(4):743–54. DOI: 10.1097/GRF.0000000000000392.
13. Сольхейм К.Н., Есаков Т.Ф., Литтл С.Е. и другие. Влияние частоты кесарева сечения на будущую заболеваемость предлежанием плаценты, приращением плаценты и материнской смертностью. J Matern Fetal Neonatal Med. 2011;24(11):1341–6. DOI: 10.3109/14767058.2011.553695.
J Matern Fetal Neonatal Med. 2011;24(11):1341–6. DOI: 10.3109/14767058.2011.553695.
14. Ananth C.V., Demissie K., Smulian J.C., Vintzileos A.M. Предлежание плаценты при рождении одного плода и близнецов в США, 19 лет.с 89 по 1998 год: сравнение профилей факторов риска и связанных с ними состояний. Am J Obstet Gynecol. 2003;188(1):275–81. DOI: 10.1067/моб.2003.10.
15. D’Antonio F., Iacovella C., Bhide A. Пренатальная идентификация инвазивной плацентации с помощью ультразвука: систематический обзор и метаанализ. УЗИ Акушерство Гинекол. 2013;42(5):509–17. DOI: 10.1002/uog.13194.
16. McLean L.A., Heilbrun M.E., Eller A.G. et al. Оценка роли магнитно-резонансной томографии в лечении беременных с риском приращения плаценты. Академ Радиол. 2011;18(9): 1175–80. DOI: 10.1016/j.acra.2011.04.018.
17. Meng X., Xie L., Song W. Сравнение диагностической ценности ультразвуковой и магнитно-резонансной томографии для приращения плаценты: систематический обзор и метаанализ.
