Содержание
Симптомы панкреатита у беременных: Распознаем тревожные сигналы
Беременность — это удивительное время, полное ожиданий и радости. Но что если в этот волшебный период вдруг возникает острая боль в животе? Панкреатит у беременных — не такое уж редкое явление, как может показаться на первый взгляд. Давайте разберемся, что происходит, когда поджелудочная железа решает устроить бунт в самый неподходящий момент.
Представьте, что ваш организм — это сложный механизм, где каждая деталь играет важную роль. Поджелудочная железа — словно главный повар на кухне вашего тела, готовящий ферменты для переваривания пищи и гормоны для регуляции уровня сахара в крови. Но что если этот «повар» вдруг решает объявить забастовку?
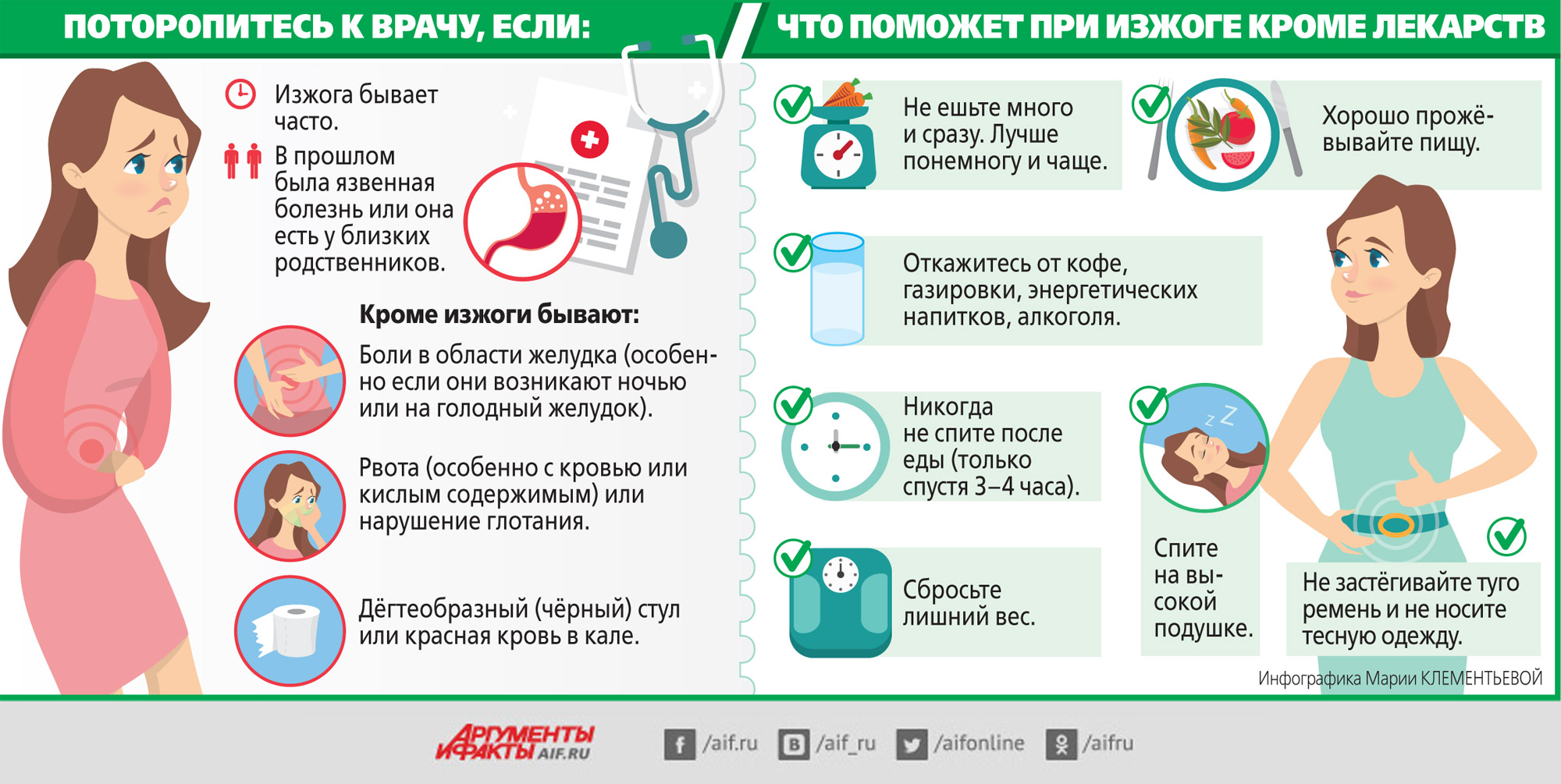
Первый звоночек — это боль. Но не просто боль, а настоящий пожар в верхней части живота, который может распространяться на спину. Эта боль не шутит — она может быть настолько сильной, что заставит вас согнуться пополам. А теперь представьте, что вы носите под сердцем маленькое чудо — и тут такое!
Но боль — это еще не все. Тошнота и рвота? Да, они тоже могут присоединиться к этому «веселому» коктейлю симптомов. И вот вы уже не знаете, то ли это обычный токсикоз, то ли что-то более серьезное. А ведь еще может появиться лихорадка, словно ваше тело решило устроить сауну изнутри.
Что же делать, если у беременной болит поджелудочная? Первое и самое главное — не паниковать! Да, это легче сказать, чем сделать, но помните: стресс — враг номер один для вашего малыша. Вместо того чтобы гуглить симптомы и накручивать себя, лучше немедленно связаться с врачом.
Первая помощь: Что делать до прибытия врача?
Итак, вы уже вызвали скорую или договорились о срочном визите к врачу. Но что делать в ожидании медицинской помощи? Во-первых, примите удобное положение. Многим помогает поза «эмбриона» — лежа на боку с подтянутыми к груди коленями. Это может немного облегчить боль.
Во-вторых, забудьте о еде. Серьезно, даже если вы голодны как волк, сейчас не время для перекусов. Поджелудочной нужен отдых, и любая пища только усугубит ситуацию. Представьте, что вы пытаетесь потушить пожар, подливая масла в огонь — вот что происходит, когда вы едите при панкреатите.

А вот пить можно и нужно, но только чистую воду, без газа и сахара. Маленькими глотками, словно вы пьете горячий чай — медленно и осторожно. Это поможет предотвратить обезвоживание, которое может наступить из-за рвоты и повышенной температуры.
Диагностика: Как врачи определяют панкреатит у беременных?
Когда вы наконец попадаете к врачу, начинается настоящее детективное расследование. Врач, словно Шерлок Холмс, будет собирать улики — проведет физический осмотр, расспросит о симптомах и истории болезни. Но главные доказательства предоставят анализы крови.
Уровень ферментов поджелудочной железы — амилазы и липазы — в крови при панкреатите взлетает до небес. Это как если бы ваша поджелудочная вдруг решила устроить фейерверк, разбрасывая ферменты направо и налево. Врачи также могут назначить УЗИ — это безопасный способ заглянуть внутрь и оценить состояние поджелудочной железы и желчных путей.
Лечение: Как помочь будущей маме?
Итак, диагноз поставлен. Что дальше? Лечение панкреатита у беременных — это настоящее искусство балансирования между эффективностью и безопасностью для малыша. Главная цель — успокоить разбушевавшуюся поджелудочную и снять воспаление.
Первым делом врачи назначат голодную диету. Звучит страшно, но на самом деле это лучшее, что можно сделать для вашей поджелудочной. Представьте, что вы даете ей отпуск — пусть отдохнет и восстановится. Вместо еды вам будут вводить питательные вещества внутривенно — это как спа-процедура для вашего организма.
Боль — главный враг в этой ситуации, и с ней нужно бороться. Но обычные обезболивающие могут быть опасны для малыша. Поэтому врачи выбирают препараты очень тщательно, словно ювелиры, подбирающие драгоценные камни для короны. Часто используются спазмолитики — они помогают расслабить гладкую мускулатуру и уменьшить боль.
Антибиотики? Да, иногда они необходимы, особенно если есть риск развития инфекции. Но не волнуйтесь — современная медицина располагает препаратами, безопасными для беременных. Это как суперсовременное оружие против бактерий, которое не навредит мирным жителям — вашему малышу.

Профилактика: Как предотвратить повторение?
После того как острый приступ миновал, встает вопрос: как не допустить повторения этого кошмара? Ведь беременность еще не закончилась, и поджелудочная может снова взбунтоваться. Здесь главное — соблюдать диету. Забудьте о жирной, острой и жареной пище. Представьте, что ваша поджелудочная — капризный гурман, которому нужны только самые легкие и полезные блюда.
Дробное питание — ваш новый лучший друг. Ешьте часто, но понемногу. Это как если бы вы кормили маленького котенка — он не может съесть много за раз, но нуждается в регулярном питании. Ваша поджелудочная будет благодарна за такой подход.
И не забывайте о движении! Конечно, речь не идет о марафонах, но легкие прогулки на свежем воздухе творят чудеса. Они улучшают кровообращение, помогают пищеварению и поднимают настроение. Представьте, что вы выгуливаете свою поджелудочную — ей тоже нужен свежий воздух и легкие физические нагрузки.
Психологический аспект: Как справиться со стрессом?
Стресс — еще один фактор, который может спровоцировать обострение панкреатита. А что может быть более стрессовым, чем беременность, осложненная проблемами со здоровьем? Поэтому важно научиться управлять своими эмоциями.
Медитация, йога для беременных, арт-терапия — выберите то, что вам по душе. Это как если бы вы учились управлять своим внутренним морем — чем спокойнее вода, тем меньше шансов на шторм. Не стесняйтесь обращаться за психологической помощью — иногда разговор с профессионалом может сделать больше, чем горсть таблеток.
Помните, что вы не одна в этой ситуации. Поддержка близких играет огромную роль в выздоровлении. Позвольте им позаботиться о вас — это как если бы вы были королевой, а они — вашей преданной свитой. Вместе вы справитесь с любыми трудностями!
Итак, что делать, если у беременной болит поджелудочная? Главное — не паниковать, обратиться к врачу, следовать его рекомендациям и помнить, что это временное явление. Ваш организм — удивительная система, способная к самовосстановлению. Дайте ему время, окружите себя заботой и любовью, и скоро вы забудете об этом неприятном эпизоде, наслаждаясь радостями материнства.

Диагностика заболеваний поджелудочной железы во время беременности
Когда будущую маму настигает неприятность в виде болей в поджелудочной железе, встает резонный вопрос: как же разобраться, что происходит внутри, не навредив при этом малышу? Ведь обычные методы диагностики могут быть небезопасны для крохи. Но не стоит паниковать! Современная медицина располагает целым арсеналом безопасных и эффективных способов выявить проблему.
Первым делом врач, словно детектив, начнет с опроса и осмотра. Он засыплет вас вопросами: когда началась боль? Как она ощущается? Что вы ели накануне? Эти, казалось бы, простые вопросы могут дать массу информации опытному специалисту. Затем последует пальпация живота — нежное, но уверенное прощупывание, которое поможет определить точную локализацию боли и наличие воспаления.
Лабораторные исследования: заглянуть внутрь, не проникая под кожу
Следующий шаг — анализ крови. Это как если бы вы заглянули в окошко вашего организма, не открывая дверь. Врачи будут искать повышение уровня ферментов поджелудочной железы — амилазы и липазы. Эти ферменты при панкреатите буквально зашкаливают, словно термометр в жаркий летний день. Но не только они интересуют докторов. Уровень лейкоцитов, С-реактивного белка и другие показатели помогут оценить степень воспаления и общее состояние организма.
А как насчет анализа мочи? Да-да, даже эта простая процедура может многое рассказать о состоянии поджелудочной железы. При панкреатите в моче могут появиться ферменты поджелудочной, словно маленькие шпионы, выдающие тайны своего хозяина.
Ультразвуковая диагностика: безопасный взгляд изнутри
УЗИ — настоящая палочка-выручалочка для беременных женщин. Этот метод абсолютно безопасен как для мамы, так и для малыша. С помощью ультразвуковых волн врач может увидеть структуру поджелудочной железы, оценить ее размеры и выявить возможные патологические изменения. Это как если бы у доктора был волшебный фонарик, позволяющий заглянуть внутрь тела, не причиняя вреда.
Кроме того, УЗИ поможет исключить другие причины боли в животе, например, проблемы с желчным пузырем или почками. Ведь иногда симптомы могут быть очень похожими, и важно не ошибиться с диагнозом.

МРТ: когда нужна детальная картинка
В некоторых случаях врач может назначить магнитно-резонансную томографию (МРТ). Этот метод считается безопасным при беременности, особенно во втором и третьем триместрах. МРТ дает более детальную картину состояния поджелудочной железы и окружающих тканей. Это как если бы вы смотрели на организм через суперсовременный микроскоп, способный показать мельчайшие детали.
МРТ особенно полезна, когда нужно выявить небольшие изменения в структуре поджелудочной или оценить состояние протоков. Однако стоит помнить, что проведение МРТ требует неподвижности в течение длительного времени, что может быть некомфортно для беременной женщины.
Эндоскопическое УЗИ: когда обычного УЗИ недостаточно
В редких случаях, когда обычное УЗИ не дает полной картины, а ситуация требует более точной диагностики, может быть назначено эндоскопическое УЗИ. Это исследование проводится с помощью специального эндоскопа с ультразвуковым датчиком на конце. Звучит страшновато, но на самом деле процедура вполне безопасна при правильном проведении.
Эндоскопическое УЗИ позволяет получить очень четкое изображение поджелудочной железы и желчных протоков. Это как если бы врач мог заглянуть прямо внутрь вашего организма через крошечное окошко. Однако из-за инвазивности метода его применяют только в крайних случаях, когда польза от диагностики превышает потенциальные риски.
Что делать, если у беременной болит поджелудочная: первые шаги
Итак, диагноз поставлен. Что дальше? Первое и самое главное правило — не паниковать! Стресс только усугубит ситуацию. Вместо этого сосредоточьтесь на выполнении рекомендаций врача. Обычно лечение панкреатита у беременных включает в себя несколько ключевых моментов.
Во-первых, диета. Забудьте о жирной, острой и жареной пище. Ваша поджелудочная сейчас нуждается в покое, как капризная примадонна перед важным выступлением. Питание должно быть дробным, небольшими порциями, с преобладанием легкоусвояемых продуктов. Представьте, что вы кормите не только себя, но и свою поджелудочную — ей нужна особая забота.
Во-вторых, медикаментозное лечение. Здесь все строго индивидуально и назначается врачом с учетом состояния беременной и срока. Могут быть назначены спазмолитики для снятия боли, препараты для нормализации работы поджелудочной железы. В некоторых случаях может потребоваться кратковременное голодание с введением питательных веществ через капельницу — своеобразный отпуск для вашей пищеварительной системы.
Альтернативные методы облегчения состояния
Помимо традиционного лечения, существуют и дополнительные способы облегчить свое состояние. Например, акупунктура. Эта древняя китайская практика может помочь снять боль и уменьшить воспаление. Конечно, важно обратиться к сертифицированному специалисту, имеющему опыт работы с беременными.
Релаксационные техники также могут быть полезны. Медитация, глубокое дыхание, легкая йога (одобренная врачом, разумеется) помогут снять стресс и расслабить мышцы живота. Это как если бы вы давали своему телу команду успокоиться и исцелиться.
Профилактика обострений: как не наступить на те же грабли
После того как острый период миновал, главная задача — не допустить повторения. Здесь ключевую роль играет образ жизни. Регулярные, но небольшие приемы пищи, исключение алкоголя (что и так обязательно при беременности), отказ от курения (если вдруг эта вредная привычка еще оставалась) — вот ваши главные союзники.
Не забывайте о движении! Легкие прогулки на свежем воздухе не только полезны для общего самочувствия, но и помогают нормализовать работу пищеварительной системы. Представьте, что каждый шаг — это маленький массаж для вашей поджелудочной.
Психологический аспект: как справиться со стрессом
Стресс — один из факторов, способных спровоцировать обострение панкреатита. А что может быть более стрессовым, чем беременность, осложненная проблемами со здоровьем? Поэтому важно научиться управлять своими эмоциями.
Попробуйте техники визуализации. Представьте, как ваша поджелудочная железа становится здоровой и сильной. Или вообразите, что вы окутываете ее целебным светом. Звучит немного эзотерически? Возможно. Но наш мозг — удивительный инструмент, способный влиять на процессы в организме.

Не стесняйтесь обращаться за психологической помощью. Разговор с профессионалом может помочь справиться со страхами и тревогами, которые неизбежно возникают в такой ситуации. Это как если бы вы разгружали тяжелый рюкзак, перекладывая часть груза на плечи того, кто готов вам помочь.
Роды и послеродовой период: что ожидать?
Многих будущих мам волнует вопрос: как панкреатит повлияет на роды? В большинстве случаев, если заболевание удалось взять под контроль, роды проходят без осложнений. Однако важно помнить, что вы находитесь в группе риска, и медицинское наблюдение должно быть более тщательным.
После родов рекомендуется продолжать соблюдать диету и следовать рекомендациям врача. Грудное вскармливание обычно не противопоказано, но все зависит от вашего состояния и препаратов, которые вы принимаете. Обязательно обсудите этот вопрос с вашим лечащим врачом.
Помните, что ваш организм только что проделал колоссальную работу — выносил и родил ребенка. Дайте себе время на восстановление. Постепенно возвращайтесь к нормальному режиму питания, не забывая о том, что ваша поджелудочная все еще нуждается в особой заботе.
Что делать, если у беременной болит поджелудочная? Главное — не паниковать, обратиться к врачу, строго следовать его рекомендациям и помнить, что это временное явление. С правильным подходом и заботой о себе вы сможете наслаждаться беременностью и с нетерпением ждать встречи с малышом, не позволяя проблемам со здоровьем омрачить этот прекрасный период вашей жизни.
Питание при болях в поджелудочной: Меню для будущей мамы
Когда у беременной болит поджелудочная, вопрос питания становится не просто важным, а жизненно необходимым. Ведь теперь вы кормите не только себя, но и растущий внутри вас маленький организм. Как же совместить заботу о поджелудочной железе и полноценное питание для малыша? Давайте разберемся в этом кулинарном квесте!
Первое правило клуба здоровой поджелудочной — никакой тяжелой пищи! Забудьте о жареной картошке, наваристых борщах и жирных стейках. Ваша поджелудочная сейчас как капризная принцесса на горошине — ей нужно особое обхождение. Представьте, что вы готовите не просто еду, а лекарство для своего организма.

Завтрак: начинаем день правильно
Утро вечера мудренее, особенно когда речь идет о питании при панкреатите. Что же выбрать на завтрак? Овсянка, сэр! Но не простая, а приготовленная на воде, без молока и сахара. Звучит скучновато? А вы добавьте в нее немного измельченного банана или яблока. Это как строить замок из песка — простые ингредиенты, но результат может быть впечатляющим!
Альтернатива овсянке — нежнейшее паровое омлет-суфле. Взбейте белки отдельно от желтков, соедините и запеките на водяной бане. Получится воздушное облако, которое не потревожит вашу поджелудочную. А если добавить немного отварной куриной грудки, то завтрак станет еще и белковым бустером для растущего малыша.
Обед: основательно, но нежно
К обеду аппетит разыгрывается не на шутку. Но помните — мы все еще в режиме «поджелудочная на диете». Что же выбрать? Супы-пюре — ваш верный друг! Картофельный, тыквенный, из цветной капусты — вариантов масса. Главное правило — никаких зажарок и минимум соли.
На второе — отварная рыба или курица. Но не просто отварили и съели. Нет, мы же творческие личности! Запеките куриную грудку в пергаменте с травами. Или приготовьте рыбные тефтельки на пару. Это как игра в кулинарного конструктора — из простых деталей собираем вкусное и полезное блюдо.
А как насчет гарнира? Овощи — ваш выбор! Но не сырые, а приготовленные на пару или запеченные. Морковь, кабачки, тыква — эти овощи станут не только вкусным дополнением к вашему обеду, но и источником витаминов для малыша.
Ужин: легкость бытия
К вечеру наш организм уже устал переваривать пищу. Поэтому ужин должен быть легким, как пёрышко. Что выбрать? Как насчет нежнейшего творожного суфле? Смешайте обезжиренный творог с яйцом, добавьте немного фруктового пюре и запеките в духовке. Получится десерт, достойный королевского стола, но при этом абсолютно безопасный для вашей поджелудочной.
Другой вариант — овощное рагу. Но не то, что жарится на сковородке в масле, а нежно тушеное в собственном соку. Баклажаны, кабачки, морковь, немного томатного сока — и вот у вас уже готово блюдо, которое и насытит, и порадует вкусом.
Перекусы: когда очень хочется, но нельзя
Беременность — это время, когда хочется есть постоянно. Но что делать, если поджелудочная протестует против частых приемов пищи? Выход есть! Фруктовое пюре — отличный вариант для перекуса. Но не покупное, а приготовленное собственноручно. Запеките яблоко или грушу в духовке, измельчите в блендере — и вот у вас уже есть вкусный и полезный снек.
А как насчет смузи? Но не тех калорийных бомб, что продаются в кафе, а легких и освежающих напитков из зелени и фруктов. Шпинат, яблоко, немного лимонного сока — и вот у вас уже есть напиток, который и утолит голод, и поддержит здоровье поджелудочной.
Питьевой режим: влага — источник жизни
Когда у беременной болит поджелудочная, вопрос питья становится особенно актуальным. Вода — ваш лучший друг! Но не простая, а слегка подщелоченная. Как этого добиться? Добавьте в стакан воды щепотку пищевой соды или выжмите немного лимонного сока. Звучит странно? А вот и нет! Такая вода помогает снизить кислотность в желудке и облегчить работу поджелудочной.
Травяные чаи — еще один способ поддержать водный баланс и при этом побаловать себя вкусным напитком. Ромашка, мята, мелисса — эти травы не только приятны на вкус, но и обладают противовоспалительным действием. Представьте, что каждая чашка такого чая — это спа-процедура для вашей пищеварительной системы.
Запретный плод: чего категорически нельзя
Теперь давайте поговорим о том, что должно оказаться в черном списке вашего меню. Жирное, жареное, копченое — эти продукты теперь табу. Представьте, что это враги, пытающиеся проникнуть в крепость вашего здоровья. Ваша задача — не пустить их на порог!
Алкоголь? Даже не думайте! Впрочем, во время беременности это и так исключено. Газированные напитки, крепкий кофе, острые соусы — все это тоже отправляется в дальний ящик до лучших времен. Помните, сейчас ваша главная задача — создать комфортные условия для малыша и дать отдых своей поджелудочной.
Готовим с умом: кулинарные хитрости
Что делать, если у беременной болит поджелудочная, а есть хочется вкусно? Есть выход! Давайте поговорим о способах приготовления, которые сделают вашу еду не только полезной, но и аппетитной.

Запекание в фольге или пергаменте — отличный способ сохранить все полезные вещества и при этом придать блюду неповторимый вкус. Добавьте немного трав, чеснока (если врач разрешил) — и вот у вас уже не просто отварная курица, а настоящий кулинарный шедевр!
Приготовление на пару — еще один способ сделать еду полезной и вкусной. Купите себе пароварку — это инвестиция в ваше здоровье. В ней можно готовить не только овощи, но и рыбу, и даже десерты! Представьте, что вы волшебник, который может превратить простые продукты в изысканные блюда, не используя ни капли масла.
Эксперименты на кухне: когда скучно есть одно и то же
Монотонная диета может навевать тоску. Но кто сказал, что здоровое питание должно быть скучным? Давайте экспериментировать! Например, попробуйте приготовить ризотто из киноа вместо обычного риса. Или сделайте лазанью из кабачков вместо теста. Это как играть в кулинарного Лего — из простых кубиков собираем сложные и интересные конструкции.
А как насчет смузи-боулов? Это не только вкусно, но и красиво! Сделайте основу из замороженных фруктов, добавьте немного овсяных хлопьев и украсьте свежими ягодами. Получится не просто завтрак, а настоящее произведение искусства, которое не потревожит вашу поджелудочную.
Психологический аспект питания: когда еда — не только пища
Когда у беременной болит поджелудочная, еда может стать источником стресса. Как преодолеть страх перед приемом пищи? Во-первых, помните — вы делаете все правильно. Каждый прием пищи — это не испытание, а акт любви к себе и своему малышу.
Создайте ритуал из приема пищи. Красиво сервируйте стол, включите приятную музыку, зажгите свечу. Пусть каждый прием пищи станет маленьким праздником. Это как медитация — вы не просто едите, вы наслаждаетесь моментом и заботитесь о себе.
И помните — временные ограничения в питании не навсегда. Это как ремонт в квартире — некоторое время неудобно, но потом будет красиво и комфортно. Так и здесь — пройдет время, и вы сможете расширить свое меню, наслаждаясь вкусом любимых блюд. А пока — творите на кухне, экспериментируйте с разрешенными продуктами и помните, что здоровое питание может быть не менее вкусным, чем привычная еда.

Медикаментозное лечение: Безопасные препараты для беременных
Когда у беременной болит поджелудочная, перед будущей мамой и ее врачом встает непростая задача: как облегчить состояние, не навредив малышу? Это как пройти по канату над пропастью — каждый шаг должен быть выверенным и осторожным. Но не переживайте, современная медицина располагает целым арсеналом средств, которые могут прийти на помощь в этой непростой ситуации.
Прежде всего, нужно понимать, что любое лечение во время беременности — это всегда баланс между необходимостью и безопасностью. Врач, назначая препараты, словно ювелир, взвешивает каждый карат пользы против возможного риска. Так что же может предложить современная фармакология будущей маме с больной поджелудочной?
Спазмолитики: когда нужно расслабиться
Первое, что приходит на помощь при болях в поджелудочной — это спазмолитики. Они словно добрые волшебники, которые приходят и расслабляют напряженные мышцы, снимая боль и дискомфорт. Но какие из них безопасны для беременных?
Дротаверин (он же «Но-шпа») — пожалуй, самый известный представитель этой группы. Он как опытный массажист для ваших внутренних органов — мягко и эффективно снимает спазм. Исследования показывают, что этот препарат не оказывает негативного влияния на плод, поэтому его часто назначают беременным.
Папаверин — еще один препарат из этой группы, который может прийти на помощь. Он действует немного мягче, чем дротаверин, но зато обладает дополнительным сосудорасширяющим эффектом. Это как если бы вы не только расслабили мышцы, но и улучшили кровоток в проблемной зоне.
Ферментные препараты: помощники пищеварения
Что делать, если у беременной болит поджелудочная, а есть все равно нужно? На помощь приходят ферментные препараты. Они как бригада рабочих, которые приходят на помощь вашей уставшей поджелудочной и берут часть работы на себя.
Панкреатин — самый известный представитель этой группы. Он содержит те же ферменты, которые в норме вырабатывает поджелудочная железа. Это как если бы вы наняли временных работников, чтобы разгрузить основной штат. Панкреатин считается безопасным для применения во время беременности, но дозировку обязательно должен подобрать врач.

Креон — более современный и чистый препарат, содержащий только панкреатические ферменты без дополнительных компонентов. Он как элитный отряд специального назначения — действует точно и эффективно. Креон также разрешен к применению у беременных, но опять же, только по назначению врача.
Антациды: когда кислотность зашкаливает
Часто проблемы с поджелудочной сопровождаются повышенной кислотностью желудка. Что делать в этом случае? На помощь приходят антациды — препараты, снижающие кислотность. Они как огнетушители, которые быстро гасят пламя изжоги и дискомфорта.
Альмагель или Маалокс — препараты на основе гидроокиси алюминия и магния. Они быстро нейтрализуют кислоту, не всасываясь в кровь, что делает их относительно безопасными для применения во время беременности. Это как если бы вы набросили одеяло на огонь — быстро и эффективно.
Гевискон — еще один препарат, который может помочь при изжоге и рефлюксе. Он образует защитную пленку на поверхности содержимого желудка, предотвращая заброс кислоты в пищевод. Это словно волшебный щит, который защищает ваш пищевод от агрессивного воздействия желудочного сока.
Обезболивающие: когда боль становится невыносимой
Иногда боль в поджелудочной может быть настолько сильной, что без обезболивающих не обойтись. Но что можно принимать беременным? Выбор здесь, увы, невелик, но он есть.
Парацетамол — пожалуй, единственный обезболивающий препарат, который считается относительно безопасным при беременности. Он как старый добрый друг, который всегда готов прийти на помощь. Однако даже его нужно принимать с осторожностью и только по назначению врача.
В особо тяжелых случаях врач может назначить более сильные обезболивающие, например, трамадол. Но это уже как тяжелая артиллерия — применяется только в крайних случаях и под строгим медицинским контролем.
Антибиотики: когда без них не обойтись
Если воспаление в поджелудочной вызвано бактериальной инфекцией, может потребоваться применение антибиотиков. Это как вызов спецназа для борьбы с особо опасными преступниками. Но какие антибиотики безопасны для беременных?
Амоксициллин — один из наиболее часто назначаемых антибиотиков при беременности. Он относится к группе пенициллинов и считается относительно безопасным для плода. Это как старый проверенный боец, который знает свое дело.
Цефалоспорины второго и третьего поколения (например, цефуроксим или цефтриаксон) также могут быть назначены беременным при необходимости. Они как современное высокоточное оружие — бьют точно в цель, минимально затрагивая «мирное население».
Инфузионная терапия: когда нужна «перезагрузка»
В тяжелых случаях может потребоваться инфузионная терапия — введение растворов внутривенно. Это как если бы вы дали вашему организму возможность «перезагрузиться», восстановив водно-солевой баланс и обеспечив поступление необходимых питательных веществ.
Физиологический раствор (0,9% раствор хлорида натрия) — самый базовый и безопасный вариант. Он как чистая вода для вашего организма, которая помогает восстановить водный баланс и улучшить микроциркуляцию.
Растворы глюкозы могут быть назначены для обеспечения организма энергией, особенно если пациентка не может нормально питаться из-за болей или тошноты. Это как экстренный паек для вашего тела в трудной ситуации.
Альтернативные методы лечения: когда хочется чего-то «натурального»
Многие будущие мамы стремятся избежать приема «химических» препаратов и ищут более натуральные способы лечения. Что может предложить альтернативная медицина?
Фитотерапия может быть полезным дополнением к основному лечению. Например, ромашковый чай обладает противовоспалительным действием и помогает снять спазмы. Это как если бы вы пригласили добрую фею, которая своим волшебным чаем успокаивает боль.
Имбирь известен своими противовоспалительными свойствами и способностью уменьшать тошноту. Небольшое количество свежего имбиря в чае может помочь облегчить симптомы. Однако важно помнить, что даже натуральные средства могут иметь противопоказания, поэтому перед их применением обязательно проконсультируйтесь с врачом.
Психологическая поддержка: лечим не только тело, но и душу
Нельзя забывать и о психологическом аспекте лечения. Стресс и тревога могут усугублять симптомы и замедлять выздоровление. Что можно сделать в этом направлении?

Техники релаксации, такие как медитация или прогрессивная мышечная релаксация, могут помочь снизить уровень стресса и даже уменьшить восприятие боли. Это как если бы вы научились управлять рубильником, который отвечает за интенсивность болевых ощущений.
Когнитивно-поведенческая терапия может быть полезна для управления хронической болью и связанной с ней тревогой. Это как если бы вы перепрограммировали свой мозг, научив его по-новому реагировать на болевые сигналы.
Помните, что при лечении панкреатита у беременных ключевое значение имеет индивидуальный подход. То, что помогло одной будущей маме, может оказаться неэффективным или даже вредным для другой. Поэтому так важно находиться под наблюдением опытного врача, который сможет подобрать оптимальную схему лечения, учитывающую все особенности вашего состояния.
Народные средства облегчения боли в поджелудочной: Проверенные рецепты
Когда у беременной болит поджелудочная, порой хочется обратиться к бабушкиным рецептам. Ведь что может быть безопаснее и натуральнее, чем проверенные веками народные средства? Однако не спешите бросаться в омут с головой! Даже самые безобидные на первый взгляд травяные сборы могут таить в себе опасность для будущей мамы и малыша. Так что же делать? Как найти золотую середину между эффективностью и безопасностью?
Прежде всего, запомните золотое правило: любое народное средство нужно согласовывать с врачом. Даже если ваша прабабушка клялась, что ромашковый чай лечит все на свете, лучше перестраховаться. Ведь ваш организм сейчас — это сложная система, где каждое изменение может повлиять на развитие малыша. Так что давайте разберемся, какие народные методы могут прийти на помощь, когда поджелудочная решила устроить бунт.
Травяные чаи: природная аптека в вашей чашке
Травяные чаи — пожалуй, самое популярное народное средство при любых недугах. Но что выбрать, когда речь идет о поджелудочной железе? И главное — как не навредить?
Ромашковый чай — настоящий чемпион среди травяных напитков. Он обладает противовоспалительным и спазмолитическим действием, что может помочь унять боль в поджелудочной. Представьте, что каждый глоток этого золотистого напитка — это маленький отряд спасателей, которые спешат на помощь вашему организму. Однако помните: даже ромашку нельзя пить литрами. Две-три чашки в день будет достаточно.

Мятный чай — еще один помощник в борьбе с болью и спазмами. Он словно прохладный ветерок в жаркий день — освежает и успокаивает. Мята помогает снять напряжение не только в мышцах, но и в нервной системе, что особенно важно при стрессе, который часто сопровождает проблемы с поджелудочной. Но будьте осторожны: в больших количествах мята может усилить изжогу, если она у вас есть.
Шиповник — настоящая витаминная бомба, которая может поддержать ваш иммунитет в период борьбы с воспалением. Этот напиток как яркое солнышко для вашего организма — согревает и насыщает полезными веществами. Однако помните, что шиповник может усилить тонус матки, поэтому его употребление обязательно нужно обсудить с врачом.
Отвары и настои: когда чая недостаточно
Иногда простого чая может быть недостаточно, и тогда на помощь приходят более концентрированные формы — отвары и настои. Но что выбрать, когда у беременной болит поджелудочная?
Овсяный отвар — настоящий бальзам для раздраженной поджелудочной. Он обволакивает слизистую желудка и кишечника, снимая воспаление и уменьшая боль. Это как если бы вы укутали свои внутренние органы мягким, теплым одеялом. Приготовить его просто: залейте стакан овса литром воды, доведите до кипения и варите на медленном огне 30 минут. Процедите и пейте теплым по полстакана 3-4 раза в день.
Льняной настой — еще один природный целитель. Семена льна богаты омега-3 жирными кислотами, которые обладают противовоспалительным действием. Представьте, что каждая ложка этого настоя — это маленькая армия, которая идет бороться с воспалением в вашем организме. Залейте столовую ложку семян льна стаканом кипятка, настаивайте час, процедите и пейте по трети стакана за 30 минут до еды.
Соки и смузи: жидкие витамины
Свежевыжатые соки и смузи могут стать настоящим спасением, когда обычная еда кажется слишком тяжелой. Но какие выбрать, чтобы помочь поджелудочной, а не навредить?
Морковный сок — настоящий эликсир здоровья для поджелудочной железы. Он богат бета-каротином, который обладает противовоспалительным действием. Это как если бы вы отправили бригаду ремонтников прямо в свой организм — они приходят и чинят все поломки. Начните с небольшого количества — 50-100 мл в день, постепенно увеличивая до 200 мл.

Картофельный сок — звучит странно, но работает! Он помогает нейтрализовать кислоту в желудке и снимает воспаление. Представьте, что это природный огнетушитель для вашего пищеварительного тракта. Пейте по 100 мл свежевыжатого картофельного сока за 30 минут до еды. Только помните: картофель должен быть свежим и качественным, без признаков прорастания или позеленения.
Смузи из запеченной тыквы и банана — не только вкусно, но и полезно. Тыква богата клетчаткой и бета-каротином, а банан помогает обволакивать слизистую и снимать раздражение. Это как мягкая подушка для вашего желудка. Запеките кусочек тыквы, смешайте в блендере с половиной банана и небольшим количеством воды — и вот у вас уже готов полезный и нежный завтрак.
Компрессы и примочки: наружная помощь
Иногда, чтобы помочь внутренним органам, нужно действовать снаружи. Компрессы и примочки могут стать отличным дополнением к другим методам лечения. Но как их правильно использовать?
Теплый компресс на область поджелудочной железы может помочь снять спазм и уменьшить боль. Это как если бы вы приложили грелку к ушибленному месту — тепло расслабляет и успокаивает. Смочите полотенце в теплой воде (но не горячей!), отожмите и приложите к животу на 15-20 минут. Повторяйте процедуру 2-3 раза в день.
Капустный лист — еще одно проверенное народное средство. Он обладает противовоспалительным действием и помогает снять отек. Представьте, что это природный пластырь, который вытягивает все плохое. Слегка отбейте свежий лист капусты, чтобы он пустил сок, и приложите к животу на 1-2 часа. Но будьте осторожны: если появится раздражение на коже, процедуру нужно прекратить.
Дыхательные упражнения: когда лекарство внутри нас
Иногда самое эффективное лекарство — это наше собственное дыхание. Правильные дыхательные техники могут помочь снять боль, уменьшить стресс и улучшить кровообращение в области поджелудочной железы. Но как дышать правильно?
Диафрагмальное дыхание — это как внутренний массаж для ваших органов. Положите одну руку на грудь, другую на живот. Вдыхайте медленно через нос, позволяя животу подниматься, while грудь остается неподвижной. Затем медленно выдыхайте через рот, чувствуя, как живот опускается. Повторяйте в течение 5-10 минут несколько раз в день.

Дыхание по квадрату — еще одна техника, которая может помочь снять боль и напряжение. Представьте, что вы рисуете квадрат своим дыханием. Вдох на 4 счета, задержка дыхания на 4 счета, выдох на 4 счета и снова задержка на 4 счета. Повторяйте этот цикл в течение нескольких минут, и вы почувствуете, как напряжение уходит.
Массаж: нежное прикосновение для быстрого облегчения
Легкий массаж области живота может помочь улучшить кровообращение и снять спазм. Но как сделать его правильно и безопасно?
Начните с легких круговых движений по часовой стрелке вокруг пупка. Представьте, что вы рисуете спираль, постепенно увеличивая круги. Движения должны быть нежными, без нажима. Это как если бы вы гладили котенка — осторожно и с любовью. Продолжайте в течение 5-10 минут, дыша глубоко и равномерно.
Точечный массаж также может быть эффективен. Найдите точку примерно на два пальца выше пупка и слегка надавливайте на нее в течение 1-2 минут. Это как кнопка перезагрузки для вашего организма — иногда легкое нажатие может принести удивительное облегчение.
Помните, что любые народные методы лечения, особенно во время беременности, должны применяться с осторожностью и только после консультации с врачом. То, что помогло вашей соседке или подруге, может оказаться неэффективным или даже вредным для вас. Каждый организм уникален, и то, что делать, если у беременной болит поджелудочная, должен решать специалист, учитывая все особенности вашего состояния.
Беременность — это удивительное время, полное новых ощущений и открытий. И даже если поджелудочная решила устроить вам небольшую проверку на прочность, помните: это временно. С правильным подходом, заботой о себе и поддержкой близких вы обязательно справитесь с этим испытанием и сможете наслаждаться каждым моментом ожидания чуда.
Профилактика обострений: Как защитить поджелудочную во время беременности
Беременность — удивительное время в жизни женщины, но оно может принести и неожиданные сюрпризы. Одним из таких сюрпризов может стать боль в поджелудочной железе. Что же делать, если у беременной болит поджелудочная? Как справиться с этой проблемой, не навредив будущему малышу? Давайте разберемся вместе.
Прежде всего, важно понимать, что боль в поджелудочной во время беременности — не редкость. Растущий живот оказывает давление на внутренние органы, в том числе и на поджелудочную железу. Кроме того, гормональные изменения могут влиять на ее работу. Но это не значит, что нужно терпеть боль и дискомфорт!
Первое, что нужно сделать при появлении болей — обратиться к врачу. Только специалист может правильно оценить ситуацию и назначить безопасное лечение. Не стоит заниматься самолечением или игнорировать проблему — это может привести к серьезным осложнениям.
Диета — ключ к здоровью поджелудочной
Одним из основных методов борьбы с болью в поджелудочной железе у беременных является правильное питание. Оно должно быть щадящим и легко усваиваемым. Забудьте о жареном, копченом и остром — эти продукты только усугубят ситуацию. Вместо этого сделайте ставку на отварные, тушеные и запеченные блюда.
Что же включить в меню будущей маме с проблемами поджелудочной? Вот несколько идей:
- Нежирные сорта мяса и рыбы
- Овощные супы и пюре
- Каши на воде
- Фрукты и овощи (кроме кислых)
- Кисломолочные продукты
Важно не только что есть, но и как. Питаться нужно часто, но небольшими порциями. Это поможет снизить нагрузку на поджелудочную железу и уменьшить болевые ощущения.
Лекарственная терапия: осторожность прежде всего
Что делать, если у беременной болит поджелудочная, а диета не помогает? В этом случае врач может назначить лекарственную терапию. Но тут нужно быть предельно осторожными — не все препараты безопасны для будущего малыша.
Обычно врачи назначают ферментные препараты, которые помогают поджелудочной железе справляться с ее функциями. Они безопасны для плода и эффективны в борьбе с болью. Однако самостоятельно принимать даже такие препараты нельзя — только по назначению врача!
В некоторых случаях могут быть назначены спазмолитики или обезболивающие. Но их применение должно быть строго контролируемым и кратковременным.
Физическая активность: движение — жизнь
Казалось бы, какая связь между физической активностью и болью в поджелудочной? Самая прямая! Умеренные физические нагрузки помогают улучшить кровообращение, нормализовать обмен веществ и снизить стресс — все это благотворно влияет на работу поджелудочной железы.
Конечно, речь не идет о интенсивных тренировках. Лучше всего подойдут:
- Пешие прогулки на свежем воздухе
- Плавание
- Йога для беременных
- Специальная гимнастика
Важно помнить, что любые физические нагрузки нужно согласовывать с врачом. Он поможет подобрать оптимальный режим, учитывая состояние вашего здоровья и срок беременности.
Стресс — враг поджелудочной
Беременность сама по себе — стресс для организма. А если добавить к этому ежедневные заботы, тревоги и переживания, то нагрузка на все органы, включая поджелудочную железу, возрастает многократно. Поэтому борьба со стрессом — важная часть профилактики и лечения болей в поджелудочной у беременных.
Как же справиться со стрессом? Вот несколько эффективных методов:
- Медитация и дыхательные упражнения
- Ароматерапия (но только с разрешения врача!)
- Общение с близкими и друзьями
- Хобби и творчество
- Прогулки на природе
Помните, что ваше эмоциональное состояние напрямую влияет на здоровье будущего малыша. Поэтому не стесняйтесь обращаться за помощью к психологу, если чувствуете, что сами не справляетесь со стрессом.
Народные средства: быть или не быть?
Многие будущие мамы, столкнувшись с болью в поджелудочной, задаются вопросом: можно ли использовать народные средства? Ответ неоднозначный. С одной стороны, многие травы и настои действительно могут помочь. С другой — их применение во время беременности может быть опасным.
Если вы все же решили попробовать народные методы, обязательно проконсультируйтесь с врачом. Он поможет выбрать безопасные средства и определить правильную дозировку. Самые распространенные народные средства от боли в поджелудочной во время беременности:
- Отвар овса
- Настой ромашки
- Сок алоэ (но только после консультации с врачом!)
- Отвар шиповника
Помните, что даже самое безобидное на первый взгляд средство может навредить будущему малышу. Поэтому без одобрения врача не экспериментируйте со своим здоровьем!
Профилактика — лучшее лечение
Как говорится, лучшее лечение — это профилактика. И это особенно верно в случае с болями в поджелудочной у беременных. Что же можно сделать, чтобы предотвратить проблему?
Во-первых, следите за питанием с самого начала беременности. Не дожидайтесь появления болей, чтобы начать есть правильно. Во-вторых, регулярно посещайте врача и сдавайте все необходимые анализы. Это поможет вовремя выявить проблемы и начать лечение на ранней стадии.
В-третьих, старайтесь вести активный образ жизни, но без фанатизма. Умеренные физические нагрузки помогут поддержать организм в тонусе и улучшить работу всех органов, включая поджелудочную железу.
И наконец, учитесь расслабляться и бороться со стрессом. Позитивный настрой и умение справляться с тревогами — ваши главные помощники в борьбе за здоровье во время беременности.
Помните, что беременность — это не болезнь, а естественное состояние организма. И даже если у вас возникли проблемы с поджелудочной железой, это не повод для паники. При правильном подходе и своевременном обращении к врачу вы легко справитесь с этой проблемой и сможете наслаждаться ожиданием малыша.
Берегите себя и будьте здоровы!
Когда обращаться к врачу: Неотложные состояния при панкреатите у беременных
Беременность — это не только радостное ожидание, но и время, когда организм женщины работает на пределе своих возможностей. И порой этот предел может быть превышен, что приводит к различным осложнениям. Одно из таких осложнений — панкреатит, воспаление поджелудочной железы. Что делать, если у беременной болит поджелудочная? Когда боль — это сигнал к немедленному обращению за медицинской помощью?
Представьте себе, что ваша поджелудочная железа — это своенравная примадонна в театре вашего организма. Обычно она тихонько выполняет свою роль, не привлекая к себе внимания. Но иногда она может устроить настоящую драму, и тогда игнорировать ее уже невозможно. Особенно, когда на кону не только ваше здоровье, но и здоровье будущего малыша.
Красные флажки: когда медлить нельзя
Итак, какие симптомы должны заставить вас немедленно набрать номер скорой помощи или мчаться в больницу? Вот список неотложных состояний, при которых промедление может быть опасным:
- Острая, нестерпимая боль в верхней части живота или под ребрами слева
- Боль, отдающая в спину или левое плечо
- Тошнота и рвота, не приносящие облегчения
- Вздутие живота и чувство распирания
- Повышение температуры тела выше 38°C
- Учащенное сердцебиение и затрудненное дыхание
- Бледность кожных покровов, холодный пот
- Снижение или отсутствие мочеиспускания
Эти симптомы могут указывать на острый панкреатит — состояние, требующее немедленной госпитализации и лечения. Помните, что во время беременности любое заболевание может протекать атипично, поэтому даже при малейших сомнениях лучше перестраховаться и обратиться к врачу.
Мифы и реальность: что нужно знать о панкреатите при беременности
Существует множество мифов о том, что делать, если у беременной болит поджелудочная. Давайте развеем некоторые из них:
- Миф: Панкреатит во время беременности — это приговор. Реальность: При своевременном обращении к врачу и правильном лечении прогноз благоприятный как для матери, так и для ребенка.
- Миф: Нужно терпеть боль, чтобы не навредить ребенку. Реальность: Боль — это сигнал организма о проблеме. Игнорирование боли может привести к серьезным осложнениям.
- Миф: Лечение панкреатита несовместимо с беременностью. Реальность: Современная медицина располагает методами лечения, безопасными для будущего малыша.
Первая помощь: что можно сделать до приезда врача
Если вы заподозрили у себя обострение панкреатита, а скорая помощь еще в пути, вот что можно предпринять:
- Примите удобное положение, лучше всего — сидя с наклоном вперед
- Прекратите прием любой пищи и жидкости
- Приложите холод к области поджелудочной железы (но не напрямую на кожу!)
- Расстегните стесняющую одежду, обеспечьте приток свежего воздуха
- Постарайтесь глубоко и медленно дышать, это поможет уменьшить боль и тревогу
Помните, что эти меры — лишь временное облегчение. Они не заменяют квалифицированной медицинской помощи!
Диагностика: что ждет вас в больнице
Итак, вы в больнице. Что дальше? Врачи проведут ряд исследований, чтобы подтвердить диагноз и оценить степень тяжести состояния:
- Анализ крови (общий и биохимический)
- УЗИ органов брюшной полости
- При необходимости — МРТ (безопасно для плода)
- Мониторинг состояния плода
Не пугайтесь обилия процедур — все они необходимы для того, чтобы обеспечить вам и вашему малышу максимально эффективное и безопасное лечение.
Лечение: баланс между эффективностью и безопасностью
Лечение панкреатита у беременных — это всегда балансирование на тонкой грани между необходимостью купировать воспаление и важностью обеспечить безопасность плода. Что может входить в схему лечения?
- Голод и покой для поджелудочной железы (частичное или полное парентеральное питание)
- Инфузионная терапия для восстановления водно-электролитного баланса
- Спазмолитики для снятия боли (разрешенные при беременности)
- Антибиотики при необходимости (безопасные для плода)
- Ферментные препараты для поддержки работы поджелудочной железы
Длительность лечения зависит от тяжести состояния и может варьироваться от нескольких дней до нескольких недель. Главное — не торопиться и следовать всем рекомендациям врачей.
После выписки: жизнь с новыми правилами
Выписка из больницы — это не конец истории, а начало новой главы. Теперь вам предстоит научиться жить по новым правилам, чтобы избежать повторного обострения. Вот несколько ключевых моментов:
- Диета: строгое соблюдение рекомендаций по питанию
- Режим: регулярные приемы пищи, достаточный сон
- Физическая активность: умеренная, по согласованию с врачом
- Контроль стресса: освоение техник релаксации
- Регулярное наблюдение: частые визиты к гастроэнтерологу и акушеру-гинекологу
Помните, что ваше здоровье сейчас — это здоровье вашего будущего малыша. Поэтому относитесь к себе с особой заботой и вниманием.
Профилактика: как не допустить повторения
Лучшее лечение — это профилактика. Как предотвратить повторное обострение панкреатита? Вот несколько советов:
- Исключите алкоголь и курение (что, впрочем, и так необходимо во время беременности)
- Избегайте жирной, острой и жареной пищи
- Ешьте часто, но небольшими порциями
- Пейте достаточно воды
- Следите за весом — избыточный вес увеличивает нагрузку на поджелудочную железу
- Регулярно проходите обследования
Помните, что ваша поджелудочная железа — как капризный ребенок. Она требует внимания, заботы и правильного обращения. Но если вы научитесь понимать ее «язык» и удовлетворять ее потребности, она ответит вам благодарностью в виде здоровья и хорошего самочувствия.
Психологический аспект: как справиться со стрессом
Не стоит недооценивать влияние стресса на течение панкреатита. Беременность сама по себе — стрессовое состояние для организма, а если к этому добавляются проблемы со здоровьем, уровень тревоги может зашкаливать. Что делать?
- Освойте техники релаксации и медитации
- Занимайтесь йогой для беременных (после консультации с врачом)
- Обратитесь к перинатальному психологу
- Найдите группу поддержки для беременных с подобными проблемами
- Занимайтесь творчеством — это отличный способ снять стресс
Помните, что ваше эмоциональное состояние напрямую влияет на физическое здоровье. Поэтому забота о душевном равновесии — это не роскошь, а необходимость.
В заключение хочется сказать: да, панкреатит во время беременности — это серьезное испытание. Но оно вполне преодолимо при правильном подходе и своевременном обращении за медицинской помощью. Не стоит паниковать, если у вас возникли проблемы с поджелудочной железой. Вместо этого сосредоточьтесь на том, что в ваших силах — соблюдайте рекомендации врачей, следите за своим состоянием и помните, что все это временно. Впереди вас ждет самая главная награда — встреча с вашим малышом. И ради этого стоит пройти через любые испытания!
