Содержание
Узнать пол малыша ДО УЗИ. Реальность?
Предугадать пол будущего ребенка невозможно. Шансы 50 на 50.
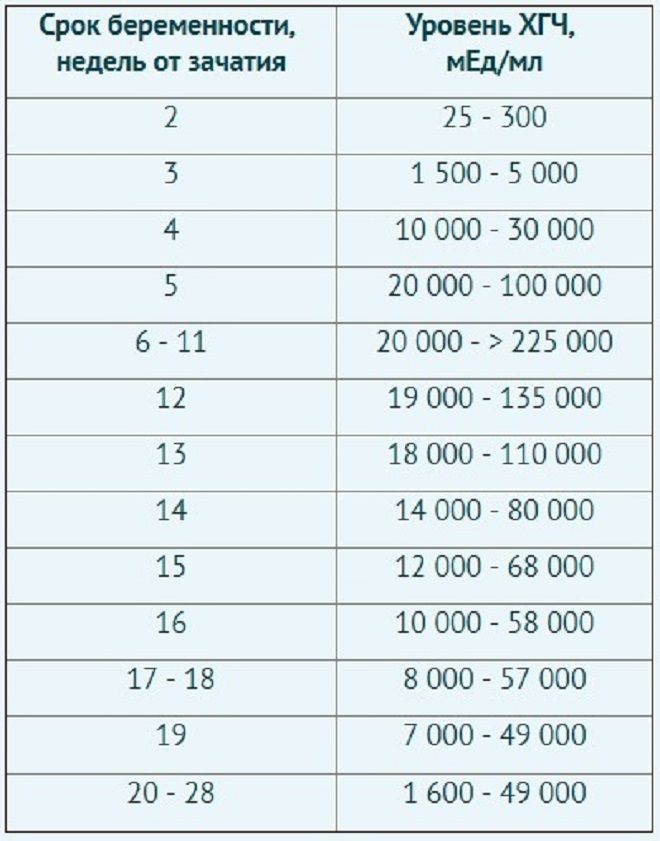
Однако есть неинвазивный медицинский анализ, с помощью которого можно определить пол малыша на ранних сроках беременности — это анализ внеклеточной ДНК плода по крови матери.
Внеклеточная ДНК плода
Открытие наличия внеклеточной фетальной фракции ДНК в крови матери стало прорывом в пренатальных исследований. Все отмершие клетки плода попадают в кровоток матери через плаценту. Именно через ее стенки происходит обмен различными питательными веществами, кислородом и продуктами жизнедеятельности плода. Таким образом фетальная ДНК начинает накапливаться в крови матери уже с первого месяца беременности. Достаточное количество фетальной фракции для проведения неинвазивного исследования достигается не раньше 9 недель беременности. В среднем содержание фетальной фракции у беременных женщин на таком сроке составляет 4-5% Принцип анализа определение пола будущего малыша Свободно-циркулирующая внеклеточная ДНК выделяется из плазмы актикоагулированной цельной крови матери.
Наличие генетического материала мужской Y-хромосомы свидетельствует о плоде с мужским генетическим полом. Отсутствие такого материала свидетельствует о женском генетическом поле плода.
Раньше чем первое УЗИ
Определение пола плода возможно с использованием УЗИ-диагностики, однако данный метод применим с 22-й акушерской недели беременности, а достоверность его не превышает 70%.
Первое УЗИ проводят с 11-ти недель беременности, однако вероятность определения пола слишком мала. Неинвазивный тест на определение пола плода можно проводить уже с 9-ти недель беременности.
Точность такого анализа 99%
На точность может повлиять низкое содержание фетальной фракции в крови матери, поэтому не рекомендуется торопиться и проводить анализ раньше 9-ти акушерских или 7-ми эмбриональных недель беременности.
Безопасность 100%
Неинвазивный метод полностью безопасен для мамы и будущего малыша, т.к. подразумевает обычный забор венозной крови.
Для сравнения:
• инвазивная диагностика (амниоцентез, биопсия ворсин хориона) — от 0,8 до 2% риска гибели плода;
• ультразвуковая диагностика — редко, но все-таки бывают дискомфортные ощущения, тонус матки.
Результат через 5 дней
Результат неинвазивного теста, как правило, готов в течение 5 рабочих дней или раньше.
Для сравнения:
• ультразвуковая диагностика — вы можете узнать пол будущего малыша прямо на приеме у врача, а можете и до самых родов не знать кого вы вынашиваете — мальчика или девочку;
• инвазивный метод (амниоцентез) — до двух недель; инвазивный метод (биопсия ворсин хориона) — от 4 дней до двух недель.
Анализы на определение пола доступны в нашей клинике, подробнее по ссылке
анатомофизиологические предпосылки, обоснование, дефиниции и патогенетические механизмы
В последние годы пристальное внимание акушеров-гинекологов, репродуктологов и патологоанатомов привлекают самые ранние сроки беременности — эмбриональный период, от начала имплантации до конца 8-й недели после оплодотворения.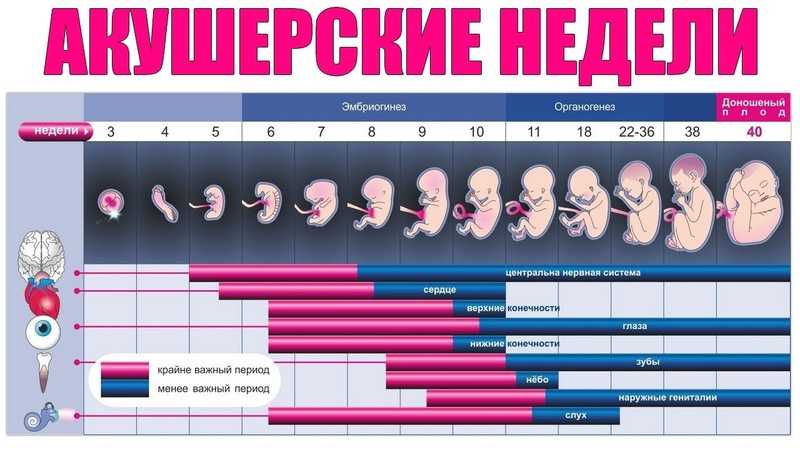 Появились первые зарубежные [1, 2] и отечественные [3, 4] руководства по эмбриональной медицине, что обусловлено рядом объективных причин. Во-первых, наличие большого количества ранних потерь беременности, составляющих до 12-15% всех желанных беременностей, что реально снижает репродуктивный потенциал населения России. Во-вторых, относительные неудачи экстракорпорального оплодотворения, поскольку успешными становятся лишь 20-30% всех попыток. В-третьих, в акушерских клиниках появились современные эхо-сканеры, позволяющие визуализировать экстраэмбриональные структуры (хориальный и желточный мешки, экстраэмбриональный целом, амниальная полость, ранняя плацента и пуповина), которые вначале опережают в развитии эмбриона, но в конце III триместра некоторые из них редуцируются.
Появились первые зарубежные [1, 2] и отечественные [3, 4] руководства по эмбриональной медицине, что обусловлено рядом объективных причин. Во-первых, наличие большого количества ранних потерь беременности, составляющих до 12-15% всех желанных беременностей, что реально снижает репродуктивный потенциал населения России. Во-вторых, относительные неудачи экстракорпорального оплодотворения, поскольку успешными становятся лишь 20-30% всех попыток. В-третьих, в акушерских клиниках появились современные эхо-сканеры, позволяющие визуализировать экстраэмбриональные структуры (хориальный и желточный мешки, экстраэмбриональный целом, амниальная полость, ранняя плацента и пуповина), которые вначале опережают в развитии эмбриона, но в конце III триместра некоторые из них редуцируются.
Однако эмбриональная медицина как отдельная отрасль здравоохранения в России только складывается и реализуется лишь в отдельных центрах. По аналогии с плацентарной недостаточностью III триместра многие авторы пытаются перенести ее патоморфологические критерии на патологию ранней плаценты. Это принципиальная ошибка, поскольку нельзя ограничиваться описанием изменений формирующихся ворсин. Следует тщательно анализировать также экстраэмбриональные структуры, маточно-плацентарную область (зона контакта так называемых якорных ворсин с эндометрием), а также париетальный эндометрий, т.е. все компоненты соскоба из полости матки после неразвивающейся беременности или раннего выкидыша.
Это принципиальная ошибка, поскольку нельзя ограничиваться описанием изменений формирующихся ворсин. Следует тщательно анализировать также экстраэмбриональные структуры, маточно-плацентарную область (зона контакта так называемых якорных ворсин с эндометрием), а также париетальный эндометрий, т.е. все компоненты соскоба из полости матки после неразвивающейся беременности или раннего выкидыша.
Цель данного обзора — обозначить анатомо-физиологические предпосылки, обосновать рациональную терминологию патологии плаценты в III триместре и определить ее основные патофизиологические механизмы.
Анатомофизиологические предпосылки. На рубеже XX и XXІ веков взгляды на условия развития и микроокружение эмбриона человека подверглись существенному пересмотру. Если раньше считалось, что первые стадии развития эмбриона обеспечивались гистотрофным типом питания и по мере выявления материнских эритроцитов в лакунах плаценты начинался гемохориальный обмен, то сейчас доказано анаэробное развитие эмбриона и закладок основных его органов.
Все экстраэмбриональные структуры непроницаемы для кислорода, а со стороны преформированных маточных спиральных артерий кровоток блокируется специальными цитотрофобластическими пробками, сквозь которые фильтруется плазма, но не проникают материнские эритроциты [5]. Следовательно, микроокружение эмбриона человека препятствует прямому попаданию кислорода и его опасных метаболитов в амниотическую жидкость. Прямые измерения парциального давления кислорода на 7-й неделе после оплодотворения показали, что в плаценте этот показатель составил около 20 мм вод.
60 мм вод.ст. [6-8]. С помощью прицельной пункции амниотической полости, экстраэмбрионального целома, крови матери, а также субстрата ворсин и окружающего эндометрия перед медицинским абортом [4, 9-11] показано, что питание эмбриона осуществляется за счет временных и постоянных путей диффузии плацентарных и эндометриальных белков, факторов роста, гормонов, гликогена и других биоэнергетических субстанций. Последовательно формируются резервуары для белков и продуктов анаэробного обмена, вначале это экстраэмбриональный целом, затем его вытесняет быстро растущая амниотическая полость. Указанная строгая очередность перестройки экстраэмбриональных структур и диффузионных потоков обеспечивает адекватность обменных процессов у эмбриона, когда еще нет стабильной маточно-плацентарной циркуляции крови.
Только с 9-10-й недели после оплодотворения постепенно исчезают трофобластические пробки, появляется и заметно увеличивается приток артериальной крови из зияющих устьев спиральных артерий в межворсинчатое пространство почти сформированной плаценты.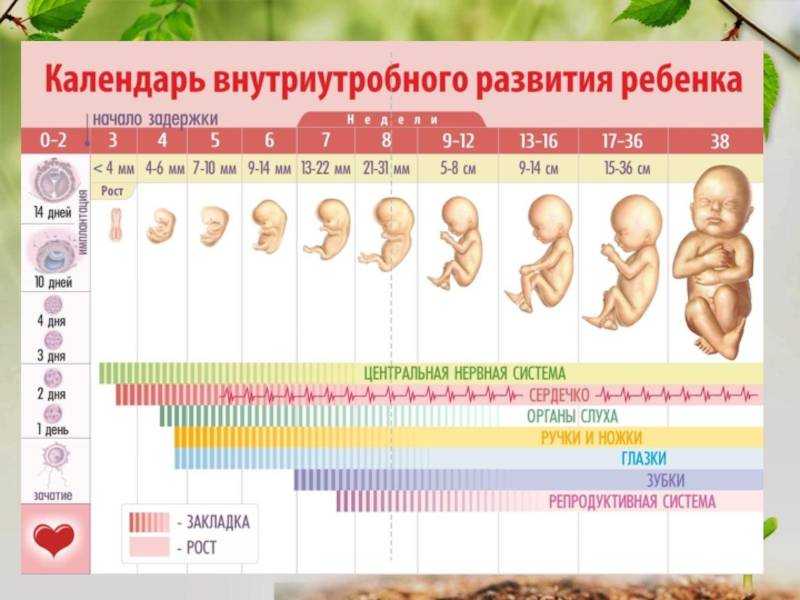 Материнская кровь омывает эпителиальный покров ворсин с множественными микроворсинами (щеточная кайма) и начинается постоянный, более эффективный гемохориальный обмен через плацентарный барьер кислорода, углекислого газа, аминокислот, глюкозы, микроэлементов и других необходимых плоду биопродуктов. Столь сложный генетически детерминированный переход от диффузионного, анаэробного к гемохориальному типу обмена может сопровождаться разнообразными нарушениями в отдельных компонентах складывающейся репродуктивной системы мать-экстраэмбриональные структуры-эмбрион, что часто приводит к недостаточности плаценты и ранней потере беременности.
Материнская кровь омывает эпителиальный покров ворсин с множественными микроворсинами (щеточная кайма) и начинается постоянный, более эффективный гемохориальный обмен через плацентарный барьер кислорода, углекислого газа, аминокислот, глюкозы, микроэлементов и других необходимых плоду биопродуктов. Столь сложный генетически детерминированный переход от диффузионного, анаэробного к гемохориальному типу обмена может сопровождаться разнообразными нарушениями в отдельных компонентах складывающейся репродуктивной системы мать-экстраэмбриональные структуры-эмбрион, что часто приводит к недостаточности плаценты и ранней потере беременности.
Дефиниции. В патологической анатомии для обозначения патологических изменений плаценты в III триместре используются различные термины, например «первичная плацентарная недостаточность», предложенный М.Ф. Федоровой и Е.П. Калашниковой [12]; она развивается до 16-й недели и связана с нарушениями процессов имплантации, плацентации и эмбриогенеза. В дальнейшем были использованы другие обозначения, такие как «ранняя эмбриоплацентарная недостаточность» [13], «первичная гипо- и гиперпластическая недостаточность» [14]. Если следовать эмбриологическим канонам и учитывать огромный массив знаний по эмбриологии человека, то более оптимальным термином является «эмбриохориальная недостаточность» (ЭХН), поскольку эмбрион (греч.) — это продукт зачатия до конца 8-й недели после оплодотворения, а хорион — наружная оболочка эмбриона с окружающими ворсинами [15] . Хорион подразделяется на гладкий, обращенный в сторону просвета матки, и ветвистый, расположенный на противоположном полюсе мешка, с более длинными и многочисленными генерациями ворсин (ранняя плацента). В конце III триместра завершается процесс плацентации: из ветвистого хориона формируется 12-15 примитивных котиледонов с хориальной пластиной, отходящими опорными ворсинами с множественными ветвями, возникших под влиянием первой волны цитотрофобластической инвазии, открываются устья спиральных артерий.
В дальнейшем были использованы другие обозначения, такие как «ранняя эмбриоплацентарная недостаточность» [13], «первичная гипо- и гиперпластическая недостаточность» [14]. Если следовать эмбриологическим канонам и учитывать огромный массив знаний по эмбриологии человека, то более оптимальным термином является «эмбриохориальная недостаточность» (ЭХН), поскольку эмбрион (греч.) — это продукт зачатия до конца 8-й недели после оплодотворения, а хорион — наружная оболочка эмбриона с окружающими ворсинами [15] . Хорион подразделяется на гладкий, обращенный в сторону просвета матки, и ветвистый, расположенный на противоположном полюсе мешка, с более длинными и многочисленными генерациями ворсин (ранняя плацента). В конце III триместра завершается процесс плацентации: из ветвистого хориона формируется 12-15 примитивных котиледонов с хориальной пластиной, отходящими опорными ворсинами с множественными ветвями, возникших под влиянием первой волны цитотрофобластической инвазии, открываются устья спиральных артерий.
Структурная несостоятельность эндометрия реализуется либо рано, во время «окна имплантации» (20-24-й день нормального цикла) в маточном эпителии, либо в течение первых недель гестации при дефиците прогестерона или его рецепторов, когда возникает незавершенная децидуализация стромальных клеток эндометрия. Выявляются рыхлые поля предецидуальных клеток, характерных для поздней секреторной фазы цикла
Дисхроноз развития экстраэмбриональных структур в виде поверхностного погружения бластоцисты с последующей ее ранней элиминацией — «менструальный аборт», а также отсутствие желточного мешка, дефекты развития хориального мешка, анэмбриония. Главный итог — ранняя остановка развития плаценты, без надлежащей васкуляризации ворсин с блоком на этапе васкулогенеза (см. рисунок, б),Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. б — очаги васкулогенеза в ворсинах при неразвивающейся беременности на 8-й неделе после оплодотворения. Иммуномаркер CD34. ×100. что приводит к задержке развития плацентарно-эмбрионального кровотока, формирования сердца эмбриона и к остановке его сердцебиений, констатированных при УЗИ.
Недостаточность цитотрофобластической инвазии, которая условно подразделяется на начальную и первую волны. Первичные ворсины, состоящие из цитотрофобласта и синцитиальных комплексов, составляют трофобластический щит, разрушающий эндометриальные железы с излитием их секрета в строму эндометрия; тем самым облегчается погружение бластоцисты вглубь эндометрия и осуществляется диффузионный тип питания эмбриона. Первая волна цитотрофобластической инвазии ориентирована уже на спиральные артерии, которые подвергаются гестационной перестройке за счет протеолиза гладкомышечной оболочки и эластических мембран и замещения их фибриноидом [16]. Столь же важным элементом является формирование трофобластических пробок, закрывающих расширенный просвет спиральных артерий. Если образуются неполные пробки, то материнская артериальная кровь проникает в межворсинчатое пространство, неся с собой опасные радикалы кислорода (см. далее).
Первая волна цитотрофобластической инвазии ориентирована уже на спиральные артерии, которые подвергаются гестационной перестройке за счет протеолиза гладкомышечной оболочки и эластических мембран и замещения их фибриноидом [16]. Столь же важным элементом является формирование трофобластических пробок, закрывающих расширенный просвет спиральных артерий. Если образуются неполные пробки, то материнская артериальная кровь проникает в межворсинчатое пространство, неся с собой опасные радикалы кислорода (см. далее).
Нестыковка гемодинамических связей капилляров ворсин плаценты через пуповину с кровеносной системой эмбриона. В соответствии с генетической программой васкуло- и ангиогенез осуществляются в строгой последовательности: первая локализация (16-17-й день после оплодотворения) — васкулогенез и эритропоэз в стенке желточного мешка; вторая (18-19-й день) — в тканях эмбриона; два эти вначале изолированные сегменты затем объединяются в общий желточно-эмбриональный кровоток. И, наконец, третья локализация васкулогенеза (20-22-й день) — в мезенхиме стенки хориального мешка и строме вторичных ворсин в виде изолированных островков ангиобластов и тяжей. Далее начинается самый сложный процесс соединения желточно-эмбрионального кровотока через короткую пуповинную ножку с общей капиллярной сетью стенки хориального мешка и ворсин. Первый, нитевидный плацентарно-пуповинно-эмбриональный кровоток фиксируется в конце 7-й недели, когда в капиллярах ворсин появляются эритроциты, образующиеся в очагах кроветворения печени эмбриона. Любая нестыковка вышеперечисленных данных, вначале изолированных сосудистых сегментов приводит к гибели эмбриона (или неразвивающейся беременности).
Далее начинается самый сложный процесс соединения желточно-эмбрионального кровотока через короткую пуповинную ножку с общей капиллярной сетью стенки хориального мешка и ворсин. Первый, нитевидный плацентарно-пуповинно-эмбриональный кровоток фиксируется в конце 7-й недели, когда в капиллярах ворсин появляются эритроциты, образующиеся в очагах кроветворения печени эмбриона. Любая нестыковка вышеперечисленных данных, вначале изолированных сосудистых сегментов приводит к гибели эмбриона (или неразвивающейся беременности).
Гемореологические нарушения — образование ретрохориальной гематомы, обусловленное возрастающим притоком материнской крови к эпителиальному покрову ворсин и отставанием формирования противосвертывающей системы в микроворсинах синцитиотрофобласта, т.е. в щеточной кайме, что сопровождается снижением (см. рисунок, в),Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. в — мозаичность иммуноэкспрессии PLAP в зоне ретрохориальной гематомы, ×100. отсутствием или локальной гиперэкспрессией плацентарной щелочной фосфатазы [17]. Меняются условия местного гемостаза с возникновением гиперкоагуляции материнской крови и способностью к тромбообразованию, что особенно характерно для антифосфолипидного синдрома [18]. При этом нарушается и гормональная функция синцитиотрофобласта; в зоне гематомы снижается иммуноэкспрессия β-hGC-хорионического гонадотропина человека (см. рисунок, г).Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. г — слабая иммуноэкспрессия антител против β-ХГЧ в зоне ретрохориальной гематомы, ×100. Следует помнить и о возможной роли полиморфизма генов свертывающей системы крови [19].
отсутствием или локальной гиперэкспрессией плацентарной щелочной фосфатазы [17]. Меняются условия местного гемостаза с возникновением гиперкоагуляции материнской крови и способностью к тромбообразованию, что особенно характерно для антифосфолипидного синдрома [18]. При этом нарушается и гормональная функция синцитиотрофобласта; в зоне гематомы снижается иммуноэкспрессия β-hGC-хорионического гонадотропина человека (см. рисунок, г).Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. г — слабая иммуноэкспрессия антител против β-ХГЧ в зоне ретрохориальной гематомы, ×100. Следует помнить и о возможной роли полиморфизма генов свертывающей системы крови [19].
Воспалительная местная реакция (эндометрит) нарушает оптимальное соотношение провоспалительных (Th2) и противовоспалительных (Th3) цитокинов в месте имплантации. Преобладание провоспалительных цитокинов (TNF-α, IL-1β и др.) приводит к феномену эмбриотоксичности, активизирует апоптоз инвазирующего цитотрофобласта. Это хорошо видно с помощью иммуномаркера цитокератина-8 (С8). Интерстициальный цитотрофобласт из основания якорной ворсины (см. рисунок, д)Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. д — неразвивающаяся беременность — основание якорной ворсины с отсутствием инвазии цитотрофобласта в зону воспаления (иммуномаркер цитокератин-8). не проникает в зону воспаления, что ведет к элиминации продукта зачатия. Для развития физиологической беременности ключевую роль играют противовоспалительные цитокины (TGF-β, IL-4, 10), которые предупреждают агрессию материнских лимфоцитов и макрофагов, направленную на эмбрион и экстраэмбриональные структуры. Важен практический вывод: даже умеренный острый, персистирующий или хронический эндометрит «сдерживает» цитотрофобластическую инвазию и приводит к ранней потере беременности, чаще всего в виде спонтанного аборта.
Это хорошо видно с помощью иммуномаркера цитокератина-8 (С8). Интерстициальный цитотрофобласт из основания якорной ворсины (см. рисунок, д)Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. д — неразвивающаяся беременность — основание якорной ворсины с отсутствием инвазии цитотрофобласта в зону воспаления (иммуномаркер цитокератин-8). не проникает в зону воспаления, что ведет к элиминации продукта зачатия. Для развития физиологической беременности ключевую роль играют противовоспалительные цитокины (TGF-β, IL-4, 10), которые предупреждают агрессию материнских лимфоцитов и макрофагов, направленную на эмбрион и экстраэмбриональные структуры. Важен практический вывод: даже умеренный острый, персистирующий или хронический эндометрит «сдерживает» цитотрофобластическую инвазию и приводит к ранней потере беременности, чаще всего в виде спонтанного аборта.
Оксидативный стресс возникает в результате преждевременного (на 5, 6 и 7-й неделе после оплодотворения) и чрезмерного притока артериальной материнской крови в раннюю плаценту из-за неполной блокады трофобластическими пробками просветов маточно-плацентарных артерий (см. рисунок, е).Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. е — неразвивающаяся беременность — неполная цитотрофобластическая пробка и материнские эритроциты в просвете спиральной артерии. Окраска гематоксилином и эозином. ×200. В межворсинчатое пространство проникают токсические метаболиты кислорода, вызывающие структурные повреждения синцитиотрофобласта — основного продуцента плацентарных гормонов и белков. В экстремальных условиях гипероксии появляются вакуолизация цитоплазмы, урежение и укорочение микроворсинок синцитиотрофобласта, дезорганизация его митохондрий и гибель эмбриона [20].
рисунок, е).Рисунок 1. Основные морфологические эквиваленты эмбриохориальной недостаточности. е — неразвивающаяся беременность — неполная цитотрофобластическая пробка и материнские эритроциты в просвете спиральной артерии. Окраска гематоксилином и эозином. ×200. В межворсинчатое пространство проникают токсические метаболиты кислорода, вызывающие структурные повреждения синцитиотрофобласта — основного продуцента плацентарных гормонов и белков. В экстремальных условиях гипероксии появляются вакуолизация цитоплазмы, урежение и укорочение микроворсинок синцитиотрофобласта, дезорганизация его митохондрий и гибель эмбриона [20].
Вторичные изменения вызваны тем, что после гибели эмбриона ранняя плацента некоторое время существует обособленно, что объясняет появление выраженного отека, мелкодисперсной трансформации, гиалиноза и даже склероза или кальцификации стромы ворсин [21]. Эти изменения ворсин в материале соскоба из полости матки трудно дифференцировать с картиной инволюции ворсин, бывших ранее в составе гладкого хориона.
Компенсаторные реакции возможны даже в столь ранние сроки беременности. Микроокружение эмбриона, в частности ворсины плаценты, способны нейтрализовать неблагоприятные внутренние и внешние воздействия. Так, в их строме одновременно с васкулогенезом появляются плацентарные макрофаги (клетки Кащенко-Гофбауэра), а также первые эритроциты — эритробласты, обладающие в несколько раз большим сродством к кислороду и способностью передавать его в ткани эмбриона. По мере развития ангиогенеза наблюдается приближение капиллярной сети к эпителию ворсин, что облегчает диффузионные процессы в этом гестационном периоде. Существуют и другие компенсаторные реакции для сохранения микроокружения эмбриона, которые еще предстоит исследовать.
Важным в теоретическом и практическом отношении разделом эмбриональной медицины является эмбриохориальная недостаточность (ЭХН), определяемая как сочетанная патологическая реакция экстраэмбриональных структур и эмбриона в ответ на различные экзо- и эндогенные нарушения материнского организма и приводящая к ранним потерям беременности. ЭХН реализуется при ранних менструальных абортах, спонтанных выкидышах и неразвивающейся беременности в течение I триместра. Вследствие опережающего роста экстраэмбриональных структур (хориальный и желточный мешки, целомическая и амниотическая мембраны), составляющих вместе с децидуализированным близлежащим эндометрием микроокружение эмбриона человека, а также наличия разнонаправленных диффузионных потоков эндометриальных и плацентарных белков в анаэробных условиях ЭХН существенно отличается в структурном отношении от хронической плацентарной недостаточности II и III триместров. Для разработки патоморфологических критериев ЭХН необходимы четкие корреляции с прижизненной УЗИ-картиной экстраэмбриональных структур, чтобы совместить целостную эхо-анатомию хориального и желточного мешков, желточно-эмбрионального и пуповинного кровообращения, а также межворсинчатого кровотока с морфологией разрозненного соскоба из полости матки. Только такой комплексный подход позволит точнее определить перспективные направления для целенаправленной клинико-лабораторной диагностики семейных пар и осуществить индивидуальную предгравидарную подготовку женщин к следующей полноценной беременности.
ЭХН реализуется при ранних менструальных абортах, спонтанных выкидышах и неразвивающейся беременности в течение I триместра. Вследствие опережающего роста экстраэмбриональных структур (хориальный и желточный мешки, целомическая и амниотическая мембраны), составляющих вместе с децидуализированным близлежащим эндометрием микроокружение эмбриона человека, а также наличия разнонаправленных диффузионных потоков эндометриальных и плацентарных белков в анаэробных условиях ЭХН существенно отличается в структурном отношении от хронической плацентарной недостаточности II и III триместров. Для разработки патоморфологических критериев ЭХН необходимы четкие корреляции с прижизненной УЗИ-картиной экстраэмбриональных структур, чтобы совместить целостную эхо-анатомию хориального и желточного мешков, желточно-эмбрионального и пуповинного кровообращения, а также межворсинчатого кровотока с морфологией разрозненного соскоба из полости матки. Только такой комплексный подход позволит точнее определить перспективные направления для целенаправленной клинико-лабораторной диагностики семейных пар и осуществить индивидуальную предгравидарную подготовку женщин к следующей полноценной беременности. Реальное сокращение ранних потерь желанных беременностей — это конкретный шаг к восстановлению репродуктивного потенциала населения России.
Реальное сокращение ранних потерь желанных беременностей — это конкретный шаг к восстановлению репродуктивного потенциала населения России.
Конфликт интересов отсутствует.
Интерактивный инструмент: от эмбриона до ребенка за 9 месяцев
Перейти к основной навигации Перейти к основному содержанию Перейти к нижнему колонтитулу За Медикэр За Провайдеры За Брокеры За Работодатели испанский Для отдельных лиц и семей: Для отдельных лиц и семей Медицинский Стоматологический Другие дополнительные Узнайте о покрытии через работу Как купить медицинскую страховку Виды стоматологического страхования Открытая регистрация против специальной регистрации Посмотреть все темы Купить планы Medicare Руководство для участников Найти доктора Войти в myCignaГлавнаяЦентр знанийВелнес-библиотека Интерактивный инструмент: от эмбриона до ребенка за 9 месяцев
Что этот инструмент поможет вам узнать?
Вы можете использовать этот инструмент, чтобы обнаружить удивительные изменения, происходящие во время беременности. Взгляните крупным планом на ранний эмбрион. Посмотрите, как сильно меняется растущий плод каждые несколько недель. Читайте о новинках каждый месяц.
Взгляните крупным планом на ранний эмбрион. Посмотрите, как сильно меняется растущий плод каждые несколько недель. Читайте о новинках каждый месяц.
Вы также найдете ссылки на полезную информацию о тестировании, здоровой беременности, преждевременных родах, родах и родоразрешении.
Мур К.Л. и др. (2013). «Развитие человека: клинически ориентированная эмбриология», 9-е изд. Филадельфия: Эльзевир Сондерс.
Кэмпбелл С. (2004 г.). «Смотри, как я расту!» Нью-Йорк: Издательство Св. Мартина.
Что следует помнить?Что следует помнить?
Все дети разные. Каждый плод индивидуален. Изображения, которые мы вам показываем, могут не соответствовать цвету вашей кожи или точному размеру вашего плода. Но они многое говорят вам о том, что происходит во время беременности.
Этот инструмент связывает вас с информацией о пренатальных тестах. Некоторые из этих тестов являются новыми и доступны не везде. Например, в вашем городе может не быть биопсии ворсин хориона или ультразвукового исследования воротникового пространства. Хорошей новостью является то, что у вас все еще есть отличные варианты, такие как тройной или четырехкратный просмотр.
Например, в вашем городе может не быть биопсии ворсин хориона или ультразвукового исследования воротникового пространства. Хорошей новостью является то, что у вас все еще есть отличные варианты, такие как тройной или четырехкратный просмотр.
Что дальше?
Если вы беспокоитесь о своей беременности, обязательно поговорите со своим врачом или медсестрой-акушеркой.
Узнать больше
Эта информация не заменяет консультацию врача. Healthwise, Incorporated отказывается от каких-либо гарантий или ответственности за использование вами этой информации. Использование вами этой информации означает, что вы согласны с Условиями использования. Узнайте, как мы разрабатываем наш контент.
Чтобы узнать больше о Healthwise, посетите сайт Healthwise.org.
© 1995-2022 Healthwise, Incorporated. Healthwise, Healthwise для каждого решения о здоровье и логотип Healthwise являются товарными знаками Healthwise, Incorporated.
Связанные ссылки
Недоношенный ребенокВрожденные дефекты ТестированиеРоды и родыБеременностьЭмбриология, рука — StatPearls — Книжная полка NCBI
Джесси А. Рашевски; Парамвир Сингх.
Информация об авторе
Последнее обновление: 8 августа 2022 г.
Введение
Развитие плода происходит в три отдельные фазы. Первый — это преддифференцировочный период на 1-й и 2-й неделях, второй — эмбриональный период, который происходит с 3-й по 8-ю недели, и последний — фетальный период с 9-й недели.вперед. В эмбриональный период дифференцировка морфологии верхней конечности начинается с зачатка верхней конечности примерно на пятой неделе. Скопление клеток, расположенных на дистальном гребне зачатка конечности, определяемом как апикальный эктодермальный гребень, обеспечивает дифференцировку и процесс созревания верхней конечности.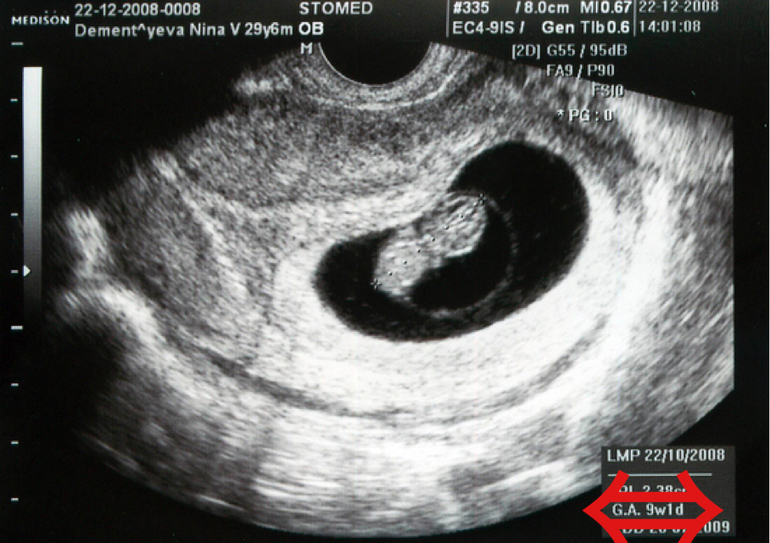 Мезенхимальная конденсация приводит к образованию хрящевых аналогов плеча, руки, предплечья и, в конечном счете, кисти. Эти аналоги окостеневают в кости примерно на 6-й неделе беременности. Первичные очаги окостенения начинают формировать длинные кости уже на 12-й неделе. Последовательное образование полостей в суставах, уплотнение связок и дифференцировка мышц начинается сначала в плечевом поясе и продолжается дистально до кисти в течение 6-8 недель. После 9недель кости, суставы, связки и мышцы проходят дальнейшее созревание.
Мезенхимальная конденсация приводит к образованию хрящевых аналогов плеча, руки, предплечья и, в конечном счете, кисти. Эти аналоги окостеневают в кости примерно на 6-й неделе беременности. Первичные очаги окостенения начинают формировать длинные кости уже на 12-й неделе. Последовательное образование полостей в суставах, уплотнение связок и дифференцировка мышц начинается сначала в плечевом поясе и продолжается дистально до кисти в течение 6-8 недель. После 9недель кости, суставы, связки и мышцы проходят дальнейшее созревание.
Развитие
Морфогенез руки плода, который происходит между 6 и 14 неделями беременности, можно описать тремя отдельными фазами развития: формой от 6 до 10 недель, появлением складок от 10 до 13 недель и образованием гребни с 13-й недели и далее. В первой фазе, в течение 6-10 недель, вся внешняя форма руки формируется во время беременности. Первая организация кисти возникает при асимметрии зачатка кисти и развитии щели для большого пальца уже в 6 недель.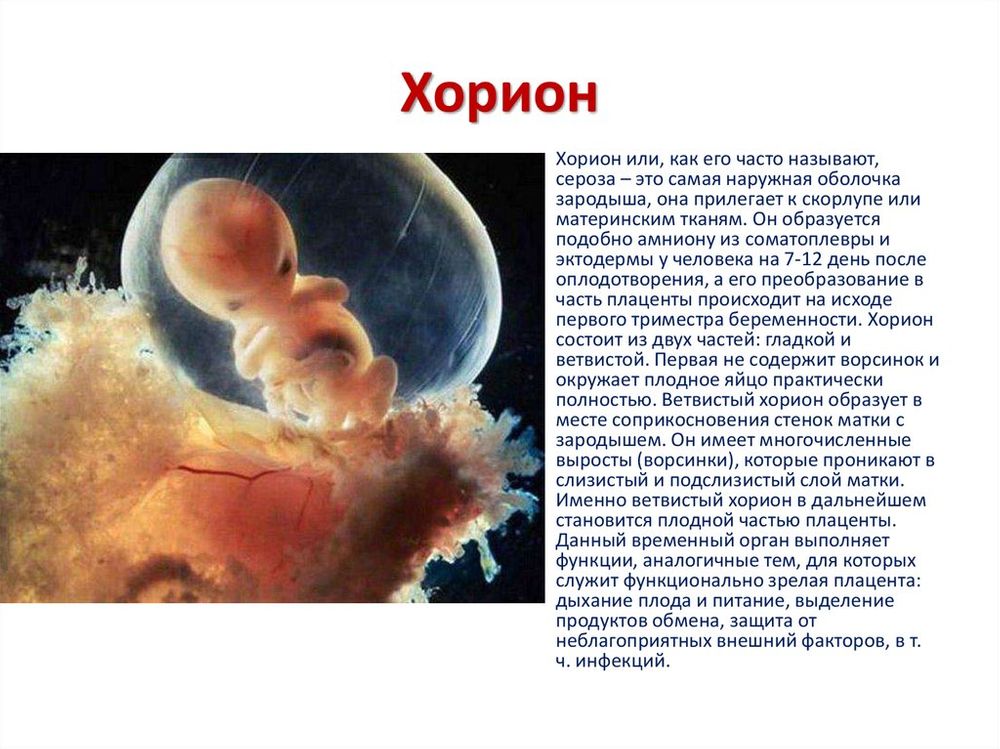 В течение 8–10 недель все пальцы достигают одной и той же пространственной плоскости, а большой палец вращается. Это также происходит, когда конфигурация пальцевых и межпальцевых подушечек приобретается постепенно и становится заметной. На второй фазе развития оба типа подушечек начинают регрессировать. Межпальцевые подушечки начинают регрессировать примерно на 11-й неделе, а пальцевые подушечки следуют в течение 13-й недели. Примерно через 10 недель область тенара появляется из-за противопоставления большого пальца, что создает первый вид складки. В следующие 2 недели становятся более заметными проксимальные ладонные и дистальные ладонные складки. Последней появляется складка межфалангового сгибания. Появление гребней определяет третью фазу. Сканирующий электронный микроскоп может изобразить образование гребней, начинающихся с латеральной части кончиков пальцев, которые идут от латерального к дистальному, а затем от медиального к проксимальному положению на конце фаланги.[2]
В течение 8–10 недель все пальцы достигают одной и той же пространственной плоскости, а большой палец вращается. Это также происходит, когда конфигурация пальцевых и межпальцевых подушечек приобретается постепенно и становится заметной. На второй фазе развития оба типа подушечек начинают регрессировать. Межпальцевые подушечки начинают регрессировать примерно на 11-й неделе, а пальцевые подушечки следуют в течение 13-й недели. Примерно через 10 недель область тенара появляется из-за противопоставления большого пальца, что создает первый вид складки. В следующие 2 недели становятся более заметными проксимальные ладонные и дистальные ладонные складки. Последней появляется складка межфалангового сгибания. Появление гребней определяет третью фазу. Сканирующий электронный микроскоп может изобразить образование гребней, начинающихся с латеральной части кончиков пальцев, которые идут от латерального к дистальному, а затем от медиального к проксимальному положению на конце фаланги.[2]
Клеточный
Формирование пальцев на руке происходит на клеточном уровне.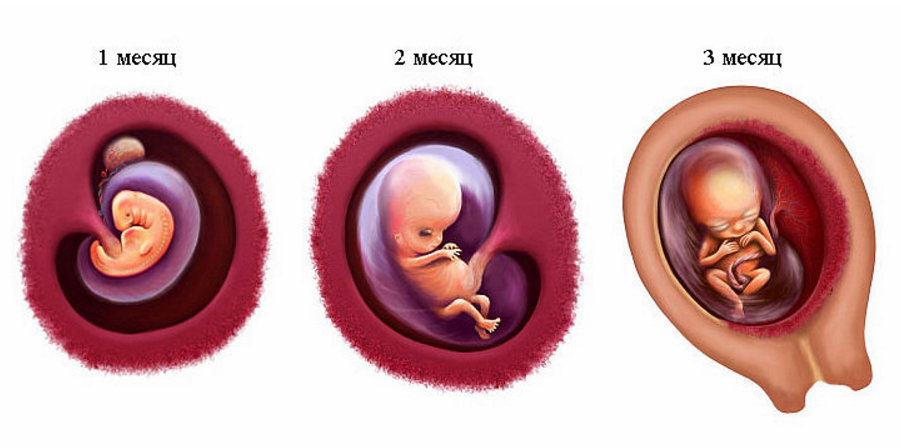 Промежутки между каждым пальцем формируются в направлении от дистального к проксимальному в результате двух различных процессов апоптоза и гибели клеток, опосредованной лизосомальными ферментами. На ранних фазах гибели клеток межпальцевая мезенхима экспрессирует высокие уровни каспаз-активируемых ДНКаз и нормальные уровни лизосомальных ДНКаз. Другими словами, апоптоз происходит на гораздо более высоких уровнях, чем лизосомальная деградация, опосредованная ферментами. Апоптоз возникает, когда различные стимулы смерти или проапоптотические белки стимулируют митохондрии внутри клеток. Митохондрии выделяют цитохром С, который в сочетании с различными факторами внутри клетки создает «апоптосому». Это приводит к активации множества различных каспаз, которые в конечном итоге активируют ДНКазы. Фрагментированные клетки удаляются путем фагоцитоза. Во время поздних фаз клеточной гибели гены, кодирующие супероксиддисмутазу и каталазу, подавляются. Другими словами, апоптоз происходит на очень низких уровнях, а опосредованная ферментами лизосомальная деградация происходит на высоких уровнях.
Промежутки между каждым пальцем формируются в направлении от дистального к проксимальному в результате двух различных процессов апоптоза и гибели клеток, опосредованной лизосомальными ферментами. На ранних фазах гибели клеток межпальцевая мезенхима экспрессирует высокие уровни каспаз-активируемых ДНКаз и нормальные уровни лизосомальных ДНКаз. Другими словами, апоптоз происходит на гораздо более высоких уровнях, чем лизосомальная деградация, опосредованная ферментами. Апоптоз возникает, когда различные стимулы смерти или проапоптотические белки стимулируют митохондрии внутри клеток. Митохондрии выделяют цитохром С, который в сочетании с различными факторами внутри клетки создает «апоптосому». Это приводит к активации множества различных каспаз, которые в конечном итоге активируют ДНКазы. Фрагментированные клетки удаляются путем фагоцитоза. Во время поздних фаз клеточной гибели гены, кодирующие супероксиддисмутазу и каталазу, подавляются. Другими словами, апоптоз происходит на очень низких уровнях, а опосредованная ферментами лизосомальная деградация происходит на высоких уровнях. Активные формы кислорода и катепсины вызывают лизосомально-опосредованную гибель клеток.[3]
Активные формы кислорода и катепсины вызывают лизосомально-опосредованную гибель клеток.[3]
Биохимический
В руке есть три оси развития, и их определяет биохимическая роль различных факторов. Рост и дифференцировка конечности прогрессируют проксимодистально для удлинения конечности, переднезадним образом, который определяет преаксиальную и постаксиальную ориентацию, и дорсовентральным образом, который обеспечивает дорсальную и ладонную ориентацию. Переднезадняя ось опосредована зоной поляризующей активности, которая секретирует белок Sonic hedgehog (Shh). Это устанавливает лучевую и локтевую стороны конечности и является первой осью, которая развивается. Дорсовентральная ось изучена не так хорошо. Он продуцирует белок, называемый членом семейства 7a сайта интеграции вируса опухоли молочной железы бескрылого типа мыши (Wnt-7a). Этот белок индуцирует транскрипцию фактора транскрипции гомеобокса фактора LIM (Lmx1), который необходим для дорсализации зачатка конечности. Когда это происходит, на вентральной стороне возникает петля отрицательной обратной связи.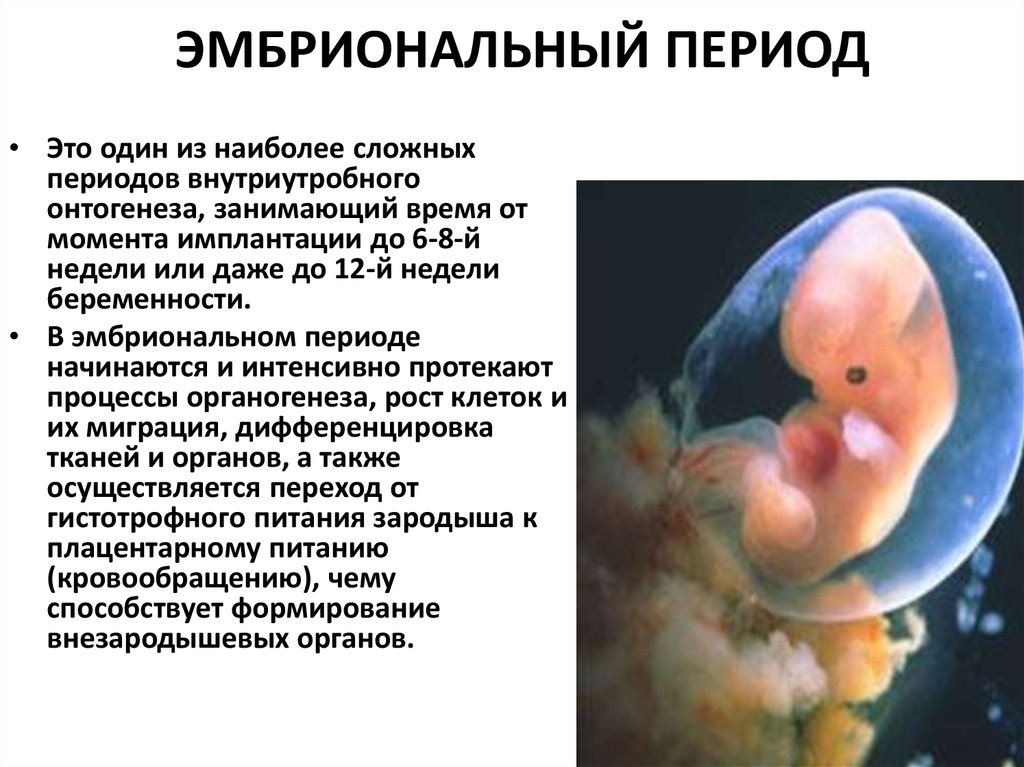 Фактор транскрипции engrailed-1 (En-1) ингибирует экспрессию Wnt-7a. Это устанавливает ладонные и тыльные аспекты руки. Апикальный эпидермальный гребень опосредует проксимодистальную ось. Этот утолщенный гребень секретирует несколько факторов роста фибробластов, которые дифференцируют зачаток конечности. Это способствует удлинению конечности и развивается в последнюю очередь.
Фактор транскрипции engrailed-1 (En-1) ингибирует экспрессию Wnt-7a. Это устанавливает ладонные и тыльные аспекты руки. Апикальный эпидермальный гребень опосредует проксимодистальную ось. Этот утолщенный гребень секретирует несколько факторов роста фибробластов, которые дифференцируют зачаток конечности. Это способствует удлинению конечности и развивается в последнюю очередь.
Молекулярный
На молекулярном уровне белковые факторы, такие как лиганды, рецепторы и транскрипционные факторы, играют решающую роль в развитии конечностей. Sonic hedgehog (Shh) и факторы роста фибробластов являются специфическими лигандами и играют важную роль в передаче клеточных сигналов. Эти факторы-лиганды индуцируют дифференцировку и пролиферацию популяций соседних клеток в зарождающейся конечности. Эти лиганды стимулируют передачу сигнала, вызывая структурные и функциональные изменения в поведении клеток. Это заставляет факторы транскрипции перемещаться в ядро клетки и создавать новую ДНК.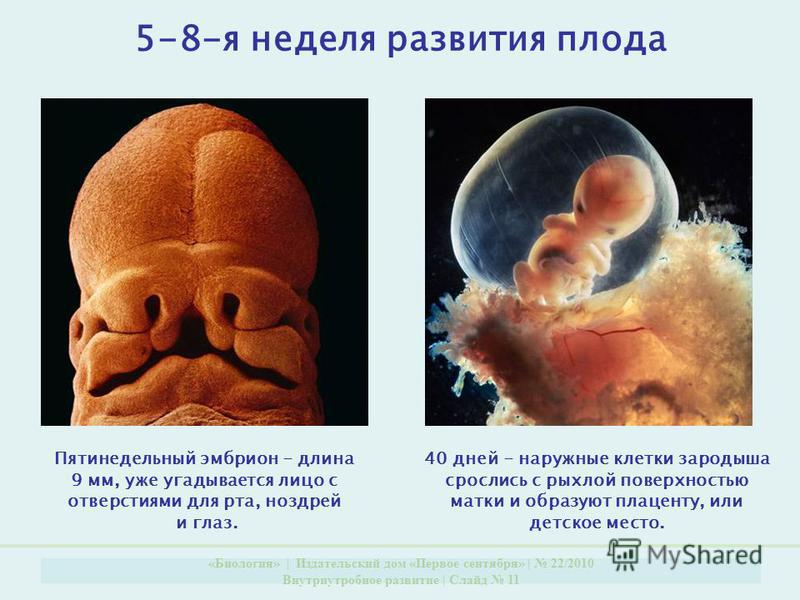 [5] Оба эти фактора приводят к экспрессии новых генов. Исследования продолжают уточнять частично понятые механизмы молекулярной биологии развивающейся руки.
[5] Оба эти фактора приводят к экспрессии новых генов. Исследования продолжают уточнять частично понятые механизмы молекулярной биологии развивающейся руки.
Функция
Рука состоит из сухожилий, связок и костей. Всего 27 костей, из них 14 в фалангах пальцев, пять пястных костей и восемь костей запястья. Кости в руке расположены и связаны связками. Сухожилия — это то, что вставляет мышцу в кости, и они делятся на компоненты сгибателей и компоненты разгибателей. Сухожилия сгибателей расположены на ладонной стороне кисти, а сухожилия разгибателей — на тыльной стороне кисти. Двигательная и сенсорная функции кисти опосредованы срединным, локтевым и лучевым нервами. Срединный нерв иннервирует мышцы тенара, червеобразные мышцы указательного и среднего пальцев, локтевой нерв иннервирует все остальные внутренние мышцы кисти. Неисправность любого из этих компонентов руки может привести к травме или износу, что в конечном итоге приводит к снижению функциональности и инвалидности.[6]
Механизм
Нервы, воздействующие на мышцы, регулируют функции и механизмы руки. Ниже приведены мышцы, нервы и механизмы действия, создаваемые их комбинацией.
Ниже приведены мышцы, нервы и механизмы действия, создаваемые их комбинацией.
Мышцы Тенара
Opponens pollici s
Механизм: Противопоставление большого пальца
Нерв: Возвратная ветвь срединного нерва (C8, T1)
Короткий похититель большого пальца
Механизм: Отведение большого пальца
Нерв: Возвратная ветвь срединного нерва (C8, T1)
Короткий сгибатель большого пальца
Механизм: Сгибание большого пальца
Нерв: Возвратная ветвь срединного нерва (C8, T1)
Аддукторный отсек
Приводящая мышца большого пальца
Механизм: Приведение большого пальца
Нерв: Глубокая ветвь локтевого нерва (C8, T1)
Мышцы гипотенара
Минимальный похититель пальцев
Механизм: Отведение мизинца
Нерв: Глубокая ветвь локтевого нерва (C8, T1)
Короткий сгибатель пальцев
Механизм: Сгибание мизинца
Нерв: Глубокая ветвь локтевого нерва (C8, T1)
Цифровые минимальные противники
Механизм: Противопоставление мизинца
Нерв: Глубокая ветвь локтевого нерва (C8, T1)
Короткие мышцы
червеобразные
Механизм: Сгибание пястно-фаланговых суставов с разгибанием межфаланговых суставов
Нерв: срединный нерв (C8, T1) для двух латеральных червеобразных отростков, глубокая ветвь локтевого нерва (C8, T1) для двух медиальных червеобразных отростков
Спинной межкостной
Механизм: Отведение второго, третьего и четвертого пальцев
Нерв: Глубокая ветвь локтевого нерва (C8, T1) Ладонная межкостная
Механизм: Приведение второго, третьего и четвертого пальцев
Нерв: глубокая ветвь локтевого нерва (C8, T1)[7]
Тестирование
Для построения карты апикального эктодермального гребня использовались маркеры флуоресцентных клеток.
 Клетки, расположенные в задней области, дают начало эктодермальному гребню, а клетки передней области покидают гребень по мере дистального роста почки. Ретиноевая кислота может быть использована для изменения нормального развития апикального гребня для создания зеркальной дупликации. Эксперименты по маркировке также продемонстрировали, что клетки нижележащей мезенхимы не выстраиваются на одной линии с гребнем, поскольку он расширяется в переднем направлении.[8] Будущие исследования, посвященные эпителию, имеют фундаментальное значение из-за решающей роли, которую он играет в развитии органов.
Клетки, расположенные в задней области, дают начало эктодермальному гребню, а клетки передней области покидают гребень по мере дистального роста почки. Ретиноевая кислота может быть использована для изменения нормального развития апикального гребня для создания зеркальной дупликации. Эксперименты по маркировке также продемонстрировали, что клетки нижележащей мезенхимы не выстраиваются на одной линии с гребнем, поскольку он расширяется в переднем направлении.[8] Будущие исследования, посвященные эпителию, имеют фундаментальное значение из-за решающей роли, которую он играет в развитии органов.Патофизиология
В эмбриональный период беременности территории конечностей сначала определяются в правильном положении вдоль цефалокаудальной оси. Зачаток конечности вырастает из тела в виде мезенхимальной клеточной массы, покрытой эктодермой. Идентичность, положение и масса клеток зависят от экспрессии генов Hox.[9]
Первая категория пороков развития конечностей – нарушение формирования, то есть задержка развития определенной части конечности.
 К поперечным дефицитам относятся все врожденные ампутации, такие как плечевые, плечевые, предплечье, запястные, пястные и фаланговые клинические образования. К продольным дефектам относятся все дефекты скелетных конечностей, не включенные в поперечные, такие как фокомелии. Они могут варьироваться от частичного до полного отсутствия. Вторая категория пороков развития конечности — нарушение дифференцировки, которое определяется как развившаяся основная единица конечности, но ее окончательная форма развита не полностью. Примером этого является синдактилия или неполное разделение соседних пальцев. Третья категория — дупликация, возникающая в результате повреждения апикального эктодермального гребня во время развития. Примером этого является полидактилия. Четвертая категория известна как чрезмерный рост, который представляет собой ненаследственное врожденное увеличение. Обычно это проявляется в цифрах. Пятая категория обозначается как гипоплазия или недоразвитие, при котором наблюдается неполный рост в течение внутриутробного периода.
К поперечным дефицитам относятся все врожденные ампутации, такие как плечевые, плечевые, предплечье, запястные, пястные и фаланговые клинические образования. К продольным дефектам относятся все дефекты скелетных конечностей, не включенные в поперечные, такие как фокомелии. Они могут варьироваться от частичного до полного отсутствия. Вторая категория пороков развития конечности — нарушение дифференцировки, которое определяется как развившаяся основная единица конечности, но ее окончательная форма развита не полностью. Примером этого является синдактилия или неполное разделение соседних пальцев. Третья категория — дупликация, возникающая в результате повреждения апикального эктодермального гребня во время развития. Примером этого является полидактилия. Четвертая категория известна как чрезмерный рост, который представляет собой ненаследственное врожденное увеличение. Обычно это проявляется в цифрах. Пятая категория обозначается как гипоплазия или недоразвитие, при котором наблюдается неполный рост в течение внутриутробного периода. Последняя категория включена, но считается отдельной сущностью. Это врожденное сужение конечности из-за бинтов, что приводит к последующей потере части.[1]
Последняя категория включена, но считается отдельной сущностью. Это врожденное сужение конечности из-за бинтов, что приводит к последующей потере части.[1]Клиническое значение
Тесная связь между структурой и функцией руки представляет собой препятствие при подходе к хирургической коррекции аномалий. Во время хирургического планирования функциональное восстановление должно превалировать над структурной коррекцией. Цели состоят в том, чтобы улучшить функцию, сохранить косметику и ограничить осложнения, которые могут ухудшить состояние пациента в долгосрочной перспективе. Хирург должен сбалансировать функциональные, косметические и культурные цели, которые совпадают с пациентом и родителями, а также с показанной хирургической техникой. Это приводит к удовлетворенности пациентов и улучшению результатов.
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Ссылки
- 1.
Van Heest AE. Врожденные аномалии кисти и верхней конечности. Педиатр Клин Норт Ам. 1996 г., октябрь; 43 (5): 1113-33. [PubMed: 8858076]
- 2.
Лакруа Б., Вольф-Кено М.Дж., Хаффен К. Ранняя морфология рук человека: оценка возраста плода. Ранний Хам Дев. 1984 февраля; 9 (2): 127-36. [PubMed: 6714133]
- 3.
Аль-Каттан ММ. Новый взгляд на формирование нормальных межпальцевых промежутков в руке: значение для патогенеза синдактилии у людей и экспериментальных животных. J Hand Surg Eur Vol. 2014 июнь; 39 (5): 491-8. [PubMed: 23719174]
- 4.
Sammer DM, Chung KC. Врожденные различия рук: эмбриология и классификация. Рука Клин. 2009 май; 25 (2): 151-6. [PubMed: 19380057]
- 5.
Коул П., Кауфман Ю., Хатеф Д.А., Холлиер Л.Х. Эмбриология кисти и верхней конечности. J Craniofac Surg. 2009 июль; 20 (4): 992-5. [PubMed: 19553860]
- 6.


 Клетки, расположенные в задней области, дают начало эктодермальному гребню, а клетки передней области покидают гребень по мере дистального роста почки. Ретиноевая кислота может быть использована для изменения нормального развития апикального гребня для создания зеркальной дупликации. Эксперименты по маркировке также продемонстрировали, что клетки нижележащей мезенхимы не выстраиваются на одной линии с гребнем, поскольку он расширяется в переднем направлении.[8] Будущие исследования, посвященные эпителию, имеют фундаментальное значение из-за решающей роли, которую он играет в развитии органов.
Клетки, расположенные в задней области, дают начало эктодермальному гребню, а клетки передней области покидают гребень по мере дистального роста почки. Ретиноевая кислота может быть использована для изменения нормального развития апикального гребня для создания зеркальной дупликации. Эксперименты по маркировке также продемонстрировали, что клетки нижележащей мезенхимы не выстраиваются на одной линии с гребнем, поскольку он расширяется в переднем направлении.[8] Будущие исследования, посвященные эпителию, имеют фундаментальное значение из-за решающей роли, которую он играет в развитии органов. К поперечным дефицитам относятся все врожденные ампутации, такие как плечевые, плечевые, предплечье, запястные, пястные и фаланговые клинические образования. К продольным дефектам относятся все дефекты скелетных конечностей, не включенные в поперечные, такие как фокомелии. Они могут варьироваться от частичного до полного отсутствия. Вторая категория пороков развития конечности — нарушение дифференцировки, которое определяется как развившаяся основная единица конечности, но ее окончательная форма развита не полностью. Примером этого является синдактилия или неполное разделение соседних пальцев. Третья категория — дупликация, возникающая в результате повреждения апикального эктодермального гребня во время развития. Примером этого является полидактилия. Четвертая категория известна как чрезмерный рост, который представляет собой ненаследственное врожденное увеличение. Обычно это проявляется в цифрах. Пятая категория обозначается как гипоплазия или недоразвитие, при котором наблюдается неполный рост в течение внутриутробного периода.
К поперечным дефицитам относятся все врожденные ампутации, такие как плечевые, плечевые, предплечье, запястные, пястные и фаланговые клинические образования. К продольным дефектам относятся все дефекты скелетных конечностей, не включенные в поперечные, такие как фокомелии. Они могут варьироваться от частичного до полного отсутствия. Вторая категория пороков развития конечности — нарушение дифференцировки, которое определяется как развившаяся основная единица конечности, но ее окончательная форма развита не полностью. Примером этого является синдактилия или неполное разделение соседних пальцев. Третья категория — дупликация, возникающая в результате повреждения апикального эктодермального гребня во время развития. Примером этого является полидактилия. Четвертая категория известна как чрезмерный рост, который представляет собой ненаследственное врожденное увеличение. Обычно это проявляется в цифрах. Пятая категория обозначается как гипоплазия или недоразвитие, при котором наблюдается неполный рост в течение внутриутробного периода. Последняя категория включена, но считается отдельной сущностью. Это врожденное сужение конечности из-за бинтов, что приводит к последующей потере части.[1]
Последняя категория включена, но считается отдельной сущностью. Это врожденное сужение конечности из-за бинтов, что приводит к последующей потере части.[1]